不典型强直性脊柱炎1例报道及文献复习
王先堃,曹筱燕,刘 伟△
(1.西南医科大学附属第一医院风湿免疫科,四川泸州 646000;2.西南医科大学人文管理学院,四川泸州 646000)
强直性脊柱炎(ankylosing spondylitis,AS)是一种影响1%人群的慢性非感染性疾病。作为最为严重的骨关节病变之一,AS影响脊柱关节和骶髂关节,导致难以忍受的疼痛及活动性的丧失[1]。
1 临床资料
患者,男,20岁,因“左侧腰骶部疼痛1+个月,反复发热20+d,加重10+d”于2017年4月15日入院。患者1+个月前摔伤后出现左侧骶髂关节疼痛,伴周围臀部、股内侧肌肉疼,遂至外院骨伤科就诊,考虑诊断“左侧梨状肌综合征?”,入院后予以抗炎止痛、营养神经等对症治疗。患者诉臀部肌肉疼痛缓解,但左侧骶髂关节疼痛仍明显,故建议转至上级医院治疗。随后患者遂入某上级医院治疗,考虑诊断为“AS?”,院外短期服用药物(具体不详)缓解后停药。20+d前,患者无明显诱因出现左侧骶髂关节疼痛,伴高热,体温39.0 ℃,不伴畏寒、寒战、咳嗽、咳痰等不适,于当地医院治疗后缓解(具体诊治不详),后反复发热,多于下午及夜间发热,体温中到高热,可自行消退,性质同前。10+d上诉症状加重,出现右侧腰骶部疼痛、右膝关节疼痛,伴右膝关节肿胀、晨僵、活动后受限、午后潮热盗汗,不伴肌萎缩、关节畸形、面部红斑、脱发、光过敏、口腔溃疡、雷诺现象等,关节疼痛活动后减轻,休息后加重,并逐渐出现行走困难,反复多家医院就诊效果欠佳,为求进一步诊治入本院。患者自发病以来,食欲正常,睡眠稍差,大小便正常,体质量明显减轻。个人史中自述5年吸烟史,6~7支/天。无家族相关遗传病史。查体:Schober试验阳性,胸廓活动度减少,指地试验阳性,直腿抬高试验阳性,双侧4字试验阳性,脊柱无侧凸、前凸、后凸畸形,无压痛、叩击痛,双膝关节肿胀、压痛、皮温升高,浮髌试验阳性,以左侧为甚。余查体未见异常。辅助检查:盆部磁共振成像(MRI,外院)提示左侧髂骨及骶髂关节骨面水肿、骨挫伤。C反应蛋白 83.32 mg/L、血沉91 mm/h(外院),HLA-B27阳性。入院诊断“AS?”。
入院后,予患者塞来昔布胶囊200 mg每天2次口服治疗,2 d后患者症状无缓解,再次出现发热,体温波动在38.0 ℃和38.9 ℃之间,伴有干咳、夜间盗汗,并且出现双肩关节、双肘关节疼痛伴压疼,考虑上述情况,结核可能性不能排除,拟抽取关节液做细菌培养鉴定、结核分枝杆菌芯片检测、结核感染T细胞(TB-IGRA)检测,痰查细菌、真菌、抗酸杆菌,查胸部CT、结核杆菌PCR、骶髂关节磁共振。相关结果回示,白细胞计数10.63×109/L,中性粒细胞率73.3%,红细胞沉降率120 mm/h,大便隐血弱阳性,结核菌脂阿拉伯甘露聚糖抗体阴性,C反应蛋白174.10 mg/L,类风湿因子17.0 IU/mL,碱性磷酸酶228.7 U/L。痰查细菌、真菌、抗酸杆菌阴性。胸部CT提示:左肺上叶前段钙化灶、纵隔及左肺门多发淋巴结钙化、双肺胸膜增厚、肝右叶钙化灶。骶髂关节磁共振成像提示(图1):左侧骶髂关节、右侧骶髂关节髂面骨髓水肿,双侧骶髂关节间隙稍变窄,底尾部软组织肿胀、盆腔内少许积液。结合上诉症状与实验室检查,结核感染排除,考虑由AS引发上述症状的可能性大。由于塞来昔布效果欠佳,换用双氯芬酸钠缓释胶囊50 mg每天2次口服治疗后,患者体温降至正常,关节肿痛明显好转。4 d后,患者出现胃肠道不适,体温再次波动在36.7 ℃和38.5 ℃之间,考虑胃肠道反应与双氯芬酸钠缓释胶囊不良反应有关,加用注射用奥美拉唑40 mg每天1次,铝镁加混悬液15 mL每天3次口服治疗。

左侧骶髂关节、右侧骶髂关节髂骨面内斑片状高STIR信号影,关节间隙稍变窄
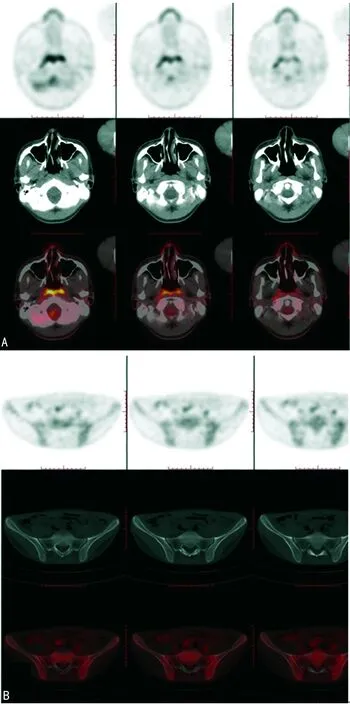
A:鼻咽喉壁及双侧壁显像剂摄取增高,SUVmax约5.3,同机CT示相应部位未见明显异常;B:双侧骶髂关节面局部骨质毛糙、模糊、硬化,局部呈锯齿状改变,双侧骶髂关节间隙稍变窄,显像剂摄取增高,SUVmax约3.0
患者胃肠道反应仍较重,将注射用奥美拉唑改为雷贝拉唑,患者胃肠道症状有所缓解。考虑患者反复发热,不排除与本病有关,加用益赛普25 mg,每周2次,皮下注射,共2次,因患者使用双氯芬酸钠后胃肠道反应大,再次改为塞来昔布,并加用柳氮磺吡啶,经治疗后患者体温及关节肿痛症状曾一度缓解,但又再次发热。体温波动在38.0 ℃和39.3 ℃之间,查体发现双膝关节肿痛,双肩关节、双肘关节红肿伴压疼,右足第5跖趾关节红肿、压痛,双侧4字试验、左膝关节浮髌试验阳性,腹股沟可扪及单个质软、活动、直径为0.5 cm×0.5 cm淋巴结,肿瘤可能性不能排除,行PET-CT及发射型计算机断层扫描仪(ECT)检查。PET-CT提示:双侧骶髂关节面局部骨质粗糙、模糊、硬化,局部呈锯齿状改变,双侧骶髂关节间隙变窄,糖代谢稍增高,AS待排,双肘、肩关节周围糖代谢增高,考虑炎性病变;咽后壁及双侧壁糖代谢增高,同机CT示相应部位未见明显异常;左肺上叶钙化,纵隔及肺门多发淋巴结钙化;双侧颈动脉鞘区、大腿根部多发淋巴结显示,部分增大伴有糖代谢增高。躯干骨及四肢骨近端骨髓分布糖代谢稍增高(图2)。ECT:未见异常。根据上诉结果,考虑鼻咽癌不能排除,进行鼻咽喉镜检查。鼻咽喉镜提示:未见异常。结合上诉检查,排除鼻咽癌,但大腿淋巴结未处理,随访中。考虑患者益赛普效果欠佳,换成阿达木单抗治疗,余治疗同前。经上诉治疗后,患者体温降至正常,患者关节肿痛明显缓解。以“发热待诊:AS?肿瘤?”出院。2个月随访,患者症状明显改善,未诉发热及关节肿痛。
2 讨 论
2.1病史特点 该例患者有创伤史,以骶髂关节疼痛作为首发症状起病,不伴有发热,考虑诊断为AS,使用塞来昔布治疗,症状加重,出现外周多个关节肿痛及按压痛,呈现持续发热状态,体温高达38.9 ℃,考虑到AS发热多为低热,且对称性外周大关节、小关节受累少见,故进行结核感染的相关检查,结果示排除结核感染。更改为双氯芬酸钠治疗及柳氮磺治疗,患者症状一度好转,但无明显诱因下,上诉症状加重,考虑强直性脊柱炎的病情转归于此不相符合,考虑是否为肿瘤所致,行PET-CT及ECT检查,结果提示鼻咽部可疑病变及大腿根部多发淋巴结,结合鼻咽喉镜检查,排除鼻咽部病变。结合上诉检查,考虑发热等症状由AS引发的可能性大,将肿瘤坏死因子受体-抗体融合蛋白换成阿达木单抗治疗,患者关节肿痛明显好转,体温正常。
2.2AS病因与诱因 遗传因素在其发病过程中起着主导作用。其中HLAB27异常在发病过程中起着重要作用[1]。并且近年来感染因素在AS发病过程中也得到了部分的证实,其中肺炎克雷伯菌、衣原体、沙门菌、志贺杆菌等肠道革兰阴性菌被证明与AS发病有关[2]。但本例患者发病前无异常,在一次创伤后出现上诉症状,但现没有相应研究证明创伤可以诱发AS发生,或者是其病因。该点可以在以后进一步研究。
2.3AS临床表现 AS典型表现如下。(1)关节症状:起病较隐匿,反复发作,慢性腰疼、夜间疼、活动后缓解,晨僵,常见肩关节及髋关节关节炎。(2)关节外表现:全身症状(低热、盗汗、乏力、消瘦)、急性虹膜炎、心血管症状(主动脉关闭不全、二尖瓣脱垂等)、肺大疱、神经肌肉改变[2]。
2.4AS合并发热 发热是指在致热源作用下使体温调定点上移所导致的体温升高[3]。发热机制涉及发热激活物(外致热源、免疫复合物、类固醇等),内生致热源[白细胞介素(IL)-1、肿瘤坏死因子(TNF)、干扰素(IFN)、IL-6、单核细胞炎性蛋白(MIP)-1等][4]。AS是一种与HLA-B27相关的自身免疫性疾病,同样涉及IL-17、IL-23、TNF、INF-γ,故AS临床表现中涉及发热[5-6]。而单纯由于AS而导致的发热,根据现有文献报道,基本上都为低热,不会有中高热发生,具体机制不详。故当AS发生中高热时,一定要排除其他原因。结合案例,患者为青年男性,中到重度发热,伴有午后潮热、出汗、多关节肿痛,较短时间内出现体质量明显减轻,查体可扪及腹股沟区淋巴结,对非甾体消炎镇痛药(NSAIDs)反应不佳,应考虑结核等感染及肿瘤因素。结核病是一种由结核杆菌感染后导致机体迟发型超敏反应的疾病,表现为低热,当出现重度肺炎可表现为中高热[7]。目前诊断手段包括胸片、胸部CT、PDD/T-spot.TB、痰液抗酸杆菌检查、痰培养检查,根据该患者的检查,排除结核感染。患者腹股沟可扪及较小的淋巴结,考虑发热与肿瘤相关。PET-CT为正电子发射断层成像与计算机断层成像术相结合技术,弥补了PET缺乏相关解剖位置对照的缺陷。该技术对全身肿瘤的显像具有较大优势[8]。结果提示患者鼻咽部代谢增高,腹股沟多发淋巴结显像伴部分糖代谢增高,行鼻咽部活检,未见异常,淋巴结肿大随访。经1个月的随访结果,患者异常淋巴结未进展,且患者病情明显好转,考虑患者反复发中高热由AS导致。而其中的机制还不完全清楚,尚待进一步研究。
2.5AS伴有多关节不适 AS影响脊柱关节和骶髂关节为主,可累计外周大关节,下肢明显多于上肢关节受累,多呈现非对称性[1]。该病例中出现了除了中轴骨以外的多发关节受累,其中包括了对称性膝、肘、踝关节,以及左第5跖趾关节,考虑到AS的典型临床表现,上述症状可能为风湿关节病所致,筛查了患者抗突变型瓜氨酸波形蛋白(MCV)抗体、类风湿因子、抗链球菌溶血素O,结果回示无明显异常。结合以上检查,可以判定该病例的多关节不适由AS所致。查阅相关文献,发现这个表现在AS中非常罕见,国内几乎没有报道过,Pubmed上鲜见相关报道。
2.6AS治疗 由于AS的发病机制尚不完全清楚,故在治疗上仍有较大的局限。现提倡非药物治疗、药物治疗及手术治疗结合的综合治疗[9]。
非药物治疗包括:局部理疗、功能锻炼、中医非药物疗法等。魏艳林等[9]对运动疗法联合重组人Ⅱ型肿瘤坏死因子受体融合蛋白治疗AS进行了研究,结果表明使用二者联合治疗的短期疗效明显高于单用重组人Ⅱ型肿瘤坏死因子受体融合蛋白治疗,在长期疗效中更加优于单一治疗。黄宏伟[10]对生物制剂结合心理咨询、运动疗法、护理干预进行研究,发现其临床疗效也得到进一步提高。上诉研究也证明了非药物治疗的重要性,而临床治疗中医务工作者及患者往往忽视了这一部分。
药物治疗包括了如下内容。(1)NSAIDs:提倡单药治疗,剂量可逐渐增加到最大剂量,若症状控制不佳,可考虑更换药物种类。现更多的证据提示NSAIDs除了解热镇痛外,长期使用可能有抑制骨质侵蚀及降低心脏病的风险,改善患者预后作用[11]。(2)柳氮磺吡啶:可减轻晨僵、外周关节炎等症状,同样循证医学证明长期应用有可能抑制骨质破坏,改善脊柱活动性和功能[12]。(3)生物制剂:AS发病机制中涉及多种炎症因子参与,包括了TNF、IL-17、IL-23等,其中TNF作用最关键。益赛普(注射用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白)、阿达木单抗(修美乐,抗TNF的人源化单克隆抗体),就是针对TNF作用的药物。TNF抑制剂能明显改善症状和功能,抑制新骨形成,但使用前得排除结核及乙型肝炎病毒感染[13-14]。
AS本身导致脊柱及骶髂关节破坏,骨质疏松导致骨折,保守治疗效果欠佳时,均可考虑外科手术治疗。
该病案中患者对NSAIDs反应效果不佳,且对于该药物不良反应敏感,对益赛普反应欠佳,对修美乐反应效果良好,病情得到明显控制。经1个月随访,患者病情控制良好,未出现大热,关节疼痛症状。其中具体的机制尚待进一步研究。
经上诉临床表现及实验室检查,考虑该例为不典型AS。从诱发因素看,目前没有研究表明骶髂关节创伤能诱发AS,该方面可进一步深入研究。从临床表现看,当临床上出现AS合并中高热及外周多发关节受累时,除了警惕有无其他并发症,还得考虑AS本身所致。而AS本身所致的中高热及外周多发关节受累的原因,考虑与基因多样性有关,具体机制还有待进一步研究。从治疗疗效看,益赛普治疗效果不如修美乐的原因可能与药物靶点及患者基因多样性有关,具体机制也有待进一步研究。
[1]GHASEMI-RAD M,ATTAYA H,LESHA E,et al.Ankylosing spondylitis:a state of the art factual backbone[J].World J Radiol,2015,7(9):236-252.
[2]MARTINEZ A,PACHECO-TENA C,VAZQUEZ-MELLADO J,et al.Relationship between disease activity and infection in patients with spondyloarthropathies[J].Ann Rheum Dis,2004,63(10):1338-1340.
[3]FELDTKELLER E,BRUCKEL J,KHAN M A.Scientific contributions of ankylosing spondylitis patient advocacy groups[J].Curr Opin Rheumatol,2000,12(4):239-247.
[4]OGOINA D.Fever,fever patterns and diseases called′fever′-a review[J].Infect Public Health,2011,4(3):108-124.
[4]LIU X,TANG Y P,LIU R,et al.Antipyretic and anti-inflammatory activities of Thais luteostoma extracts and underlying mechanisms[J].Chin J Nat Med,2015,13(3):192-198.
[6]ZAMBRANO-ZARAGOZA J F,AGRAZ-CIBRIAN J M.Ankylosing spondylitis:from cells to genes[J].Int J Inflam,2013:501653.
[6]CLIFF J M,KAUFMANN S H,MCSHANE H.The human immune response to tuberculosis and its treatment:a view from the blood[J].Immunol Rev,2015,264(1):88-102.
[7]周丽丽,郑旋,彭友霖.PET-CT的成像原理及其临床应用[J].系统医学,2017,2(2):162-164.
[8]MOON K H,KIM Y T.Medical treatment of ankylosing spondylitis[J].Hip Pelvis,2014,26(3):129-135.
[9]魏艳林,吕青,李秋霞,等.运动疗法联合重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白治疗强直性脊柱炎的临床疗效[J].中山大学学报(医学科学版),2015,36(1):6-11.
[10]黄宏伟.强直性脊柱炎生物制剂治疗中的综合护理干预[J].实用临床医药杂志,2015,19(2):40-43.
[11]TSAI W C,OU T T,YEN J H,et al.Long-term frequent use of non-steroidal anti-Inflammatory drugs might protect patients with ankylosing spondylitis from cardiovascular diseases:a nationwide casecontrol study[J].PLoS One,2015,10(5):e0126347.
[12]徐秀颖.柳氮磺吡啶治疗强直性脊柱炎的系统评价[D].福州:福建医科大学,2014.
[13]SIEPER J,VAN DER HEIJDE D,DOUGADOS M,et al.Early response to adalimumab predicts long-term remission through 5 years of treatment in patients with ankylosing spondylitis[J].Ann Rheum Dis,2012,71(5):700-706.
[14]FANG Y,LI L J,WANG R,et al.Population pharmacokinetics of rhTNFR-Fc in healthy Chinese volunteers and in Chinese patients with ankylosing spondylitis[J].Acta Pharmacol Sin,2010,31(11):1500-1507.

