胰岛素抵抗与椎体成形术后新发骨折风险的相关性研究
刘 波,冯大雄
(1.西南医科大学附属医院骨科,四川泸州 646000;2.重庆市九龙坡区第二人民医院骨科 400052)
骨质疏松(osteoporosis,OP)多为与年龄相关的一类骨骼系统退行性疾病,其发病率逐渐增高。骨折为OP的主要并发症,脊柱是其最好发部位[1]。OP性椎体压缩骨折(osteoporotic vertebral compression fracture,OVCF)易引发严重的腰背疼痛,会限制老年患者的日常活动,降低其自理能力,大大增加了患者负担和潜在的社会负担。椎体成形术(percutaneous vertebroplasty,PVP)是目前治疗OVCF最常用的治疗手段,因其微创、快速缓解疼痛的优势,在临床实践中得到了广泛应用[2]。然而近年研究发现,PVP术后患者更容易新发椎体骨折,流行病学统计发现其新发骨折发生率为5.5%~52.0%[3-5]。但导致其术后新发骨折的风险因素目前还未有定论。胰岛素抵抗(insulin resistance,IR)是指机体对一定量的胰岛素生物反应低于正常水平的现象,是2型糖尿病的致病基础。最新研究表明,IR可以抑制骨的重建,从而导致OP和骨折愈合障碍[6]。因此,本研究对IR是否为PVP术后新发骨折的重要风险因素进行研究。

表1 两组一般资料比较
1 资料与方法
1.1一般资料 选取2013年6月至2016年6月在西南医科大学附属医院骨科住院的OVCF患者,纳入患者均接受了PVP手术。该研究方案获得西南医科大学伦理委员会批准,所有患者均签署了知情同意书。所有患者在入院时均需接受双能X射线吸收仪检测骨密度,其T值小于-2.5,诊断为OP。纳入标准如下:≥55岁;胸5至腰5椎体单节段骨折;磁共振成像(MRI)显示为新发骨折,病史在4周内;随访时间至少1年以上;术后均接受了规范抗OP治疗,包括基础治疗钙剂和维生素D,以及一线用药双磷酸盐。排除标准:非原发性OP;非OP引起的椎体病理骨折,如恶性肿瘤、炎症、结核等;椎体爆裂骨折。
新发骨折由随访过程中患者症状和影像学表现确定,一旦患者术后出现持续的腰背痛,同时MRI又显示了强化椎外的椎体内出现了水肿信号即定义为新发骨折。由此将患者分为新发骨折组(new fracture,NF组)和术后无骨折发生的对照组(negative control,NC组)。
1.2方法 收集纳入患者的一般资料。所有患者均抽取清晨空腹静脉血,血糖水平由葡萄糖氧化酶法测定,血浆胰岛素水平采用固相放射免疫法测定。稳态模型-胰岛素抵抗指数(homeostasis model assessment for IR,HOMA-IR)计算公式如下:HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5。将HOMA-IR≥1.73定义为IR[7]。参考文献标准,又将IR患者分为低IR组(<2)、中IR组(2~6)和高IR组(>6)。骨密度由双能X射线吸收仪测定的正位L2~L4椎体平均T值确定。BMI=体质量(kg)/身高(m)2。观察各亚组的HOMA-IR、新发骨折发生率、骨密度T值、BMI值。
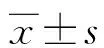
2 结 果
2.1一般资料 该项目初步纳入患者148例,除去不愿意接受PVP手术、失访、死亡等病例,最后共有128例进入了本项研究,随访时间12~54个月,平均(34.5±13.2)个月。随访过程新发骨折患者48例,发生率为37.5%。其中相邻椎体骨折30例(62.5%),非相邻椎体骨折18例(37.5%)。从术后到再发骨折间隔时间,最短为3 d,最长为1 641 d,平均(281.0±69.8)d。其中1个月内新发骨折4例(8.3%),3个月内新发骨折16例(33.3%),1年内新发骨折例数上升至45例(93.8%)。新发椎体骨折48例患者中,30例经历了2次骨折,13例经历了3次骨折,剩余5例患者经历了3次以上骨折。骨折椎体分布情况:胸段(胸10椎以上)4个(8.3%),胸腰段(胸11~腰2椎)32个(66.7%),腰段(腰3椎以下)12个(25.0%)。
2.2两组一般资料比较 NF组和NC组患者性别、年龄和BMI差异无统计学意义(P>0.05),但NF组患者IR的发病率、HOMA-IR值明显高于NC组(P<0.05),而NF组骨密度T值则明显低于NC组(P<0.05),见表1。
2.3各IR亚组比较 从低IR组到高IR组,HOMA-IR值逐渐升高,新发骨折发生率也随之进一步上升,而骨密度T值则明显下降,比较差异有统计学意义(P<0.05);BMI值在3个亚组比较中差异无统计学意义(P>0.05),见表2。
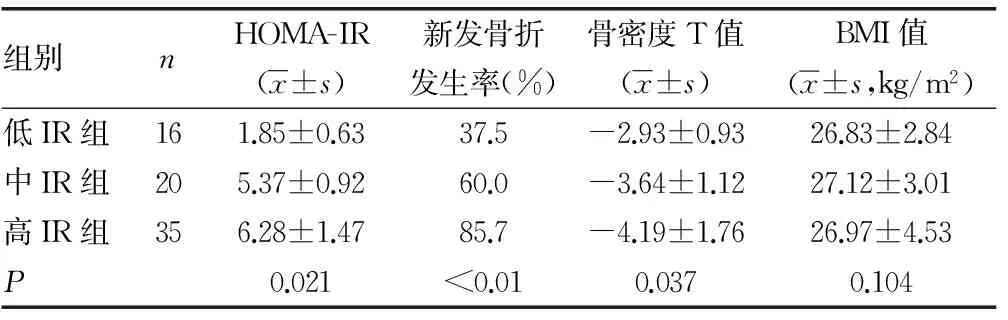
表2 各IR亚组比较
2.4Pearson相关性分析 在校正了年龄和性别等因素后,Pearson相关性分析显示HOMA-IR与骨密度T值呈负相关(r=-0.361,P=0.027),与新发骨折发生率呈正相关(r=0.413,P=0.015),但与BMI值无关联性(r=0.265,P=0.311)。此外骨密度与新发骨折发生率呈负相关(r=-0.149,P=0.081),但BMI与新发骨折发生率无显著相关性(r=-0.518,P=0.634)。
3 讨 论
PVP术后新发骨折发病率各项研究报道差异较大,可能与病例纳入标准、手术操作、随访时间等因素有关。目前认为初次骨折若累及多个椎体是较为明确的再发骨折危险因素[8]。因此本项研究只纳入了单节段椎体骨折患者,规避了由此产生的分析偏倚。尽管OVCF患者需要积极的外科处理以减轻疼痛,但近年的临床实践逐渐意识到其本质仍为OP症引起,因此所有纳入患者在PVP术后均进行了规范的抗OP治疗。但本项研究随访显示,即使实施了抗OP治疗,仍有高达37.5%的患者在PVP术后新发骨折,因此探究其风险因素,降低其发生率有着较强的临床意义。
近年来研究表明,IR是一个慢性亚临床的炎症过程,细胞因子通过内分泌、旁分泌和自分泌等机制降低增殖细胞对胰岛素的敏感性,同时作用于骨细胞,使骨代谢发生相应病理改变[9]。如机体发生IR时,血清中肿瘤坏死因子α(TNF-α)表达量增多,而TNF-α可以促进破骨细胞提前分化、成熟,从而增强骨代谢中骨吸收作用;另外TNF-α也可抑制成骨细胞碱性磷酸酶生成,抑制骨形成和钙化[10]。本研究通过比较发现,NF组中患者IR发病率明显高于NC组,且HOMA-IR值明显升高,通过相关性分析进一步揭示HOMA-IR与骨密度T值呈负相关,说明IR与OP发生密切相关。国内余玲玲等[11]研究同样证实老年男性糖尿病患者IR程度与OP程度呈正相关。因此本课题组推测IR可以作为一个预测PVP术后新发骨折的危险因素。
本研究在各IR亚组分析中发现,随着HOMA-IR值的升高,新发骨折发生率也随之进一步上升,这一结果提示了两者具有相关性,Pearson相关性分析也证实了两者之间呈现正相关。本项研究认为,可以考虑将IR作为PVP术后再发骨折的风险因素。PVP术后再发骨折可能是因为骨水泥的强化作用增强了受伤椎体的弹性模量,使得邻近椎体承受了更大的应力作用;但更为重要的是OP的病理改变,导致了上下椎体骨质量较差,大大增加了骨折风险[12]。尽管本项研究中PVP术后患者均接受了抗OP治疗,但需要注意的是IR对于骨代谢在骨吸收和骨形成两方面均存在影响,而本研究所选用的双磷酸盐类药物只能通过抑制骨吸收从而缓慢地增加骨密度。因此在今后的临床实践中,对于IR的术后患者可以考虑采用促进骨形成的药物,从而快速提高骨密度,降低新发骨折风险。有研究报道低BMI值是PVP术后再发骨折的高危因素[13],但本项研究中BMI与新发骨折发生率未显示相关性,这可能与纳入的病例多数为糖尿病患者有关,基础的BMI值均较高。黄天霁等[14]临床研究同样显示BMI与椎体强化术后再发骨折关系不大。
本项目仍然存在一些不足:(1)单中心样本量较小,势必会造成一些分析偏倚;(2)实验设计之初一些影响再发骨折的风险因素,如骨水泥的注入量、椎体高度、椎体后凸角度等未纳入统计分析,尚未充分探讨IR对于PVP术后新发骨折的影响。
综上所述,IR可参考作为PVP术后患者新发骨折的危险因素,且与骨密度密切相关,是容易导致再发骨折的一个潜在原因,为今后制定PVP术后患者的临床治疗策略提供了新的思路。
[1]MCCARTHY J,DAVIS A.Diagnosis and management of vertebral compression fractures[J].Am Fam Physician,2016,94(1):44-50.
[2]APARISI F.Vertebroplasty and kyphoplasty in vertebral osteoporotic fractures[J].Semin Musculoskelet Radiol,2016,20(4):382-391.
[3]LO Y P,CHEN W J,CHEN L H,et al.New vertebral fracture after vertebroplasty [J].J Trauma,2008,65(6):1439-1445.
[4]CHOSA K,NAITO A,AWAI K.Newly developed compression fractures after percutaneous vertebroplasty:comparison with conservative treatment[J].Jpn J Radiol,2011,29(5):335-341.
[5]TANIGAWA N,KARIYA S,KOMEMUSHI A,et al.Percutaneous vertebroplasty for osteoporotic compression fractures:long-term evaluation of the technical and clinical outcomes[J].AJR Am J Roentgenol,2011,196(6):1415-1418.
[6]TONKS K T,WHITE C P,CENTER J R,et al.Bone turnover is suppressed in insulin resistance,independent of adiposity[J].J Clin Endocrinol Metab,2017,102(4):1112-1121.
[7]FURUHASHI M,URA N,NAKATA T,et al.Insulin sensitivity and lipid metabolism in human CD36 deficiency[J].Diabetes Care,2003,26(2):471-474.
[8]REN H L,JIANG J M,CHEN J T,et al.Risk factors of new symptomatic vertebral compression fractures in osteoporotic patients undergone percutaneous vertebroplasty[J].Eur Spine J,2015,24(4):750-758.
[9]GARBOSSA S G,FOLLI F.Vitamin D,sub-inflammation and insulin resistance.A window on a potential role for the interaction between bone and glucose metabolism[J].Rev Endocr Metab Disord,2017,18(2):243-258.
[10]JAKAB L.Bone tissue:rebuilding and inflammation[J].Orv Hetil,2014,155(40):1575-1583.
[11]余玲玲,吴鸿.老年男性2型糖尿病患者胰岛素抵抗与骨质疏松关系的研究[J].中国骨质疏松杂志,2012,18(5):401-403,419.
[12]LEE D G,PARK C K,PARK C J,et al.Analysis of risk factors causing new symptomatic vertebral compression fractures after percutaneous vertebroplasty for painful osteoporotic vertebral compression fractures:a 4-year follow-up[J].J Spinal Disord Tech,2015,28(10):E578-583.
[13]MAZZANTINI M,CARPEGGIANI P,D′ASCANIO A,et al.Long-term prospective study of osteoporotic patients treated with percutaneous vertebroplasty after fragility fractures[J].Osteoporos Int,2011,22(5):1599-1607.
[14]黄天霁,寇玉辉,殷晓峰,等.椎体强化术后再发椎体骨折的临床特点和危险因素[J].北京大学学报(医学版),2015,47(2):237-241.

