微小RNA-134-5p靶向作用于EGFR对卵巢癌SKOV3和A2780细胞生长的影响
汤继英,陈 萍,蔡晓军,汪选斌,曹风军,张 莉
(湖北医药学院附属人民医院:1.肿瘤中心;2.中药药理实验室,湖北十堰 442000)
表皮生长因子受体(EGFR)信号通路的活化可促进肿瘤细胞周期进展,抑制细胞的凋亡,增强细胞的增殖能力,参与肿瘤的发生、发展[1-3]。有研究表明,miR-134-5p在肺癌中可显著干扰EGFR基因的表达[4]。然而miR-134-5p在卵巢癌细胞中对EGFR信号通路的影响尚未阐明。本研究通过转染miR-134-5p,观察卵巢癌细胞中EGFR信号通路的表达情况及卵巢癌细胞生物学行为的变化。
1 材料与方法
1.1材料 卵巢癌细胞系SKOV3和A2780(中国科学院上海生命科学研究院细胞资源中心);miR-134-5p模拟物(mimics),miR-NC(上海吉凯基因化学技术有限公司合成);DMEM高糖培养基、胎牛血清(美国Gibco公司);lipofectamine 2000(美国Invitrogen公司);qRT-PCR相关试剂(日本TaKaRa公司);引物(上海生物工程股份有限公司,表1);本实验所用抗体均购自美国CST公司;四甲基偶氮唑蓝(MTT,美国Sigma公司);Annexin V-FICT/PI双染细胞凋亡检测试剂盒(上海鑫乐生物科技有限公司)。

表1 qRT-PCR引物序列
1.2方法
1.2.1细胞培养及转染 卵巢癌细胞系SKOV3和A2780贴壁生长于含10%胎牛血清的DMEM高糖培养基中。培养条件为:37 ℃,5%CO2,饱和湿度。对照组转染miR-NC,实验组转染miR-134-5p mimics,具体操作步骤参考lipofectamine 2000转染说明书。
1.2.2qRT-PCR检测 收集细胞,依据TaKaRa试剂盒说明书建立反应体系及参数,以GAPDH为内参,进行qRT-PCR,检测两组细胞中EGFR基因的表达,最终Ct值均以2-ΔΔCt分析。
1.2.3Western blot检测miR-143下游靶基因表达 转染48 h后,收集各组细胞进行细胞裂解提取总蛋白,行10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离蛋白,并转移至硝酸纤维膜上,分别孵育一抗、二抗,发光剂显影。
1.2.4细胞周期实验 转染48 h后,0.25%胰酶消化收集细胞;磷酸盐缓冲液(PBS)洗2次,弃上清液,加入70%乙醇在4 ℃下固定12 h;离心收集细胞,PBS洗2次,加入含RNA酶的PI染液400 μL避光染色1 h,流式细胞仪上机检测。
1.2.5细胞凋亡实验 转染实验后48 h,使用胰酶消化收集细胞,按照Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明书进行操作,流式细胞仪检测。
1.2.6MTT法检测细胞增殖 将转染24 h后的细胞按4 000/孔加入96孔细胞培养板,分别于第1、2、3、4、5天,每孔加MTT 20 μL,培养箱内孵育4 h,小心吸去培养液。每孔加二甲基亚砜150 μL,振荡10 min,使结晶充分溶解。在酶标仪波长490 nm处测定光密度(OD)值。
1.2.7集落形成实验 瞬转后24 h,胰酶消化收集细胞,并计数。6孔板中加入细胞1 000 /孔,摇晃均匀,细胞培养箱内连续培养10 d左右。10 d后观察集落形成情况,并使用结晶紫染色法固定染色细胞,拍照、分析。

2 结 果
2.1miR-134-5p与EGFR mRNA结合位点 miR-134-5p结合于EGFR mRNA的3′UTR(图1),mirSVR评分为-1.0627, PhastCons评分为0.5561。

图1 miR-134-5p与EGFR mRNA3′UTR结合位点
2.2miR-134-5p转染效率检测 qRT-PCR结果显示,与对照组相比,实验组中miR-134-5p的表达明显上升(P<0.01),见图2。
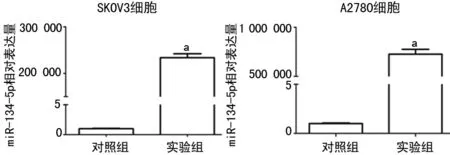
a:P<0.01,与对照组比较
2.3各组细胞中EGFR基因mRNA及蛋白表达 qRT-PCR结果显示,与对照组相比,实验组SKOV3细胞中EGFR mRNA下调至48%(P<0.05),A2780细胞中EGFR mRNA下调至47%(P<0.05)(图3)。Western blot结果显示,与对照组相比,实验组中EGFR蛋白表达降低(P<0.05),见图4。
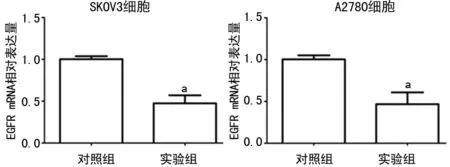
a:P<0.05,与对照组比较
2.4EGFR下游靶蛋白表达 Western blot结果显示,与对照组相比,转染miR-134-5p后的卵巢癌细胞中,EGFR信号通路中的磷酸化表皮生长因子受体(p-EGFR)、磷酸化蛋白激酶B(p-AKT)、磷酸化细胞外调节蛋白激酶(p-ERK1/2)、细胞周期蛋白D1(Cyclin D1)蛋白的表达明显下调(P<0.05),见图4。
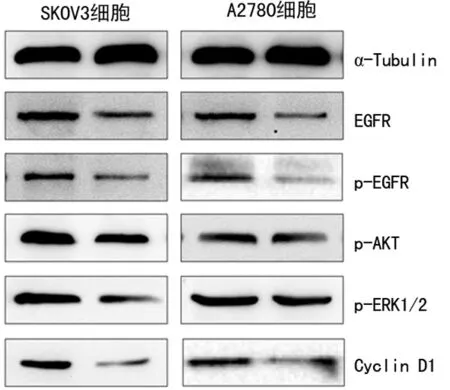
图4 Western blot 检测两组卵巢癌细胞中蛋白的表达
2.5卵巢癌细胞周期和细胞凋亡 流式细胞术检测显示,与对照组相比,实验组中G0/G1期细胞明显增多,G2/M期细胞明显减少,A2780细胞S期细胞明显减少(P<0.05),而SKOV3细胞S期细胞比较差异无统计学意义(P>0.05)(表2)。实验组较对照组凋亡明显增多,比较差异有统计学意义(P<0.01),见表3。

表2 两组卵巢癌细胞的细胞周期结果比较

表3 两组卵巢癌细胞的凋亡率、集落形成能力结果比较
2.6转染miR-134-5p后细胞增殖能力 MTT结果表明,与对照组相比,实验组SKOV3细胞在第4、5天细胞生长明显受到抑制,A2780细胞在第5天的生长抑制有统计学意义(P<0.05),见图5。

*:P<0.05,与对照组比较
2.7转染miR-134-5p后细胞集落形成能力 与对照组相比,实验组的集落少而小,比较差异有统计学意义(P<0.05),见表3,集落形成见图6。

图6 两组卵巢癌细胞形成的集落图
3 讨 论
EGFR属于l型酪氨酸激酶ErbB家族,是一种重要的跨膜受体[5-6]。EGFR可介导细胞的增殖、分化及凋亡,且EGFR的过表达或异常活化与肿瘤的发生、发展密切相关[7]。p-EGFR是EGFR的活性形式,p-EGFR可通过激活下游靶蛋白p-AKT、p-ERK1/2和Cyclin D1的表达,促进肿瘤细胞的增殖、抑制肿瘤细胞的凋亡[8]。RNA干扰是指内源性miRNA或外源性dsRNA通过与细胞内的酶如解旋酶、内切酶、外切酶等结合形成RNA诱导的沉默复合物(RISC)。RISC在转录后水平与靶基因mRNA结合,特异性切割降解mRNA,从而达到干扰靶基因表达的作用[9]。miRNAs是一类内源性非编码 RNA分子,长度为19~25个核苷酸,主要在转录后水平发挥调控作用,参与细胞的增殖、分化、衰老、凋亡等多种功能变化,与各种肿瘤的发生、发展密切相关[10]。miR-134-5p在多种肿瘤的发生、发展中发挥重要作用,抑制多种肿瘤如结食道癌、肝癌、肾癌、乳腺癌等细胞的增殖能力或迁移、侵袭能力[11-13]。有研究表明,肺癌细胞中miR-134-5p可干扰EGFR基因的表达[4];那么miR-134-5p在卵巢癌中是否同样能够干扰EGFR通路的活化,有待进一步研究。
本研究通过Western blot实验发现,转染miR-134-5p后,卵巢癌细胞中EGFG、pEGFR及下游靶蛋白p-AKT、p-ERK1/2和Cyclin D1的表达明显下调。p-AKT和p-ERK1/2异常高表达与肿瘤的形成密切相关[14]。Cyclin D1是细胞增殖周期中的启动因子,通过与CDK4或CDK6结合形成复合物,促进细胞越过G1调控点[15]。本课题组下一步将构建稳定表达miR-134-5p的病毒载体,通过裸鼠荷瘤实验观察miR-134-5p在体内对卵巢癌生长的影响。转录激活因子-5b(STAT5b)是信号转导及转录激活因子的一种,STAT5b的持续或高表达与多种恶性肿瘤的增殖、迁移和侵袭能力密切相关[16]。有研究表明,STAT5b在卵巢癌组织中呈现高表达[17]。本研究通过miRNA靶基因预测网站microRNA.org、TargetScan和miRecords发现STAT5b是miR-134-5p的靶基因,miR-134-5p是否能通过靶向作用于STAT5b发挥抑癌作用值得研究。
本研究表明,miR-134-5p可通过靶向作用于EGFR基因的表达,沉默EGFR信号通路的活化,显著抑制卵巢癌细胞的增殖。miR-134-5p干扰EGFR基因表达的机制研究在未来可能为卵巢癌及其他相关疾病提供一个新型的治疗手段。
[1]MOHYELDIN M M,AKL M R,SIDDIQUE A B,et al.The marine-derived pachycladin diterpenoids as novel inhibitors of wild-type and mutant EGFR[J].Biochem Pharmacol,2017(126):51-68.
[2]MARTINELLI E,MORGILLO F,TROIANI T,et al.Cancer resistance to therapies against the EGFR-RAS-RAF pathway:the role of MEK[J].Cancer Treat Rev,2017(53):61-69.
[3]YANG Q S,JIANG L P,HE C Y,et al.Up-regulation of microRNA-133a inhibits the MEK/ERK signaling pathway to promote cell apoptosis and enhance radio-sensitivity by targeting EGFR in esophageal cancer in vivo and in vitro[J].J Cell Biochem,2017,118(9):2625-2634.
[4]QIN Q,WEI F R,ZHANG J B,et al.miR-134 inhibits non-small cell lung cancer growth by targeting the epidermal growth factor receptor[J].J Cell Mol Med,2016,20(10):1974-1983.
[5]TSIAMBAS E,LEFAS A Y,GEORGIANNOS S N,et al.EGFR gene deregulation mechanisms in lung adenocarcinoma:a molecular review[J].Pathol Res Pract,2016,212(8):672-677.
[6]SINGH D,ATTRI B K,GILL R K,et al.Review on EGFR inhibitors:critical updates[J].Mini Rev Med Chem,2016,16(14):1134-1166.
[7]MENG F,WANG F,WANG L,et al.MiR-30a-5p overexpression may overcome EGFR-inhibitor resistance through regulating PI3K/AKT signaling pathway in non-small cell lung cancer cell lines[J].Front Genet,2016(7):197.
[8]JEDLINSKI A,GARVIN S,JOHANSSON A C,et al.Cetuximab sensitivity of head and neck squamous cell carcinoma xenografts is associated with treatment-induced reduction in EGFR,pEGFR,and pSrc[J].J Oral Pathol Med,2017,46(9):717-724.
[9]SVOBODA P.Renaissance of mammalian endogenous RNAi[J].FEBS Lett,2014,588(15):2550-2556.
[10]LOGAN M,HAWKINS S M.Role of microRNAs in cancers of the female reproductive tract:insights from recent clinical and experimental discovery studies[J].Clin Sci (Lond),2015,128(3):153-180.
[11]KLIMCZAK-BITNER A A,KORDEK R,BITNER J,et al.Expression of MMP9,SERPINE1 and miR-134 as prognostic factors in esophageal cancer[J].Oncol Lett,2016,12(5):4133-4138.
[12]ZHA R,GUO W,ZHANG Z,et al.Genome-wide screening identified that miR-134 acts as a metastasis suppressor by targeting integrin β1 in hepatocellular carcinoma[J].PLoS One,2014,9(2):e87665.
[13]LIU Y,ZHANG M,QIAN J,et al.miR-134 functions as a tumor suppressor in cell proliferation and epithelial-to-mesenchymal transition by targeting KRAS in renal cell carcinoma cells[J].DNA Cell Biol,2015,34(6):429-436.
[14]LIU H,MOROI Y,YASUMOTO S,et al.Expression of insulin-like growth factor-1 receptor,p-AKT and p-ERK1/2 protein in extramammary Paget′s disease[J].Br J Dermatol,2006,155(3):586-591.
[15]GIOACCHINI F M,ALICANDRI-CIUFELLI M,KALECI S,et al.The prognostic value of cyclin D1 expression in head and neck squamous cell carcinoma[J].Eur Arch Otorhinolaryngol,2016,273(4):801-809.
[16]SUMIYOSHI H,MATSUSHITA A,NAKAMURA Y,et al.Suppression of STAT5b in pancreatic cancer cells leads to attenuated gemcitabine chemoresistance,adhesion and invasion[J].Oncol Rep,2016,35(6):3216-3226.
[17]JINAWATH N,VASOONTARA C,JINAWATH A,et al.Oncoproteomic analysis reveals co-upregulation of RELA and STAT5 in carboplatin resistant ovarian carcinoma[J].PLoS One,2010,5(6):e11198.

