表达猪融合IL4/6和抗菌肽重组酵母的构建及对仔猪免疫和生长的影响
胡立博 ,黎 凌 ,马常俊 ,吴雪颖 ,万小平 ,肖永乐 ,熊 旗 ,梁 歌 ,曾 凯 ,李江,吕学斌 ★★,王泽洲 ,高 荣 ★
(1.四川大学生命科学学院,生物资源与生态环境教育部重点实验室,四川省动物疫病预防与食品安全重点实验室,成都 610064;
2.四川省畜牧科学研究院,成都 610066;3.四川省动物疫病控制中心,成都 610035)
中国是世界第一养猪大国,2016年生猪出栏量达6.8亿多头;规模化和集约化养猪场面临多种细菌和病毒性传染病的威胁,给养猪业每年造成数百亿元的巨大经济损失。传统防治方法是接种疫苗和使用抗生素。但是生产实践中因动物应激、免疫抑制等复杂因素影响,经常发生动物免疫接种失败;而抗生素在治疗和在饲料添加剂中过度使用,诱导和增加抗生素耐药性病原菌出现和扩散的风险,同时动物产品药物残留也危害人体健康。目前养猪业迫切需要高效安全的免疫调节生物制剂,能在生长过程中增强动物全面的免疫防御抗病力,减少或消除抗生素添加造成的危害。
白细胞介素是一种结合到特定受体而发挥作用的分泌蛋白,同时是白细胞之间的通信分子。先前的研究表明大量白细胞可以作为疫苗佐剂,并且大多数细胞因子可以使机体增加或是再次获得先天免疫和获得性免疫反应的能力。此外,疫苗佐剂可用于许多复杂疾病的治疗,如艾滋病、手足口病和黑色素瘤。抗菌肽是先天性免疫反应的一部分,已被证明可以杀死革兰氏阴性菌和革兰氏阳性菌、抗病毒、真菌以及癌细胞。因此,细胞因子和抗菌肽可增强动物对传染性病原体的抵抗力。
迄今为止,很少见猪白细胞介素和抗菌肽协同对动物的免疫生物效应研究报道。本实验基于我们以前的研究基础,将IL-2和IL-4/6融合基因与IL-4/6和抗菌肽融合基因分别构建的重组毕赤酵母菌高密度发酵,并拌料饲喂仔猪,定期检测对其生长发育和对免疫机能调节的情况,为研发新型免疫制剂增强动物免疫力和促进动物传染性疾病的防控提供新技术支撑。
1 材料和方法
1.1 材料
重组猪IL-2、4/6(SG246)和猪IL4/6与融合猪抗菌肽(为猪PR-39,Tritrpticin,PAMP23和PG1抗菌活性结构融合肽)重组毕赤酵母SMD1168酵母菌(SG46P):本实验室构建保存。
实验仔猪:28头体重约为7kg的45日龄健康杜大长杂交仔猪,四川省种猪性能测定中心简阳基地提供。
1.2 重组毕赤酵母菌的高密度发酵培养
首先,将-80℃保存的重组毕赤酵母菌解冻,再将30μL菌液分别接种到含有YPD 3mL培养基和100μg/mL Zzeocin(博来霉素,购自Invitrogen公司)的10mL试管中,并在培养箱振荡器中孵育16h(30℃,220rpm)。在含500mL YPD培养基的2000mL摇瓶中接种30mL重组菌液,并在30℃和200rpm下培养14h。
将培养物转移到100L发酵罐中发酵。培养基成分:50g甘油,15g NH4H2PO4,14.9g MgSO4·7H2O,0.53g CaCl2,18.2g K2SO4,1g KH2PO4,2.5g K2HPO4,4.35mL PTM1 微量盐溶液,将其过滤灭菌,并在高压蒸汽灭菌后加入到培养基中。培养条件如下:30℃,搅拌器转150rpm,通过调节搅拌和出气速率将溶解氧(DO)水平保持在20%~30%,通过加入NH4OH将pH维持在5.0~6.0,使用聚醚消泡剂GPE控制发泡。通过在不同时间点测量发酵物OD 600nm来监测生长。两种重组毕赤酵母和空白毕赤酵母各发酵35L。空白发酵菌的发酵条件与上述相同。
1.3 动物实验
本实验中28只仔猪随机分为3组:A1组,A2组和C组,21日龄时分别肌肉注射猪瘟弱毒疫苗和蓝耳病灭活苗(成都药械厂生产)常规免疫;所有仔猪在整个实验期间均进行相同的饲料喂养条件,将发酵液按表1安排连续喂食6周,在实验0、7、14、28和42d,每组随机取5只仔猪各采集3~4mL静脉血样(EDTA抗凝)。
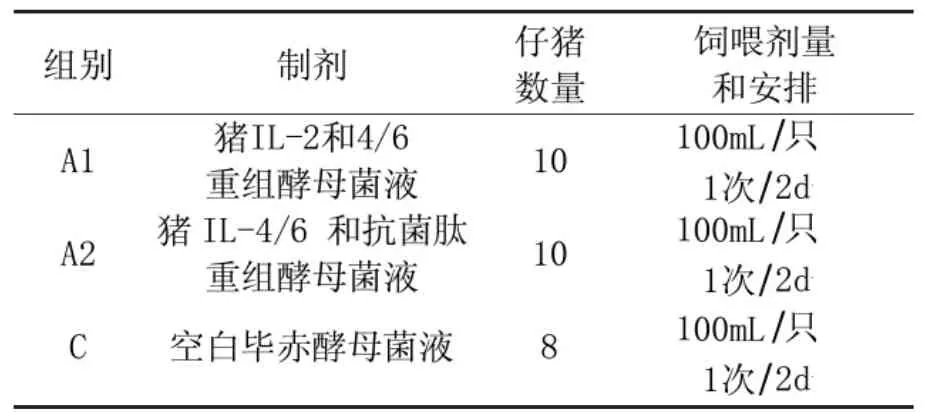
表1动物实验组和饲喂处理组
1.4 仔猪体重
测量仔猪的体重,评估在实验0、14、28和42d时两种不同的重组毕赤酵母发酵液对仔猪生长的影响。
1.5 免疫分析
1.5.1 外周血免疫细胞数量的测定
收集每组仔猪100μL血液样品,用血液自动计数仪器(MIND-RAY BC-3000)测定免疫细胞,血小板和血红蛋白的含量。
1.5.2 T细胞的测定
双色FCM分析:使用小鼠抗猪CD4和CD8抗体,分别用异硫氰酸荧光素(FITC)和R-藻红蛋白(R-PE)标记,购自SouthernBiotech(Birmingham,USA)。照说明书进行标记,以FACScan流式细胞仪(Becton Dickinson)进行分析。
1.5.3 ELISA测定特异性抗体
猪瘟(CSF)抗体和猪繁殖与呼吸综合征(PRRS)抗体ELISA试剂盒购自上海艾丽莎生物科技有限公司(中国),以测定 CSF和PRRS抗体。按照试剂盒上的步骤进行操作分析。
1.5.4 定量实时PCR(qRT-PCR)分析mRNA表达
500μL全血细胞加1mL RNAiso plus裂解后,提取细胞总RNA,再用Tiangen反转录试剂盒逆转录的cDNA,RT-PCR进行检测。根据Gene Bank相关基因设计合成了扩增引物(见表2)。使用iQ5(BIO-RAD)通过qPCR分析每个基因的表达水平,循环条件如下:每次运行初始变性在95℃下3min,然后在95℃下进行42次循环,最佳退火温度下为9s,在72℃下为10s。重复3次检测,以每个样品PPIA基因作参考基因,计算其表达相对水平=2-ΔΔCt。
1.6 统计分析
上述各种实验数据均用SPSS分析进行显著性差异比较,用ANOVA and Tukey分析组间差异,以P<0.05为显著性差异标准。
2 结果
2.1 对猪生长性能的影响
重组酵母制剂对仔猪体重变化的影响如表3和表4所示,A1组和A2组每只仔猪的平均体重分别比C组多出6.89 kg和5.23kg(P<0.05)。实验组(A1和A2)的平均净增重也高于对照组C(P<0.05)。此外,A1制剂增重效应大于A2。

表2 qPCR引物序列表
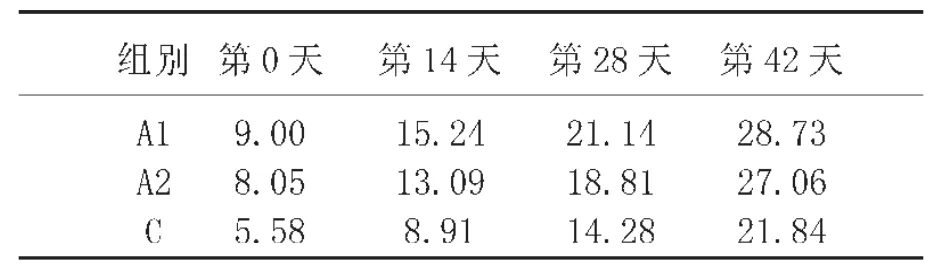
表3 仔猪的平均体重变化

表4 实验仔猪平均净重增长
2.2 外周血中的T细胞
表5看出,在整个实验期间,在14~42d,A1组相对C组外周血CD8+T细胞数显著增加(P<0.05)。而CD4+T细胞14~42d时 A1和A2组明显多于对照 C组(P<0.05),后期各组变化差异较大,规律性不明显。
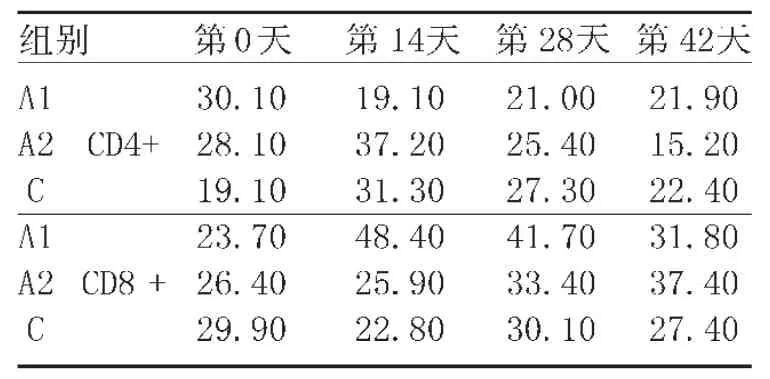
表5猪血液中T细胞数量的变化
2.4 特异性抗体的变化
表6表明,接种后0~42d,A1组和A2组血清中猪瘟特异性抗体和蓝耳病特异性抗体水平比对照组明显增加(P<0.05)。 C组的猪瘟与蓝耳病特异性抗体在整个实验期间变化不大。
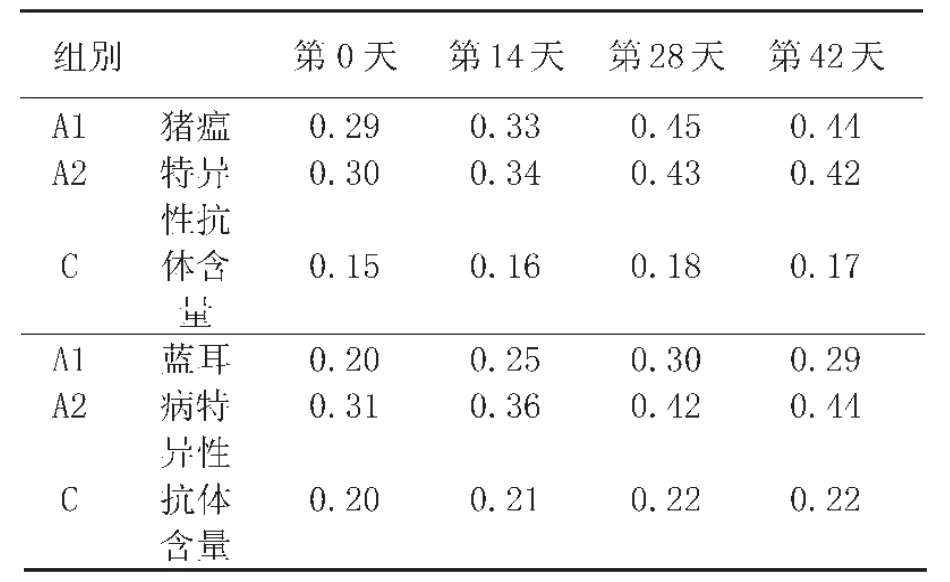
表6血清中猪瘟特异性抗体和蓝耳病特异性抗体的变化
2.5 免疫相关基因的变化
2.5.1 TLR基因的变化
3种TLR基因检测表达量,来观察重组毕赤酵母发酵液制剂对猪的影响。从表7可知,在饲喂后7~28d内,A1、A2组的TLR-2,TLR-4和TLR-7的表达水平明显高于对照组 C(除个别时间点,TLR-7 的 14d)(P<0.05);此外,在 42d时A2的3个TLR基因的表达水平高于A1组和C组(P<0.05)。
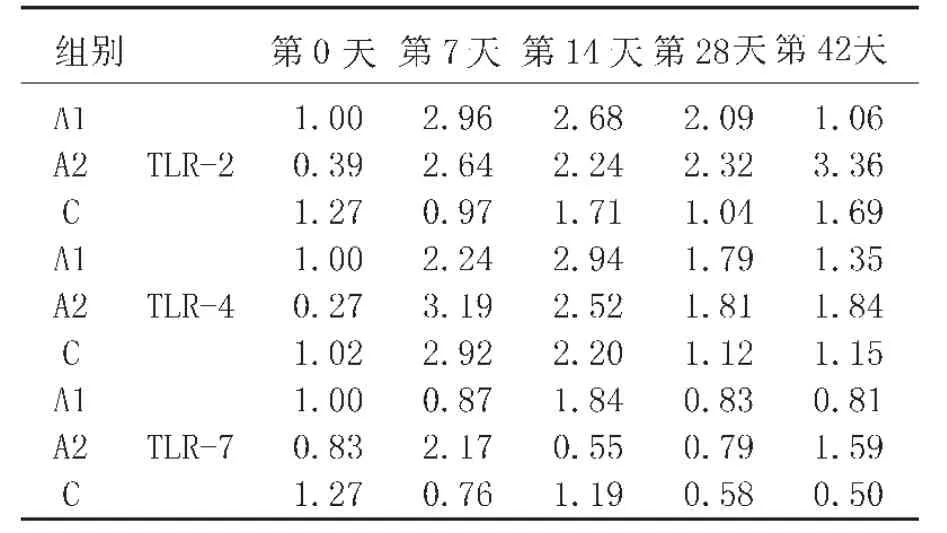
表7 实验仔猪血液样本中TLR基因的变化
2.5.2 免疫信号转导分子相对基因的变化
表8表明实验猪的NF-kB(p50)和Bcl-2的表达水平在实验后期较对照组明显增加(P<0.05),而14d时A2、7d时A1 和对照组 NF-kB(p50)之间没有明显的差异(P>0.05);A2的NF-kB和Bcl-2的表达水平在7d、28~42d高于A1和C组(P<0.05)。
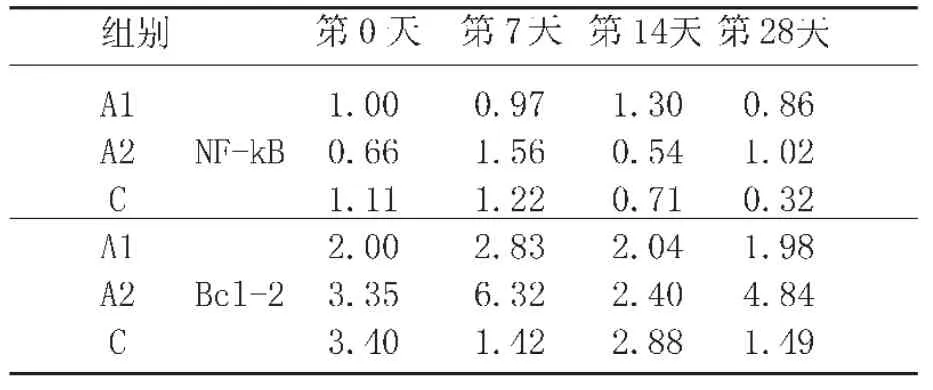
表8 实验仔猪血液样本中免疫信号转导分子相对基因的变化
2.5.3 免疫记忆相对基因表达的变化
表9显示,在0~28d,实验仔猪的IL-23,CD45和CD62L的相对表达水平每组间差异变化较复杂(P>0.05)。早期变化规律性不甚明显,但在28~42d时,A1和A2组的CD45和CD62L的表达均明显高于对照C组(P<0.05),A2组除28d外,其IL-23水平均较对照组明显升高(P<0.05)。

表9 实验仔猪血样中免疫记忆相对基因表达的变化
3 讨论
我们以前的研究表明,IL-2、IL-6和IL4/6融合基因重组表达质粒通过肌肉注射的方法共同表达可以引起仔猪免疫力的显着增强。此外,IL-2和IL-4/6融合基因和IL-4/6和抗菌肽融合基因可以有效增强小鼠的体液和细胞免疫应答。本实验进一步利用IL-2和IL-4/6融合基因与IL-4/6和抗菌肽融合基因,探讨通过口服接种来改善仔猪的免疫机能和生长。
本实验首先发现,重组毕赤酵母共表达猪IL-2和IL-4/6和重组毕赤酵母共表达猪IL-4/6和抗菌肽可诱导更强的免疫应答,并且A1组和A2组仔猪净增重明显高于C组(P<0.05)。A1和A2组CD8+T细胞、白细胞和血红蛋白、量在整个实验期间高于C组(P<0.05)。此外,与对照组相比,实验组的外周血中CSF和PRRS特异性抗体显著增加(P<0.05)。这些均证明处理组的体液免疫和细胞免疫水平均明显提高。现代研究表明细胞因子可以调节如内分泌激素和神经介质的分泌释放,进而影响细胞代谢和动物生长。抗菌肽是先天免疫系统的一部分,不仅可中和病毒和拮抗肿瘤细胞,也能加速伤口愈合和促进免疫。因此,本实验处理组动物接受融合细胞因子与抗菌肽作用后,呈现出免疫水平提升和生长增重改善的良好效应。
TLR在哺乳动物中进化非常保守的先天性免疫受体,在多种免疫(巨噬细胞,单核细胞,B淋巴细胞,DC细胞,NK细胞等)和非免疫细胞(脂肪组织)中表达,并且通过识别各种与病原体相关的分子模式(PAMPs)来诱导炎性细胞因子和Ⅰ型干扰素来抵抗致病微生物。CD62L经常在大多数白细胞的表面,并在炎症部位这些细胞附着内皮细胞。CD45具有促进T细胞在胸腺中选择和生长中的功能,并且用作未成熟和成熟T细胞的标志。选择Bcl-2,NF-κB(p50)来检测免疫信号转导分子相对基因的表达水平。Bcl-2的作用是凋亡抑制剂。NF-kB是真核转录因子激活抗凋亡基因Bcl-2的表达,并编码了许多免疫功能的炎症相关蛋白,如IL-6,TNF-α和IL-2R;它们的表达水平升高,也有利于免疫调节机能增强。
4 结论
我们的实验结果表明:A1和A2仔猪大多数免疫相关基因的表达水平在整个实验期间部分高于对照组(C组)。尤其是在实验后期(28~42d)时与A1和C组相比,A2组的大多数基因(TLR,NF-kB,Bcl-2,CD45,CD62L和IFN-γ)的表达水平显著增高(P<0.05)。因此,免疫相关基因的表达水平明显提高,表明A2实验组仔猪直接喂养A2重组毕赤酵母发酵液制剂后,有效强化了A2实验组仔猪的免疫调节和获得性免疫。
总之,我们的研究结果首次证明了猪IL-4/6基因和融合猪抗菌肽基因在毕赤酵母中共表达,除可以安全较好地促进仔猪生长,还能提高其先天性免疫机能和获得性特异免疫应答,可望开发为新的免疫生物制剂,用于预防和控制猪传染性病。
[1]Akdis,M.,et al.Interleukins,from 1 to 37,and interferon-gam ma:receptors,functions,and roles in diseases.J Allergy Clin Immunol,2011.127(3):701-21 e1-70.
[2]Vajdy,M.,et al.Mucosal adjuvants and delivery systems for protein-,DNA-and RNA-based vaccines.Immunol Cell Biol,2004.82(6):617-27.
[3]Block,M.S.,et al.,Pilot study of granulocyte-macrophage colony-stimulating factor and interleukin-2 as immune adjuvants for a melanoma peptide vaccine.Melanoma Res,2011.21(5):438-45.
[4]Reddy,K.V.,et al.Antimicrobial peptides:premises and promises.Int J Antimicrob Agents,2004.24(6):536-47.
[5]Yang,X.,et al.Potentiation of Immunity of Piglets to My coplasma Hyopneumoniae Vaccine with Fused Gene for PigIL-4 and IL-6 Embodied in Chitosan Nanoparticles.Procedia in Vac cinology,2013.7:15-22.
[6]Huang,J.,et al.Enhancement of the Immunity of Piglets to Pseudorabies Vaccine with Plasmids Containing Interleukin-6 Gene and CpG Motifs Encapsulated in Chitosan Nanoparticles.Procedia in Vaccinology,2013.7:8-14.
[7]Spurlock,M.E.Regulation of metabolism and growth during im mune challenge:an overview of cytokine function.J Anim Sci,1997.75(7):1773-83.
[8]Lande,R.,et al.Plasmacytoid dendritic cells sense self-DNA cou pled with antimicrobial peptide.Nature,2007.449(7162):564-9.
[9]C.VIOR,et al.The toll-like receptors signaling network.Faculty of Veterinary Medicine,Timisoara,2008.20(10):1020-1030.
[10]Schaffler,A.et al.Innate immunity and adipose tissue biology.Trends Immunol,2010.31(6):228-35.
[11]Kumar,H.,et al.Toll-like receptors and innate immunity.Biochem Biophys Res Commun,2009.388(4):621-5.
[12]Vega,A.,et al.,Angiotensin II induces CD62L shedding in hu man neutrophils.Atherosclerosis,2010.209(2):344-51.
[13]Suresh,M.,et al.,Role of CD28-B7 Interactions in Generation and Maintenance of CD8 T Cell Memory.The Journal of Im munology,2001.167(10):5565-5573.
[14]Kaipia,A.et.al.Regulation of ovarian follicle atresia Annual Review of Physiology,1997.59(1):349.
[15]Schreck,R.,et.al.Nuclear factor kappa B:an oxidative stress-responsive transcription factor of eukaryotic cells(areview).Free Radic Res Commun,1992.17(4):221-37.

