白喉毒素突变体CRM197在大肠杆菌中的高效可溶表达、纯化及免疫原性分析
房婷,陶正红,刘艳红,于长明,职睿智,于蕊
1军事医学科学院 生物工程研究所,北京 100071
2北京城市学院 生物医药学部,北京 100083
CRM197蛋白是白喉毒素 (Diphtheria toxin,DT)的突变体,由于其第52位氨基酸Gly突变为Glu,使其丧失了ADP-核糖转移酶活性,从而失去细胞毒性[1]。但CRM197仍然具有DT的完整功能结构,从而保留其免疫原性,且不存在传统白喉类毒素制备需要甲醛脱毒处理、组分不均一以及可能恢复毒性等缺点,而有望成为重组白喉疫苗的有效成分[2-3]。此外CRM197可以作为多糖疫苗的载体蛋白,能有效提高多糖抗原的免疫原性,而广泛用于疫苗开发领域[4-6]。目前已有多种以CRM197为载体的多糖疫苗上市,包括武田B型流感嗜血杆菌 (Hib)疫苗VaxemHibTTM(Takeda)、C群脑膜炎疫苗MeningitecTM和MenjugateTM(Nuron)、四价脑膜炎球菌ACWY多糖结合疫苗MenveoTM(Nuron)以及针对肺炎球菌的7价疫苗PrevnarTM和13价疫苗Prevnar 13TM(Pfizer)。同时有研究发现CRM197具有抑制肿瘤细胞增殖和迁移的作用,可作为肿瘤抑制剂开发为新型抗肿瘤药物[7-9]。
本研究通过对CRM197的序列进行优化,实现了目的蛋白在大肠杆菌中无标签、高效、可溶表达。通过对纯化步骤进行一系列的摸索与优化,搭建了可以工业放大的快速纯化体系,并对其毒性和免疫原性开展了初步研究,为该蛋白的进一步应用打下了坚实的基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
质粒pET-32a(+)购自Novagen公司。感受态细菌Escherichia coliTop10、E.coliBL21(DE3)购自天根公司。
1.1.2 主要材料和仪器
限制性内切酶购自NEB公司;Pyrobest DNA聚合酶、ExTaqDNA聚合酶、T4 DNA连接酶等购自TaKaRa公司;质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自OMEGA公司。PageRuler Prestained Protein Ladder购自Thermo公司。蛋白Marker购自北京全式金生物技术有限公司。化学发光试剂盒购自Millipore公司。兔抗白喉类毒素多克隆抗体和HRP标记羊抗兔IgG购自Abcam公司。
HiTrap Q Sepharose FF预装柱 (CV=5 mL)、HiTrap Heparin HP预装柱 (CV=5 mL)、HiPrep 26/10 Desalting预装柱 (CV=53 mL)均购于GE Healthcare公司。酵母提取物、胰蛋白胨为OXOID公司产品,其余为国产或进口分析纯试剂。
低温高速离心机购自Beckman Coulter公司。SDS-PAGE电泳仪为BIO-RAD公司产品。Image Quant LAS 4000 mini成像系统和纯化仪ÄKTA avant均为GE Healthcare公司产品。酶标仪Spectra Max Paradigm为Molecular Devices公司产品。
1.1.3 实验动物
6–8周龄雌性 BALB/c小鼠来自本院实验动物中心。
1.2 方法
1.2.1 CRM197的序列优化
根据白喉毒素序列 (GenBank Accession No.K01722.1),分析编码CRM197的序列进行优化。用大肠杆菌常用密码子替换稀有密码子,并平衡A、T、G、C四种碱基的比例和分布。在CRM197序列的5′端和3′端分别加入EcoRⅠ和XhoⅠ酶切位点,并在起始密码子前加入UAA终止密码子以终止载体pET32a(+)上Trx蛋白的表达,委托北京博迈德基因技术有限公司进行全基因合成。
1.2.2 CRM197表达载体构建
将优化合成后的CRM197基因用EcoRⅠ和XhoⅠ双酶切后,连接入同样双酶切后的表达载体pET32a(+)上,转化大肠杆菌感受态细胞DH5α,37℃培养过夜。次日挑取单克隆于5 mL LB(Amp+)培养基中,37℃、220 r/min培养12 h,提取质粒,EcoRⅠ和XhoⅠ双酶切鉴定目的基因的插入,并送测序。测序正确的质粒命名为pET32a(+)-CRM197。
1.2.3 CRM197在大肠杆菌中的表达
将重组表达质粒pET32a(+)-CRM197转化至感受态E.coliBL21(DE3),挑取单克隆于5 mL LB(Amp+)液体培养基中,37℃、220 r/min培养至OD600≈0.6时,加入终浓度为0.2 mmol/L的IPTG,28℃、220 r/min继续培养 6 h。6163 r/min、4℃离心收集菌体,用PBS重悬后超声碎菌。12000 r/min、4℃离心取上清,进行SDS-PAGE,以空载体表达产物为对照,鉴定CRM197蛋白的表达情况。
1.2.4 Westem blotting鉴定
将含有CRM197蛋白的超声碎菌上清及空载体碎菌上清进行SDS-PAGE后,蛋白转移至硝酸纤维素膜上,用含3%BSA的PBST室温封闭1 h后,加入1︰1000稀释的兔抗白喉类毒素多克隆抗体,37℃反应1 h。将膜用PBST洗涤4遍后,加入1︰5000稀释的辣根酶标记的羊抗鼠IgG二抗,37℃反应1 h后PBST洗涤4遍,采用化学发光法显色、压片和曝光。
1.2.5 CRM197阴离子交换
将pET32a(+)-CRM197/BL21(DE3)按上述发酵条件扩大培养到1 L,收集菌体,按菌体湿重 (g)与缓冲液体积 (mL)为1︰20重悬于缓冲液A(20 mmol/L Tris,0.5 mmol/L EDTA,5%甘油,pH 8.0)。超声破菌后,4℃、12000 r/min离心20 min收集上清。采用HiTrap Q Sepharose FF预装柱(CV=5 mL),流速为5 mL/min,缓冲液A平衡5 CV后上样,收集流穿,缓冲液B(20 mmol/LTris,1 mol/L NaCl,pH 8.0)100%缓冲液B、10 CV,洗脱杂蛋白。
1.2.6 肝素亲和层析
采用肝素亲和层析柱HiTrap Heparin HP预装柱(CV=5 mL)对样品进行精纯,缓冲液C(20 mmol/L Tris,pH 8.0)、缓冲液 D(20 mmol/L Tris,1 mol/L NaCl,pH 8.0),流速为5 mL/min,梯度洗脱,60%D、10 CV收集目的蛋白峰。
1.2.7 脱盐换液
采用HiPrep26/10Desalting预装柱 (CV=53 mL),缓冲液E(20 mmol/L PB,0.15 mol/L NaCl,pH 7.2),流速为15 mL/min,每次上样量15 mL,更换缓冲液,收集目的蛋白。
1.2.8 毒性试验
将Vero细胞消化后进行细胞计数,调整细胞浓度为1.25×105个细胞/mL,将细胞悬液加入到96孔培养板中,100 μL/孔。白喉毒素首孔从5 ng/mL开始倍比稀释,依次加入到含有细胞的培养板中,100 μL/孔;白喉类毒素和CRM197蛋白首孔从0.25 mg/mL开始倍比稀释,依次加入到含有细胞的培养板中,100 μL/孔。加入毒素、类毒素和CRM197蛋白的Vero细胞培养板继续于37℃、CO2孵箱中培养6–7 d,采用MTT法观察细胞的存活情况,用酶标仪在490 nm测定吸光值,参比波长620 nm。用GraphPad Prism 5.01软件计算各组的 IC50。
1.2.9 免疫原性检测
将不同剂量的CRM197蛋白2 μg/只和20 μg/只,采用腹部皮下方式免疫6−8周龄BALB/c小鼠,每3周免疫1次,共免疫3次,均采用氢氧化铝佐剂,每次免疫后3周、下一次免疫前取血检测血清中的抗体滴度;抗体滴度的测定采用ELISA的方法,白喉类毒素2 μg/mL,100 μL/孔包被96孔酶联板,4℃包被过夜。PBST洗涤4次,5 min/次。将抗血清用PBST从1:100依次倍比稀释后,加入酶联板中,37℃反应1 h,同时设PBS免疫后的血清为对照。PBST洗涤4次,5 min/次。加入HRP-抗小鼠二抗,37℃反应30−40 min。加入TMB显色液,50 μL/孔,显色后用2 mol/L H2SO4终止,酶标仪450 nm测定光吸收值。以加入阴性对照血清孔的显色值为对照,以OD450大于0.1且高于阴性孔2倍为阳性稀释滴度。
2 结果与分析
2.1 CRM197序列优化及载体构建
构建CRM197表达载体pET32a(+)-CRM197(图 1)转化大肠杆菌DH5α,用EcoRⅠ和XhoⅠ双酶切鉴定,结果显示,该重组质粒酶切后产生一条约1600 bp的条带 (图1B箭头所示),与目的基因片段大小一致,测序结果 (序列略)表明此片段与设计的CRM197基因序列完全相同。
2.2 可溶性表达分析
将构建好的质粒pET32a(+)-CRM197转化入大肠杆菌BL21(DE3),IPTG诱导表达,收集菌体超声后,取上清,以空白载体为对照进行SDS-PAGE和Westem blotting鉴定。从图2可以看出,与空载体对照相比,转化有pET32a(+)-CRM197质粒的菌株在58 kDa左右有明显的条带。Westem blotting结果证实该蛋白可与鼠抗白喉类毒素多克隆抗体发生特异性结合。目的条带用凝胶灰度扫描显示重组蛋白可占菌体总蛋白的40%以上,说明CRM197蛋白在大肠杆菌中得到了高效可溶性表达。
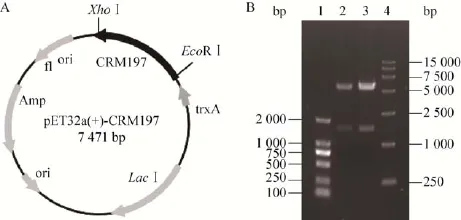
图1 CRM197表达载体的构建及酶切鉴定Fig.1 Construction and characterization of CRM197 expression plasmid.(A)Diagram of pET32a(+)-CRM197 expression plasmid.(B)Restriction map of recombinant plasmid.1:DNA marker(DL2000);2,3:pET32a(+)-CRM197 digested by XhoⅠ/EcoRⅠ;4:DNA marker(DL15000).
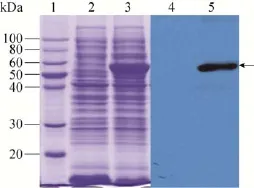
图2 表达蛋白CRM197的SDS-PAGE和Westem blotting分析Fig.2 SDS-PAGE and Westem blotting analysis of expression protein.1:marker;2,4:the blank vector;3,5:the supernatant after homogenate and centrifuge.
2.3 重组CRM197蛋白的纯化及鉴定
从图3可以看出,目的蛋白基本在超声上清中,为可溶表达,且表达量较高占比为40%。首先通过QFF一步流穿快速去除杂蛋白,随后无需更换缓冲液,正确折叠的目的蛋白能与Heparin特异性结合,并且通过梯度洗脱进一步去除痕量杂质,最后通过脱盐换液将蛋白置换到保存溶液PBS中,经过三步纯化后,无标签的目的蛋白得到了很好的纯化,纯度可达95%以上。
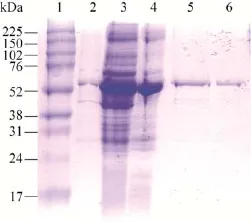
图3 纯化CRM197各步骤的SDS-PAGE分析Fig.3 SDS-PAGE of CRM197’s purification of each step.1:marker;2:the precipitation after ultrasonic cytolysis and centrifuge; 3: the supernatant after ultrasonic cytolysis and centrifuge;4:the flow-through collection of QFF;5:the fraction collection of Heparin HP;6:the fraction collection of desalting.
2.4 重组CRM197蛋白的毒性试验
根据加入毒素、类毒素和CRM197蛋白的Vero细胞的存活情况 (图4),计算IC50值分别为0.012 ng/mL、26.46 μg/mL 和 254.50 μg/mL。可以看出,CRM197的IC50值是白喉毒素IC50值的2.1×107倍;与白喉类毒素相比,CRM197的IC50值是前者的9.6倍。以上结果说明CRM197在细胞实验水平上是安全无毒性的。
2.5 抗原在小鼠体内的免疫原性分析
分别采用高剂量 (20 μg)和低剂量 (2 μg)免疫BALB/c小鼠,每两周免1次,共免3次。从图5中可以看出,2 μg和20 μg组的CRM197均可诱导小鼠产生较高的抗体滴度,且在第9周抗体滴度达到峰值,达1︰409600,并且2 μg组三免后的抗体滴度与20 μg组的相当。
3 讨论
自19世纪80年代以来,结合疫苗的发展大大降低了包括Hib、肺炎支原体和脑膜炎奈瑟氏球菌等导致的相关儿科疾病的发病率[10]。其中白喉类毒素、破伤风类毒素和CRM197是目前已获批上市疫苗中使用最多的载体。有实验表明,使用CRM197作为载体蛋白的结合疫苗,除了能有效激发受体产生针对结合物的抗体外,还能产生足够针对白喉毒素的抗体[11-14]。并且在上述3种载体蛋白存在预存免疫的情况下,CRM197能更加有效地激发小鼠产生特异的针对结合物的抗体[15],这对于已接种破伤风和白喉疫苗的人群具有一定的参考意义。随着研究手段的进步,进一步拓宽了CRM197作为载体蛋白的应用领域,除了与传统的多糖结合外,还可与半合成糖进行缀合,进而提升13价肺炎疫苗的功效,或利用CRM197能与白喉毒素受体 (Diphtheria toxin receptor,DTR)结合通过血脑屏障的特性,与纳米粒子相结合,开发针对阿尔茨海默病的治疗药物[16-18]。
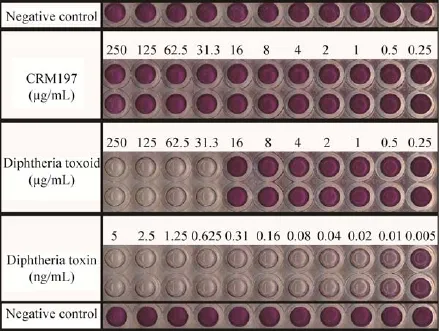
图4 细胞毒性试验 (MTT)Fig.4 Cytotoxicity test(MTT).
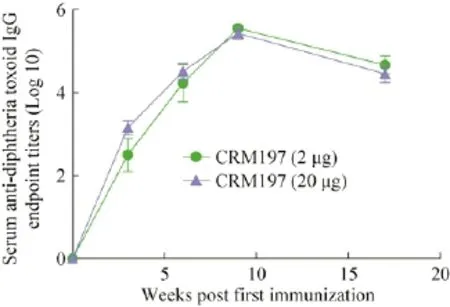
图5 免疫后小鼠血清中的抗体滴度Fig.5 Serum IgG titer in mouse serum after immunization.
目前CRM197以及其他非毒突变体一般采用溶原化的白喉杆菌分泌产生,该菌株经由β噬菌体感染含有编码DT的tox突变基因[19-20]。该系统的优点是目的蛋白以分泌形式表达于胞外,杂蛋白含量低有利于纯化生产。缺点是白喉杆菌发酵条件严苛,且培养基成分复杂、价格昂贵[21-22]。采用大肠杆菌表达系统,具有生产周期短、成本低、外源DNA易于导入、外源蛋白表达简易和能很快产生大量的目的蛋白等优点,是表达重组蛋白优先选用的系统。但目前采用该系统表达CRM197存在缺陷,即目的蛋白以包涵体的形式存在,需要经过变性、复性的阶段,不利于产量的提高和生产放大,且携带标签需要后续处理步骤,为产品质控增加风险[23-24]。本研究对原有序列进行了优化,采用大肠杆菌常用密码子替换稀有密码子,并平衡A、T、G、C四种碱基的比例和分布,优化后重组CRM197在大肠杆菌BL21(DE3)中获得了可溶性高表达,目的蛋白约占碎菌上清总蛋白的40%,克服了上述表达体系的缺点,实现了目的蛋白的高效、可溶表达,且无标签无需后续去除步骤。
目的蛋白获得表达后,我们又对纯化流程进行了摸索。通过研究发现,CRM197具有与天然的DT对DTR相似的亲和力。而DTR的氨基酸序列与肝素结合表皮生长因子前体 (pro-HB-EGF)的相同[25]。因此推断,正确折叠的CRM197能与Heparin柱特异结合,经过一系列的条件摸索,最终确定了阴离子柱流穿、肝素亲和柱梯度洗脱、脱盐柱换液的快速纯化流程,获得了无细胞毒性、能诱导小鼠产生较高抗体滴度的目的蛋白,为后续工艺放大、工业生产奠定了坚实的基础。
[1]Bröker M,Costantino P,DeTora L, et al.Biochemical and biological characteristics of cross-reacting material 197(CRM197),a non-toxic mutant of diphtheria toxin:use as a conjugation protein in vaccines and otherpotentialclinical applications.Biologicals,2011,39(4):195–204.
[2]Bröker M,Berti F,Costantino P.Factors contributing to the immunogenicity of meningococcal conjugate vaccines.Hum Vaccin Immunother,2016,12(7):1808–1824.
[3]Podda A,Vescia N,Donati D,et al.A phase-I clinicaltrialofanew antitetanus/antidiphtheria vaccine for adults.Ann Ig,1991,3(2):79–84.
[4]Bröker M,Berti F,Schneider J,et al.Polysaccharide conjugate vaccine protein carriers as a“neglected valency”-potential and limitations.Vaccine,2017,35(25):3286–3294.
[5]Romaniuk SI,Kolibo DB,Komisarenko SV.Perspectives of application of recombinant diphtheria toxin derivatives. Bioorg Khim, 2012, 38(6):639–652.
[6]Pappenheimer AM Jr,Uchida T,Harper AA.An immunological study of the diphtheria toxin molecule.Immunochemistry,1972,9(9):891–906,IN5-IN6.
[7]Buzzi S,Rubboli D,Buzzi G,et al.CRM197(nontoxic diphtheria toxin):effects on advanced cancer patients.Cancer Immunol Immunother,2004,53(11):1041–1048.
[8]Fiorentini G,Banfi R,Dentico P,et al.Clinical experience of treatment of metastatic melanoma and solid tumours adopting a derivative of diphtheria toxin:cross-reacting material 197.In vivo,2013,27(2):197–202.
[9]DateokaS,OhnishiY,Kakudo K.Effectsof CRM197,a specific inhibitor of HB-EGF,in oral cancer.Med Mol Morphol,2012,45(2):91–97.
[10]Shinefield HR.Overview of the development and currentuse ofCRM197conjugate vaccines for pediatric use.Vaccine,2010,28(27):4335–4339.
[11]Halperin SA,McDonald J,Samson L,etal.Simultaneous administration of meningococcal C conjugatevaccineand diphtheria-tetanus-acellular pertussis-inactivated poliovirus-Haemophilus influenzae type b conjugate vaccine in children:a randomized double-blind study.Clin Invest Med,2002,25(6):243–251.
[12]Gasparini R,Conversano M,Bona G,et al.Randomized trial on the safety,tolerability,and immunogenicity of MenACWY-CRM,an investigationalquadrivalent meningococcal glycoconjugate vaccine,administered concomitantly with a combined tetanus,reduced diphtheria, and acellular pertussis vaccine in adolescents and young adults.Clin Vaccine Immunol,2010,17(4):537–544.
[13]McVernon J,MacLennan J,Clutterbuck E,et al.Effect of infant immunisation with meningococcus serogroup C-CRM197conjugate vaccine on diphtheria immunity andreactogenicity inpre-schoolaged children.Vaccine,2003,21(19/20):2573–2579.
[14]Tashani M,Alfelali M,Barasheed O,et al.Effect of Tdap when administered before,with or after the 13-valent pneumococcal conjugate vaccine(coadministered with the quadrivalent meningococcal conjugate vaccine)in adults:a randomised controlled trial.Vaccine,2016,34(48):5929–5937.
[15]Tontini M,Berti F,Romano MR,et al.Comparison of CRM197,diphtheria toxoid and tetanus toxoid as protein carriers for meningococcal glycoconjugate vaccines.Vaccine,2013,31(42):4827–4833.
[16]Möginger U,Resemann A,Martin CE,et al.Cross reactive material 197 glycoconjugate vaccines contain privileged conjugation sites.Sci Rep,2016,6:20488.
[17]Parameswarappa SG,Reppe K,Geissner A,et al.A semi-synthetic oligosaccharide conjugate vaccine candidate confers protection againstStreptococcus pneumoniaeSerotype 3 infection.Cell Chem Biol,2016,23(11):1407–1416.
[18]Kuo YC,Rajesh R.Targeted delivery of rosmarinic acid across the blood-brain barrier for neuronal rescueusing polyacrylamide-chitosan-poly(lactideco-glycolide) nanoparticles with surface cross-reacting material 197 and apolipoprotein E.Int J Pharm,2017,528(1/2):228–241.
[19]Rappuoli R. Isolation and characterization ofCorynebacteriumdiphtheriaenontandem double lysogens hyperproducing CRM197.Appl Environ Microbiol,1983,46(3):560–564.
[20]Rappuoli R,Michel JL,Murphy JR.Integration of corynebacteriophagesandinto two attachment sites on theCorynebacterium diphtheriaechromosome.J Bacteriol,1983,153(3):1202–1210.
[21]Cox JC.New method for the large-scale preparation of diphtheria toxoid:purification of toxin.Appl Microbiol,1975,29(4):464–468.
[22]Fass R,Bahar S,Kaufman J,et al.High-yield production of diphtheria toxin mutants by high-density culture of C7(β)tox+strains grown in a non-deferrated medium.Appl Microbiol Biotechnol,1995,43(1):83–88.
[23]Stefan A,Conti M,Rubboli D,et al.Overexpression and purification of the recombinant diphtheria toxin variant CRM197 inEscherichia coli.J Biotechnol,2011,156(4):245–252.
[24]Bishai WR,Rappuoli R,Murphy JR.High-level expression of a proteolytically sensitive diphtheria toxin fragment inEscherichia coli.J Bacteriol,1987,169(11):5140–5151.
[25]Mitamura T, Umata T, Nakano F, et al.Structure-function analysis of the diphtheria toxin receptor toxin binding site by site-directed mutagenesis.J Biol Chem,1997,272(43):27084–27090.

