苹果树腐烂病菌根皮苷水解酶基因 Vmlph1的功能
朱百涛,尹志远,吴玉星,高小宁,冯 浩,韩青梅,黄丽丽
(西北农林科技大学 植物保护学院,旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
苹果树腐烂病是由子囊菌黑腐皮壳属真菌(Vaslamali)引起的苹果树枝干病害[1]。该病能引起苹果树主干、主枝皮层腐烂,乃至整株枯死,在中国各苹果产区都有发生,严重影响苹果产业的发展[2-4]。根皮苷(Phlorizin)是根皮素的葡萄糖苷,在苹果树叶、枝和树皮中广泛存在,其中以树皮中最高,达到64.32 mg/g[5]。在苹果属的树皮中,抗腐烂病品种比感病品种具有相似或更高的根皮苷含量[6]。根皮苷对苹果树腐烂病菌与寄主互作起重要作用,苹果树腐烂病菌可以降解根皮苷产生5种有毒化合物,这些产物能产生与苹果树感染腐烂病同样的树皮坏死症状[7-8]。苹果树腐烂病菌降解根皮苷产生有毒化合物的能力与病菌致病力强弱相关,强致病力菌株降解根皮苷产生更高含量的5种有毒化合物,弱致病力菌株只能产生低量的3~4种有毒化合物[9]。苹果树腐烂病菌及其代谢产物均能降解根皮苷,苹果树腐烂病菌代谢产生的蛋白类为降解根皮苷的主要成分,1 mg/L蛋白类对根皮苷作用1 d时,降解率达到75%,这些蛋白可能是酶类[10]。真核生物、古细菌和细菌糖苷类水解酶(GH)家族Ⅰ通常水解G-O-X(或G-S-X)型底物,其中G代表β连接的糖基,而X代表另一个糖基残基,乳糖根皮苷降解酶(LPH)能降解根皮苷,属于家族Ⅰ中的一种酶[11-15]。本研究基于苹果树腐烂病菌全基因组数据[2],鉴定到对根皮苷具有降解作用的糖苷类水解酶(GH)家族Ⅰ的1个乳糖根皮苷水解酶(LPH)基因 Vmlph1,为明确该基因的功能,利用Double-joint PCR和PEG介导的原生质体转化技术,对该基因进行敲除,通过分析敲除突变体营养生长、致病力变化及对根皮苷降解的作用,明确该基因在苹果树腐烂病菌侵染过程中的作用。
1 材料与方法
1.1 试验材料与试剂
1.1.1 试验材料及仪器 苹果树腐烂病菌(V.mali)野生型分离株03-8由西北农林科技大学果树病害病原生物学及综合防治研究团队分离并保存;苹果‘富士’品种(MalusdomesticaBorkh. cv.‘Fuji’)枝条及叶片采于陕西省咸阳市杨凌区;质粒pHIG2RHPH2-GFP-GUS(含有潮霉素磷酸转移酶基因hph)由浙江大学宋凤鸣教授惠赠。 Waters 600E高效液相色谱仪;CFX96TMConnect Real-Time Systems(Bio-Rad)。
1.1.2 主要试剂 常用化学试剂(金华大),根皮苷(春秋生物),DH5α(天根),Taq酶和内切酶(Thermo),胶回收提取试剂盒(百泰克),质粒小量提取试剂盒(Omega),潮霉素B(Roche),G418 (MP),崩溃酶、溶壁酶(Sigma),核酸提取试剂盒(华越洋),反转录试剂盒(Thermo),引物由上海生工生物工程股份有限公司合成,所用引物见表1。

表1 试验所用引物Table 1 Primers in the study
1.2 试验方法
1.2.1 基因敲除 以苹果树腐烂病菌野生型菌株03-8基因组DNA为模板,引物Vmlph1-1F/2R扩增目的基因上游片段,Vmlph1-3F/4R扩增目的基因下游片段,以质粒 pHIG2RHPH2-GFP-GUS为模板hph-F/hph-R扩增hph片段,胶回收各DNA片段。使用Double-joint PCR方法构建基因敲除载体[16]。PEG介导原生质体转化参照高静等[17]的方法,100 μg/mL潮霉素筛选转化子。对于能够正常生长的菌株,提取DNA,用4对引物(Vmlph1-5F/6R、H850/H852、Vmlph1-1F/H855-R、H856-F/Vmlph1-4R)进行PCR检测[18]。CTAB法提取基因组DNA,内切酶BgⅡ进行酶切。电泳、转膜,使用hph基因片段为探针进行杂交,参照DIG DNA Labeling and Detection KitⅡ说明书。
1.2.2 表型观察 活化野生型03-8及突变体菌株,用打孔器(d=5 mm)在菌落边缘打取菌饼,挑取1个菌饼接到含有10 mL PDA培养基的培养皿中央,每个菌株3个重复,25 ℃避光倒置培养,2 d后观察菌落生长情况并测量菌落直径,试验重复3次。
1.2.3 突变体产孢变化观察 挑取活化好的野生型03-8及突变体菌饼(d=5 mm)接到分别含有10 mL的PDA和ABA(苹果树皮煎汁培养基)平板中央,25 ℃避光倒置培养,7 d后置于光暗交替条件下(光照∶黑暗=12 h∶12 h),25 ℃静置培养,30 d后观察各菌株产孢情况并计数。每个菌株设3个重复,试验重复3次。
1.2.4 致病力检测 离体叶片致病力检测参照韦洁玲等[19]的方法,叶片用φ=0.6%的次氯酸钠溶液进行表面消毒;针头刺伤叶片正面;在伤口上接种野生型03-8及突变体菌饼,并以无菌PDA作为对照;置于托盘内,25 ℃保湿培养3 d后测量病斑大小。离体枝条致病力检测参照臧睿等[20]的方法,苹果枝条用φ=0.6%的次氯酸钠溶液进行表面消毒;石蜡封顶,用电烙铁对苹果枝条进行烫伤处理;在伤口上接种野生型03-8及突变体菌饼,并以无菌PDA作为对照; 置于托盘中,25 ℃保湿培养5 d后测量病斑大小。每个菌株设置3个重复,试验重复3次。
1.2.5 根皮苷降解检测 以根皮苷为碳源的病原菌发酵培养参照Okuno等[21]的方法,略有改动,MS培养基以0.1 g/L根皮苷为碳源。在100 mL灭菌PDB培养基(马铃薯葡萄糖液体培养基)中,加入10块25 ℃黑暗培养2 d的03-8及突变体菌落边缘菌饼(d=5 mm),25 ℃ 100 r/min摇培2 d,除去PDB,用无菌水冲洗菌丝,换100 mL MS培养基,25 ℃ 100 r/min摇培24 h。
根皮苷的降解检测参照王建华等[10]的方法,略有改动,取发酵液经孔径0.22 μm微孔滤膜过滤得到无菌发酵液,同时设置0.1 g/L根皮苷标准品为对照, HPLC法检测根皮苷的质量分数,计算各菌株对根皮苷的降解利用率,根皮苷降解率=(对照样品中根皮苷质量分数-处理样品中根皮苷质量分数)/对照样品中根皮苷质量分数×100%,试验重复3次。
HPLC分析条件参照文献[22]。
1.2.6 突变体黑色素合成调控转录因子表达量变化 以“1.2.5”方法培养和诱导野生型03-8和突变体菌株,过滤菌丝吸干水分,锡箔纸包裹菌丝迅速放入液氮中冷冻,-80 ℃冰箱保存,备用。以0 h菌株为对照,通过qRT-PCR检测野生型03-8和突变体ΔVmlph1在诱导24 h时黑色素合成调控因子 Cmr1的表达量变化。华越洋核酸提取试剂盒提取野生型03-8和突变体菌丝样品总RNA。反转录试剂盒(Thermo)合成第一链cDNA,4 μg RNA为模板,引物使用Oligo d(T)18。qRT-PCR:苹果腐烂病菌 G6PDH作为内参基因[23], PCR体系参照GenStar 2×RealStar Green Power Mixture说明书进行。目的基因相对表达量用2-△△Ct方法计算。
2 结果与分析
2.1 敲除突变体获取
经PEG介导的原生质体转化,获得转化子,以转化子DNA为模板,利用4对引物进行PCR检测。对鉴定为阳性的转化子进行Southern Blot验证,最终得到1个单拷贝敲除突变体ΔVmlph1-4(图1)。
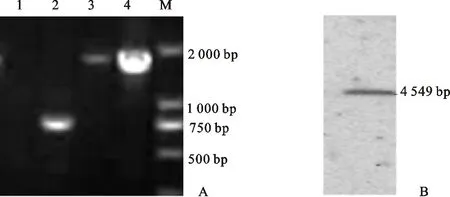
A:突变体4对引物PCR检测 PCR detection of deletion mutant of four pairs of primers. 1.目的基因 Target gene; 2.hph基因hphcassette;3.上游片段 Upstream region;4.下游片段 Downstream region;M. DNA marker;B:突变体Southern blot检测 Southern blot detection of the deletion mutant
图1基因敲除突变体验证
Fig.1Verificationofdeletionmutant
2.2 突变体表型观察
突变体ΔVmlph1在PDA平板上生长2 d后,与野生型03-8相比,ΔVmlph1菌落变白、菌丝稀疏,生长速率减小(图2)。表明Vmlph1基因影响菌落的形态和生长速率。
2.3 突变体产孢变化观察
在光暗交替(光照∶黑暗=12 h∶12 h)条件下培养30 d后,PDA和ABA培养基上野生型03-8和突变体菌株都有分生孢子器生成。对分生孢子器进行数据统计发现,与野生型03-8相比,突变体ΔVmlph1在PDA和ABA培养基上数量都显著减少(图3)。表明 Vmlph1影响苹果腐烂病菌分生孢子产生。
2.4 突变体致病力检测
与野生型03-8相比,突变体ΔVmlph1致病力显著下降,在叶片上致病力下降22.0%,在枝条上致病力下降11.0%(图4)。表明 Vmlph1基因影响病菌致病力。

*表示显著性差异(P<0.05),下同 * indicates significant difference(P<0.05),the same below.
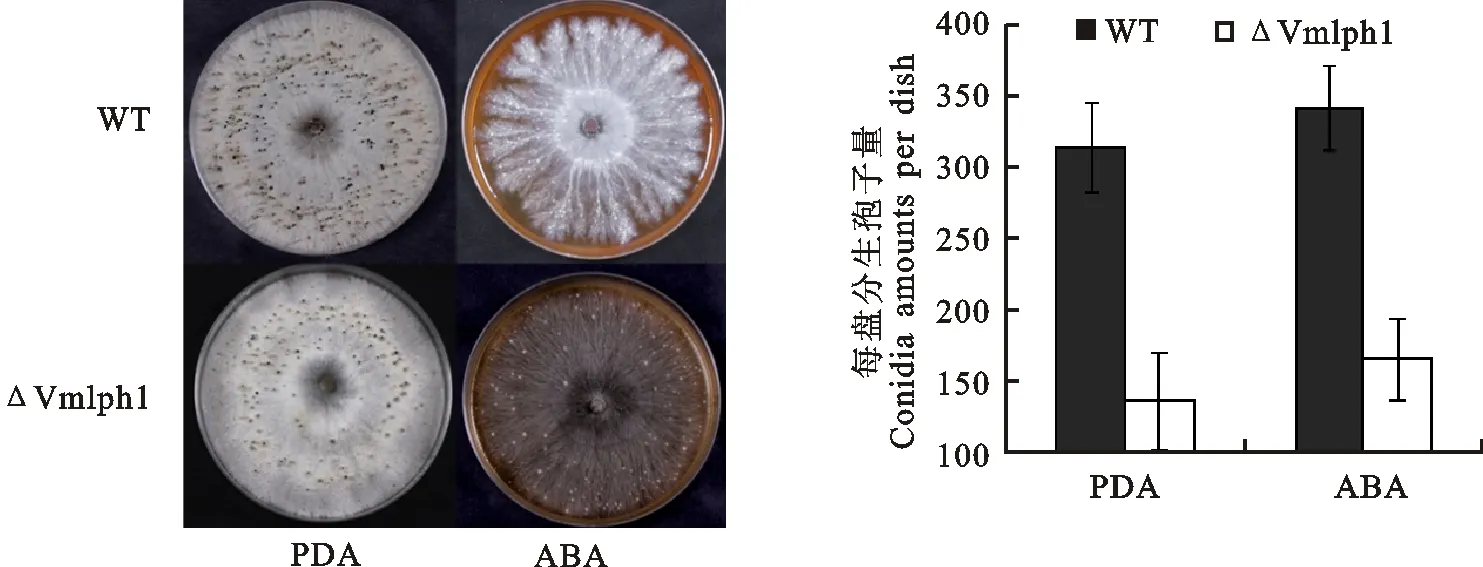
图3 野生型菌株03-8和突变体在PDA和ABA培养基上的产孢情况Fig.3 Pycnidia formation of wild type strain 03-8 and mutant inoculated on PDA and ABA mediums respectively
2.5 根皮苷降解检测
HPLC检测结果显示,野生型03-8对发酵液中根皮苷降解率为26.7%,ΔVmlph1降解率25.4%,表明突变体ΔVmlph1与野生型03-8对根皮苷的降解能力无显著差异。
2.6 突变体黑色素基因簇表达量变化
qRT-PCR结果(图5)显示根皮苷诱导24 h后,野生菌株03-8和突变体黑色素合成调控基因 Cmr1相对表达量分别为未诱导菌株的3.7、1.9倍,突变体ΔVmlph1中 Cmr1的上调倍数显著低于野生型03-8,表明 Vmlph1基因的敲除影响病菌 Cmr1基因的表达,该基因可能与病菌黑色素合成有关。
3 结论与讨论
本研究首次对苹果树腐烂病根皮苷水解酶基因 Vmlph1进行研究,利用基因敲除技术及PEG介导的遗传转化获得目的基因的敲除突变体,与野生型03-8相比,该基因敲除突变体ΔVmlph1菌落颜色变白,生长速率和分生孢子产量显著降低,在苹果叶片和枝条上致病力显著降低。表明 Vmlph1基因与苹果树腐烂病菌的侵染和致病相关。
苹果树腐烂病菌分解小部分根皮苷产生根皮酸,根皮酸再次被分解为致病毒素,致使苹果树皮层腐烂,病菌迅速扩张[24]。在活体试验中,苹果树腐烂病菌的致病力高度依赖与其分解根皮苷产生有毒化合物的能力,弱致病力菌株比强致病力菌株产生更少量的有毒化合物[9]。本研究结果显示,与野生型03-8相比,突变体ΔVmlph1致病力显著降低,但其对根皮苷降解能力无显著性变化。表明 Vmlph1基因的敲除对病菌降解根皮苷的能力无影响。病菌可能存在其他糖苷水解酶基因的共同作用,实现对根皮苷的降解利用。
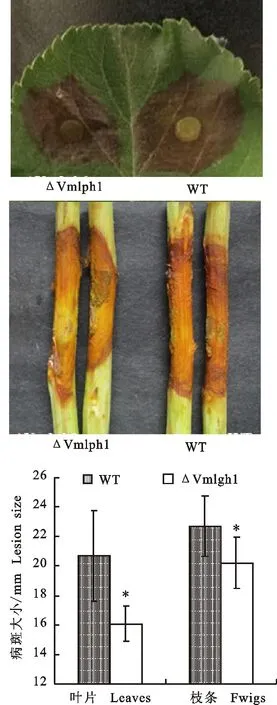
图4 突变体在苹果叶片和枝条上的致病力检测Fig.4 Pathogenicity test and analysis of mutant on apple leaves and twigs
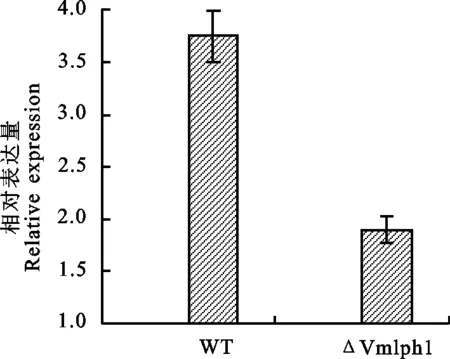
图5 野生型03-8及突变体在根皮苷诱导下 Cmr1基因相对表达量 Fig.5 Relative expression of Cmr1 in wild type strain 03-8 and mutant induced by phlorizin
根皮苷通过cAMP信号传导途径增加酪氨酸酶基因的表达,从而促进L-DOPA黑色素的生成[25]。在烟曲霉(Aspergillusfumigatu)中,DHN黑色素合成关键基因pksP的表达部分地由cAMP/PKA信号转导途径控制,而 Cmr1基因调控黑色素合成基因簇的转录[26-28]。突变体ΔVmlph1在PDA培养基上菌落颜色变白,在根皮苷诱导下,野生型 Cmr1基因表达量比突变体ΔVmlph1显著上调。此结果表明 Vmlph1基因的缺失导致 Cmr1基因表达量下降从而影响病菌黑色素的合成。
本研究初步探究 Vmlph1基因的功能,然而苹果树腐烂病降解根皮苷是一个复杂的过程,亟待进一步研究。
参考文献Reference:
[1] WANG X,ZANG R,YIN Z,etal.Delimiting cryptic pathogen species causing appleValsacanker with multilocus data[J].EcologyandEvolution,2014,4(8):1369-1380.
[2] YIN Z,LIU H,LI Z,etal.Genome sequence ofValsacanker pathogens uncovers a potential adaptation of colonization of woody bark[J].NewPhytologist,2015,208(4):1202-1216.
[3] 曹克强,国立耘,李保华,等.中国苹果树腐烂病发生和防治情况调查[J].植物保护,2009,35(2):114-117.
CAO K Q,GUO L Y,LI B H,etal.Investigations on the occurrence and control of apple canker in China [J].PlantProtection,2009,35(2):114-117.
[4] 李正鹏,高小宁,杜战涛,等.陕西渭北地区苹果树腐烂病发生情况调查[J].西北农业学报,2013,22(1):174-178.
LI ZH P,GAO X N,DU ZH T,etal.Survevy of appleValsacanker in Weibei Area of Shaanxi province[J].ActaAgriculturaeBoreali-occidentalisSinica,2013,22(1):174-178.
[5] 李荣涛,刘杰超,焦中高,等.RP-HPLC 法测定苹果树枝、叶中根皮苷的含量[J].食品工业科技,2009,30(12):385-387.
LI R T,LIU J CH,JIAO ZH G,etal.Determination of phlorizin in apple branch and leave by RP-HPLC[J].FoodScienceandTechnology,2009,30(12):385-387.
[6] BESSHO H,TSUCHIYA S,SOEJIMA J.Screening methods of apple trees for resistance toValsacanker[J].Euphytica,1994,77(1):15-18.
[8] KOGANEZAWA H,SAKUMA T.Possible role of breakdown products of phloridzin in symptom development byValsaceratosperma[J].JapaneseJournalofPhyTopathology,1982,48(4):521-528.
[9] WANG C X,LI CH,LI B H.etal.Toxins produced byValsamalivar.maliand their relationship with pathogenicity[J].Toxins,2014,6(3):1139-1154.
[10] 王建华,柯希望,黄以超,等.苹果树腐烂病菌发酵液中根皮苷主要降解成分的分析[J].西北农林科技大学学报(自然科学版),2012,40(8):89-94,105.
WANG J H,KE X W,HUANG Y CH,etal.Components analysis of ofValsamalivar.malifermentation liquid degrading phloridzin[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2012,40(8):89-94,105 .
[11] BARRETT T,SURESH C,TOLLEY S,etal.The crystal structure of a cyanogenic β-glucosidase from white clover,a family 1 glycosyl hydrolase[J].Structure,1995,3(9):951-960.
[12] BURMEISTER W,COTTAZ S,DRIGUEZ H,etal.The crystal structures ofSinapisalbamyrosinase and a covalent glycosyl-enzyme intermediate provide insights into the substrate recognition and active-site machinery of an S-glycosidase[J].Structure,1997,5(5):663-676.
[13] CZJZEK M,CICEK M,ZAMBONI V,etal.The mechanism of substrate (aglycone) specificity in β-glucosidases is revealed by crystal structures of mutant maize β-glucosidase-DIMBOA,-DIMBOAGlc,and-dhurrin complexes[J].ProceedingsoftheNationalAcademyofSciences,2000,97(25):13555-13560.
[14] MIAN I.Sequence,structural,functional,and phylogenetic analyses of three glycosidase families[J].BloodCells,Molecules,andDiseases,1998,24(2):83-100.
[15] LEESE H,SEMENZA G.On the identity between the small intestinal enzymes phlorizin hydrolase and glycosylceramidase[J].JournalofBiologicalChemistry,1973,248(23):8170-8173.
[16] YU J,HAMARI Z,HAN K,etal.Double-joint PCR:a PCR-based molecular tool for gene manipulations in filamentous fungi[J].FungalGeneticsandBiology,2004,41(11):973-981.
[17] 高 静,李艳波,柯希望,等.PEG 介导的苹果腐烂病菌原生质体转化[J].微生物学报,2011,51(9),1194-1199.
GAO J,LI Y B,KE X W,etal.Development of genetic transformation system ofValsamaliof apple mediated by PEG[J].ActaMicrobiologicaSinica,2011,51(9):1194-1199.
[18] 宋 娜,戴青青,宋 娜,等.苹果树腐烂病菌 GTP-环化水解酶Ⅱ基因敲除载体构建及其突变体的表型分析[J].中国农业科学,2014,47(15):2980-2989.
SONG N,DAI Q Q,SONG N,etal.The construction of knockout vector of GTP cyclohydrolase Ⅱ gene and mutant’s biological characteristics ofValsamali[J].ScientiaAgriculturaSinica,2014,47(15):2980-2989 .
[19] 韦洁玲,黄丽丽,郜佐鹏,等.苹果树腐烂病室内快速评价方法的研究[J].植物病理学报,2010,40(1) :14-20.
WEI J L,HUANG L L,GAO Z P,etal.Laboratory evaluation method of appleValsacanker disease cause byValsaceratospermasensuKobayshi[J].ActaPhytopathologicaSinica,2010,40(1):14-20 .
[20] 臧 睿,黄丽丽,康振生,等.陕西苹果树腐烂病菌(Cytosporaspp.) 不同分离株的生物学特性与致病性研究[J].植物病理学报,2007,37(4):343-351.
ZANG R,HUANG L L,KANG ZH SH,etal.Biological characteristics and pathogenicity of different isolates ofCytosporaspp.isolated from apple trees in Shaanxi province[J].ActaPhytopathologicaSinica,2007,37(4):343-351.
[21] OKUNO T,OIKAWA S,GOTO T,etal.Structures and phytotoxicity of metabolites fromValsaceratosperma[J].AgriculturalandBiologicalChemistry,1986,50(4):997-1001.
[22] 陈 磊,杨建荣,黄雪松.高效液相色谱法快速测定‘红富士’苹果渣中的6种多酚[J].食品与发酵工业,2008,34(8):158-161.
CHEN L,YANG J R,HUANG X S.Determination of 6 polyphenols in ‘Fuji’ apple pomace by high performance liquid chromatography [J].FoodandFermentationIndustry,2008,34(8):158-161.
[23] YIN Z,KE X,HUANG D,etal.Validation of reference genes for gene expression analysis inValsamalivar.maliusing real-time quantitative PCR[J].WorldJournalofMicrobiologyandBiotechnology,2013,29(9),1563-1571.
[24] 王 娟.青霉素对苹果树及腐烂病中根皮苷影响的研究[D].呼和浩特:内蒙古农业大学,2009.
WANG J.Study on the effect of penicillin on the apple tree and phloridzin of apple tree canker [D].Huhhot:Inner Mongolia Agricultural University,2009 .
[25] JUNG E,LEE J,HUH S,etal.Phloridzin-induced melanogenesis is mediated by the cAMP signaling pathway[J].FoodandChemicalToxicology,2009,47(10):2436-2440.
[26] BRAKHAGE A A,LIEBMANN B.Aspergillusfumigatusconidial pigment and cAMP signal transduction:significance for virulence[J].MedicalMycology,2005,43(sup1):75-82.
[27] TSAI H F,WHEELER M H,CHANG Y C,etal.A developmentally regulated gene cluster involved in conidial pigment biosynthesis inAspergillusfumigatus[J].JournalofBacteriology,1999,181(20):6469-6477.
[28] TSUJI G,KENMOCHI Y,TAKANO Y,etal.Novel fungal transcriptional activators,Cmr1p ofColletotrichumlagenariumand Pig1p ofMagnaporthegrisea,contain Cys2His2 zinc finger and Zn (Ⅱ) 2Cys6 binuclear cluster DNA-binding motifs and regulate transcription of melanin biosynthesis genes in a developmentally specific manner[J].MolecularMicrobiology,2000,38(5):940-954.

