丹参3个R2R3-MYB转录因子的亚细胞定位和自激活活性分析
丁 恺 ,麻鹏达,贾彦彦,裴天林,白朕卿,梁宗锁,2
(1.西北农林科技大学 生命科学学院,陕西杨凌 712100;2.浙江理工大学 生命科学学院,杭州 310018)
丹参(SalviamiltiorrhizaBunge)为药用模式植物,其水溶性的酚酸是发挥药理作用的主要物质[1-3],在临床医学研究中被用于治疗心脑血管疾病[4]。酚酸类物质的生物合成途径已经得到较为清晰的阐明[5-7]。转录因子可以同时调控代谢途径中多个基因,所以它成为植物次生代谢途径遗传改良的热点。R2R3-MYB转录因子在调控植物生长发育、次生代谢、响应生物和非生物胁迫等方面发挥重要作用[8-10]。R2R3-MYB可调控丹参的次生代谢,在丹参中过表达AtMYB75、SmPAP1或Rosea1,显著提高苯丙烷代谢途径基因的转录水平,进而提高迷迭香酸和丹酚酸B的含量[11-13]。在丹参毛状根中过表达ZmC1或ZmC1/R,降低酚酸的含量[14]。
拟南芥和丹参分别有125个[15]和110个R2R3-MYB[16]。根据进化分析,拟南芥中R2R3-MYB分成22个亚族[9,15],拟南芥和丹参的所有R2R3-MYB共分成37个亚族[16],同一亚族的R2R3-MYB往往在代谢中发挥相似的作用[10]。Liu等[10]结合结构分析和功能分析,归纳总结不同亚族的R2R3-MYB对于植物苯丙烷代谢的影响,大多数第4亚族成员对苯丙烷代谢途径发挥抑制作用。例如,SmMYB39可抑制丹参酚酸代谢途径基因的表达,进而抑制迷迭香酸和丹酚酸B的积累[17]。因此,结构分析对于探讨MYB转录因子的功能十分有参考价值。
转录因子的功能与其定位情况密切相关[18],转录因子可在细胞核中调控基因的转录,也有一些转录因子在细胞核外发挥作用[18-19]。细胞质是许多生理过程发生的场所,比如质体中的转录过程。转录因子的功能或定位情况可能会受到其他转录因子的影响[19]。例如,拟南芥的AtMYC1单独定位在细胞质,GL1单独定位在细胞核,AtMYC1和GL1之间可以互作;当进行AtMYC1和GL1共定位研究时,二者之间出现互作,且这种互作导致GL1重新定位到细胞质[19]。在发挥调控作用时,R2R3-MYB可单独作用,也可与bHLH和WD转录因子形成MBW复合体发挥作用[20-22]。因此,了解转录因子的定位情况和是否存在自激活活性,可以为探索转录因子的功能奠定基础。
本研究从进化、亚细胞定位和自激活活性分析3个角度对SmMYB33、SmMYB54和SmMYB93的功能进行探讨,为进一步研究3个转录因子的功能提供依据。
1 材料与方法
1.1 材 料
1.1.1 植物材料 选用当季新鲜洋葱用于亚细胞定位试验。
丹参种子由陕西天士力公司商洛基地提供。丹参种子先用自来水浸泡12 h,再用流动自来水冲洗12 h;经过预处理的种子在超净台中进行消毒,先用乙醇溶液(φ=75%)浸泡30 s,无菌水冲洗2次;再用HgCl2溶液(w=0.1%)浸泡15 min,无菌水冲洗7次;用镊子将种子均匀平铺在MS固体培养基,培养于组培间(温度约为25 ℃,光照度约为2 000 lx,光照时间为14 h)。选用2周龄丹参无菌苗,使用RNA提取试剂盒提取其总RNA,使用反转录试剂盒将总RNA反转录成cDNA,以cDNA为模板进行基因克隆。
1.1.2 质粒和菌种 质粒pA7-GFP由中药指纹图谱与天然产物库研究中心实验室(以下简称本实验室)保存;质粒pDONR207和pDEST-GBKT7由John Innes Centre的Cathie Martin教授赠予;克隆载体pMD19-T购自Invitrogen公司;酵母菌株AH109也由本实验室保存;大肠杆菌DH5α菌株感受态购自康为试剂公司。
1.1.3 主要试剂 RNA提取试剂盒购自北京天根公司;反转录试剂盒购自Takara公司;质粒提取试剂盒和胶回收试剂盒购自OMEGA公司;Gateway重组反应试剂盒购自Invitrogen公司;氨苄青霉素、庆大霉素和卡那霉素购自Amerosco公司;腺苷酸、组氨酸、色氨酸、3-氨基-1,2,4-三氮唑(3AT)和DAPI购自北京索莱宝公司;Taq聚合酶、T4连接酶和各限制性内切酶(SmaI、BamH I、XhoI和SpeI)购自Thermo Fisher公司。
1.2 方 法
1.2.1 引物设计和基因克隆 根据NCBI的Nucleotide数据库收录的SmMYB33、SmMYB54和SmMYB93序列,使用Primer Premier 6软件设计引物,用于扩增上述3个基因,引物序列详见表1,其中下划线标注的序列为酶切位点或接头引物序列。根据RNA提取试剂盒说明书,提取2周龄丹参小苗的全部RNA并以此为模板,根据反转录试剂盒说明书将其反转录成cDNA。使用上述模板和引物(F33/R33、F54/R54或F93/R93)进行PCR扩增、电泳检测;根据胶回收试剂盒说明书回收目的片段,分别连接克隆载体pMD19-T和转化大肠杆菌DH5α感受态细胞,经过PCR验证后送Invitrogen公司测序验证。对测序验证结果正确的菌株提取质粒,并分别命名为pMD19-T-SmMYB33、pMD19-T-SmMYB54和pMD19-T-SmMYB93。
1.2.2 载体构建 使用上述质粒(pMD19-T-SmMYB33、pMD19-T-SmMYB54或pMD19-T-SmMYB93)为模板,用表1中的引物(F332/R332、F542/R542、F932/R932、F333/R333、F543/R543、F933/R933)进行PCR扩增,将扩增产物用电泳检测并回收。
使用SmaI和BamHI分别双酶切pA7-GFP和F332/R332扩增得到的片段;使用XhoI和SpeI分别双酶切pA7-GFP、F542/R542和F932/R932扩增得到的片段。电泳检测并回收目的条带,使用T4连接酶将回收的载体和目的片段进行连接;将连接产物转化大肠杆菌DH5α感受态细胞,使用含氨苄青霉素的平板筛选阳性菌株;经过PCR验证后送Invitrogen公司测序验证。对测序结果正确的菌株提取质粒,并分别命名为pA7-GFP-SmMYB33、pA7-GFP-SmMYB54和pA7-GFP-SmMYB93。
根据Gateway重组反应试剂盒说明书,将引物(F333/R333、F543/R543或F933/R933)扩增回收得到的片段分别与pDONR207进行BP重组反应;反应产物转化大肠杆菌DH5α感受态细胞,使用含庆大霉素的平板筛选阳性菌株;经过PCR验证后送Invitrogen公司测序验证,对测序结果正确的菌株提取质粒,并分别命名为pDONR207-SmMYB33、pDONR207-SmMYB54和pDONR207-SmMYB93;将上述质粒分别与pDEST-GBKT7进行LR重组反应,反应产物转化大肠杆菌DH5α感受态细胞,使用含卡那霉素的平板筛选阳性菌株;经过PCR验证后送Invitrogen公司测序验证,对测序结果正确的菌株提取质粒,并分别命名为pDEST-GBKT7-SmMYB33、pDEST-GBKT7-SmMYB54和pDEST-GBKT7-SmMYB93。

表1 用于基因扩增的引物Table 1 Primers used for gene amplification
注:酶切位点序列用下划线标注;同源重组臂序列用斜体标注。
Note:Underlined sequences represent restriction enzyme sites; the italic sequences represent homologous recombination arm sequences.
1.2.3 生物信息学分析 将测序得到的核苷酸和氨基酸序列在NCBI中进行BLAST,并与得分最高的序列进行比对;使用SMART和SOPMA对其结构域和二级结构进行预测;使用MUSCLE法将Rosea1(ABB83826.1)、C1(P10290.1)、SmPAP1(ACZ48688.2)、SmMYB39(AGS48990.1)、SmMYB36和拟南芥的125条R2R3-MYB氨基酸序列进行多序列比对,然后使用MEGA 7.0软件的最大似然法构建系统进化树,参数为默认值;使用双向BLAST法寻找研究基因在拟南芥中的直系同源基因;根据进化树结果,选取进化上相近的成员进行二级结构分析,使用Clustal X2进行序列比对和BoxShade工具呈现比对结果。
1.2.4 亚细胞定位分析 参考张顺仓[23]的方法进行亚细胞定位试验。选取新鲜洋葱最内层葱瓣,用手术刀片将其切至1.5 cm×1.5 cm大小,快速撕取内表皮,平铺于MS固体培养基,25 ℃暗培养24 h。用基因枪法将质粒pA7-GFP、pA7-GFP-SmMYB33、pA7-GFP-SmMYB54和pA7-GFP-SmMYB93转化到内表皮,25 ℃共培养36 h后,用10 μg/mL DAPI染色20 min,再用pH 7.2的磷酸缓冲液清洗3次,制片,用激光共聚焦扫描显微镜在明场、激发光405 nm和激发光488 nm下进行观察。
1.2.5 自激活活性分析 分别转化质粒pDEST-GBKT7、pDEST-GBKT7-SmMYB33、pDEST-GBKT7-SmMYB54和pDEST-GBKT7-SmMYB93到酵母AH109感受态细胞,使用SD/-Trp培养基筛选菌株;挑取单克隆并使用SD/-Trp液体培养基扩繁到足够量,提取质粒送Invitrogen公司测序验证。将成功转化质粒的菌液分别稀释到原菌的1、1/10和1/100,分别在3AT浓度为0、5、10、15或20 mmol/L的SD/-Trp或SD/-Trp-His-Ade培养基上点斑验证,30 ℃暗培养3~4 d后观察并拍照记录。
2 结果与分析
2.1 基因克隆和鉴定
如图1,经PCR扩增得到738 bp的基因 SmMYB33,804 bp的基因 SmMYB54和495 bp的基因 SmMYB93。使用BLAST进行比对,发现测序得到序列SmMYB33的核苷酸序列(A363、C438和G654)与数据库中登录号为KF059387.1的序列(G363、T438和A654)有差异;测序得到的序列的氨基酸序列(G217)与数据库中登录号为AGN52057.1的序列(D217)也有差异。测序得到序列SmMYB54的核苷酸序列(A278、G281、C429、T504和T702)与数据库中登录号为KF059408.1的序列(T278、T281、T429、C504和G702)有差异;测序得到的序列的氨基酸序列(V255和H258)与数据库中登录号为AGN52078.1的序列(G255和Q258)也有差异。测序得到序列SmMYB93的核苷酸序列比数据库中登录号为KF059447.1的序列在379~380位之间多6个核苷酸(CTACTG),测序得到的序列的氨基酸序列比数据库中登录号为AGN52117.1的序列在127~128位之间多2个氨基酸(TA);此外,测序得到序列SmMYB93的核苷酸序列(G408)与数据库中登录号为KF059447.1的序列(A408)其他位点也存在差异,但氨基酸序列没有差异。以上差异可能由丹参品系差异造成。综上所述,所有序列符合预期。对上述质粒进行测序鉴定,测序结果正确。
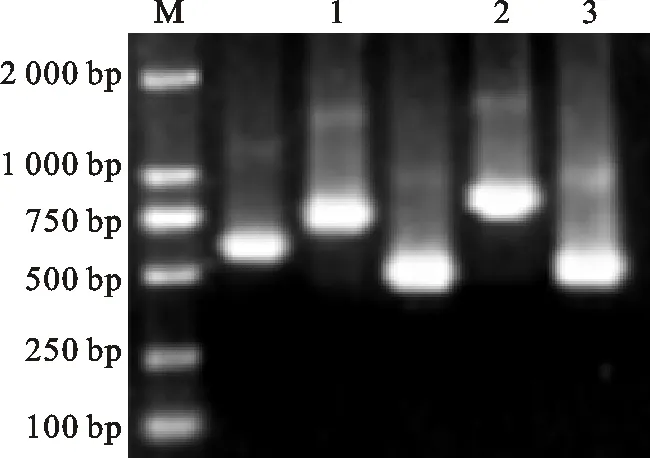
M.DL2000 marker;1. SmMYB33基因扩增产物 Amplification product of SmMYB33;2. SmMYB54基因扩增产物 Amplification product of SmMYB54;3. SmMYB93基因扩增产物 Amplification product of SmMYB93
图1SmMYB33、SmMYB54和SmMYB93基因的扩增
Fig.1AmplificationofSmMYB33,SmMYB54andSmMYB93
2.2 生物信息学分析
进化树分析表明,SmMYB33聚到第2亚族,SmMYB54和SmMYB93聚到第4亚族,详见图2。

在丹参中经过验证的R2R3-MYBs用黑色圆点标注 R2R3-MYBs which was identified inSalviamiltiorrhizawere emphasized with black dots
图2SmMYB33、SmMYB54和SmMYB93的进化树
Fig.2PhylogenetictreeofSmMYB33,SmMYB54andSmMYB93
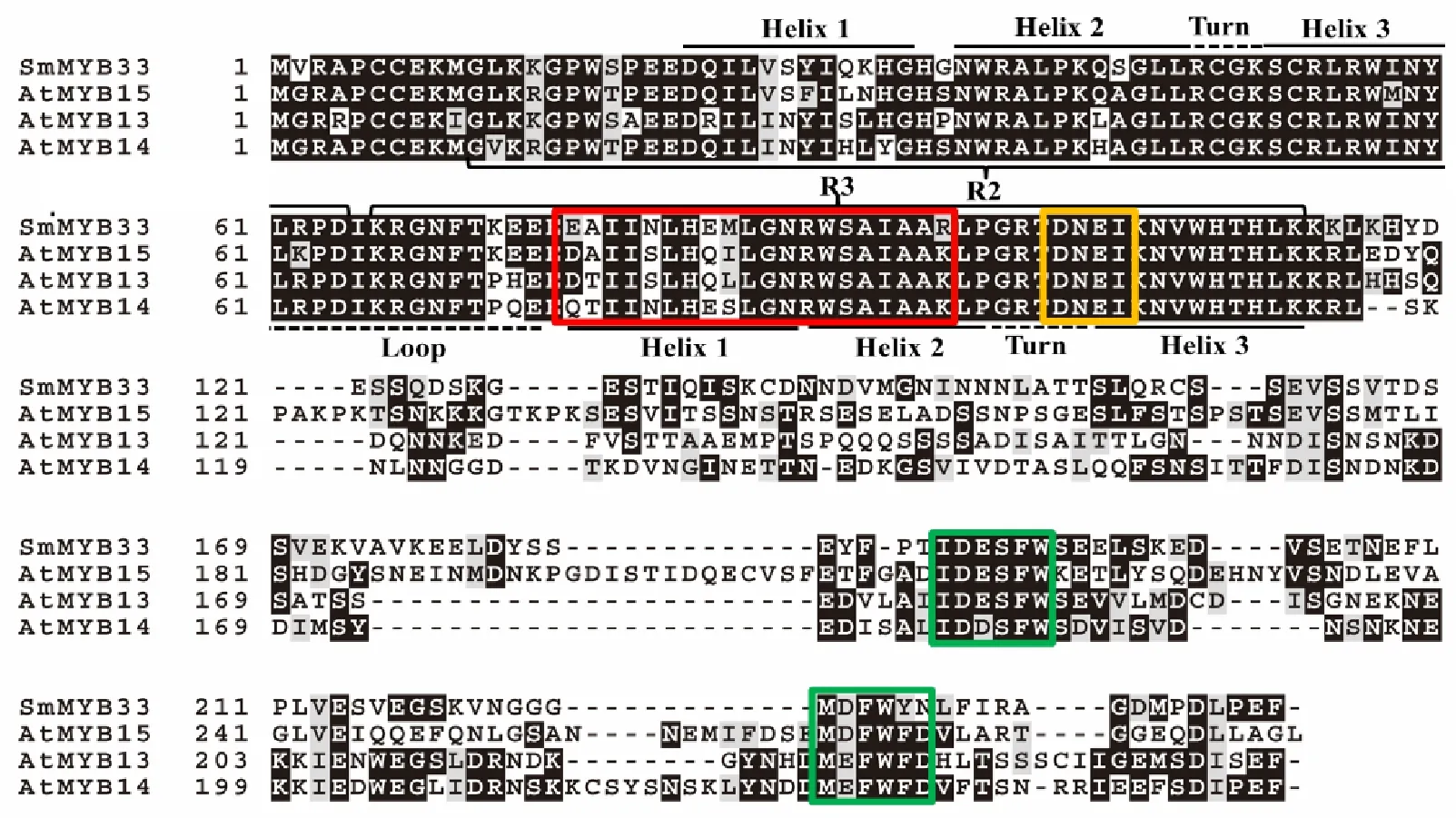
[D/E]Lx2[R/K]x3Lx6Lx3R二级结构用红色方框标出,DNEI二级结构用橙色方框标出,第2亚族特有二级结构IDxSFW-MxFWFD用绿色方框标出 The [D/E]Lx2[R/K]x3Lx6Lx3R motif was emphasized with red box,the DNEI motif was emphasized with orange box,and the IDxSFW-MxFWFD motif specific to subgroup 2 was emphasized with green box
图3SmMYB33的二级结构分析
Fig.3MotifanalysisofSmMYB33
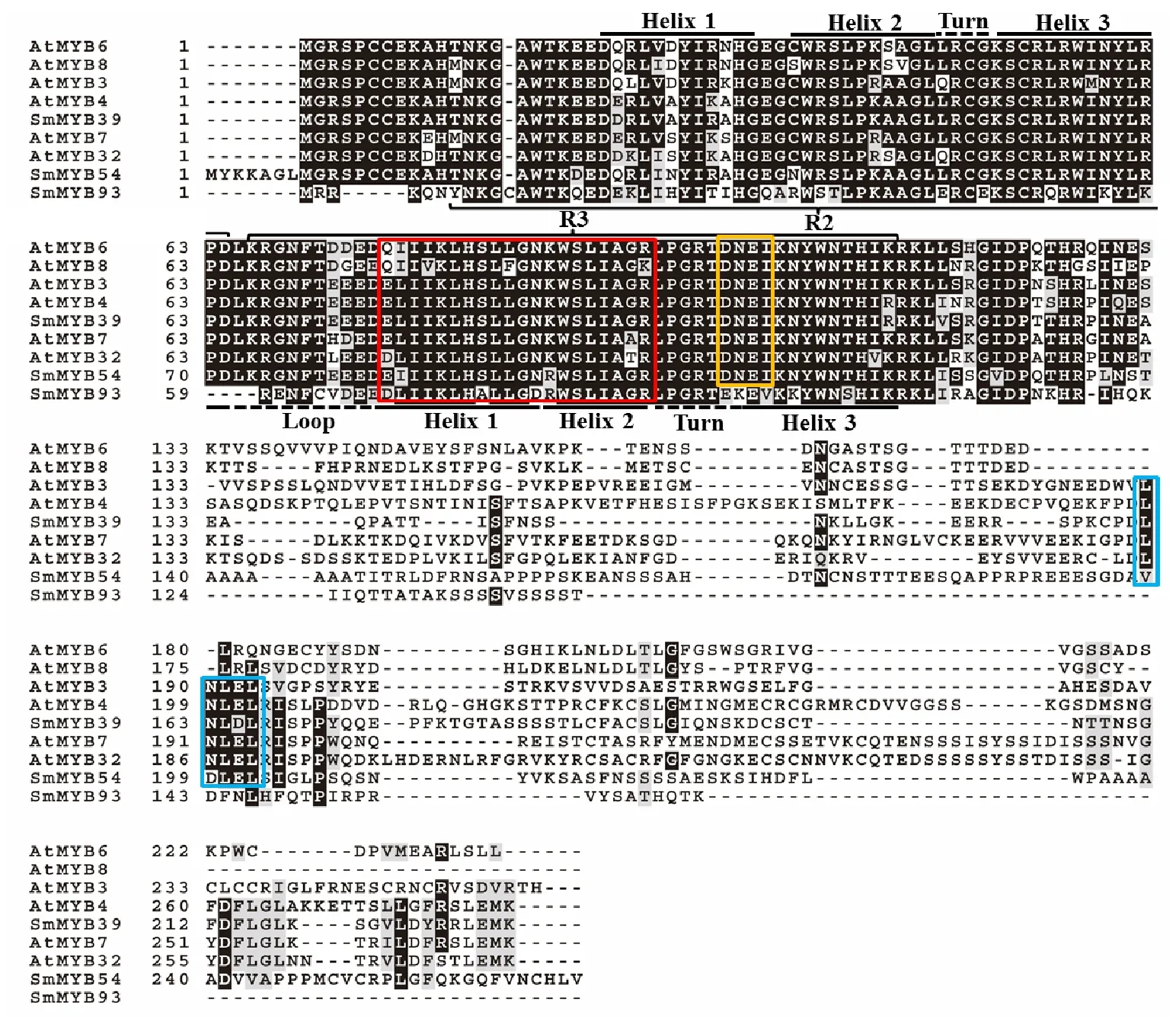
[D/E]Lx2[R/K]x3Lx6Lx3R二级结构用红色方框标出,DNEI二级结构用橙色方框标出,第4亚族特有二级结构LxL[E/D]L用蓝色方框标出 [D/E]Lx2[R/K]x3Lx6Lx3R motif was emphasized with red box,the DNEI motif was emphasized with orange box,and the LxL[E/D]L motif specific to subgroup 4 was emphasized with blue box
图4SmMYB54和SmMYB93的二级结构分析
Fig.4MotifanalysisofSmMYB54andSmMYB93
二级结构分析结果表明(图3和图4),SmMYB33、SmMYB54和SmMYB93含有R2R3型MYB转录因子特有的完整的R2和R3重复区域,并且每个重复区域含有1个螺旋—螺旋—转折—螺旋的二级结构。R2和R3重复区域的一级结构(-W-(X19)-W-(X19)-W-……-F/I/L/M-(X18)-W-(X18)-W-)与之前报道相同[9]。二级结构分析表明,SmMYB33、SmMYB54和SmMYB93的R3重复区含有[D/E]Lx2[R/K]x3Lx6Lx3R二级结构,这个结构是负责与bHLH蛋白互作的区域[24-25],表明这3个转录因子可能与某些bHLH转录因子存在互作;SmMYB33和SmMYB54含有DNEI结构[26],这是一个与调节原花青素合成密切相关的保守二级结构[9],表明这2个转录因子可能与原花青素合成密切相关;SmMYB33含有第2亚族特有的IDxSFW--MxFWFD结构[9];SmMYB54含有第4亚族特有的LxL[E/D]L结构[9]。使用双向BLAST法找到SmMYB33在拟南芥中的直系同源基因为 AtMYB15,没有找到 SmMYB54和 SmMYB93在拟南芥中的直系同源基因。
2.3 亚细胞定位
如图5,细胞核和细胞质均出现空载对照的绿色荧光;融合GFP的SmMYB33、SmMYB54和SmMYB93的绿色荧光在细胞核和细胞质中均可以被观察到,在细胞核中绿色荧光十分明亮,而在细胞质中绿色荧光呈弥散状态。
2.4 自激活活性分析
如图6,转化质粒pDEST-GBKT7、pDEST-GBKT7-SmMYB33、pDEST-GBKT7-SmMYB54和pDEST-GBKT7-SmMYB93的酵母均能够在含有不同浓度抑制剂的SD/-Trp+3AT培养基正常生长。在含有不同浓度抑制剂的SD/-Trp-His-Ade+3AT培养基上,转化质粒pDEST-GBKT7、pDEST-GBKT7-SmMYB54和pDEST-GBKT7-SmMYB93的酵母均不能生长;转化质粒pDEST-GBKT7-SmMYB33的酵母能够生长,这表明 SmMYB33能够在酵母中正确转录和翻译,并能够自己激活报告基因的转录和翻译,但是随着抑制剂3AT浓度的增加,酵母的生长受到明显抑制。这表明SmMYB33有自激活活性,SmMYB54和SmMYB93没有自激活活性。

1.明场 Bright field;2.绿色荧光蛋白的荧光场 Green fluorescent field of GFP;3.DAPI染料的荧光场 Blue fluorescent field of DAPI;4.拟合结果 Merged results
图5SmMYB33、SmMYB54和SmMYB93在洋葱表皮细胞中的亚细胞定位结果
Fig.5SubcellularlocalizationofSmMYB33,SmMYB54andSmMYB93inonionepidermalcells

图6 SmMYB33、SmMYB54和SmMYB93的自激活活性分析Fig.6 Transactivation analysis of SmMYB33,SmMYB54 and SmMYB93
3 讨 论
进化树分析和二级结构分析表明SmMYB33、SmMYB54和SmMYB93是典型的R2R3-MYB类型的转录因子。转录因子的功能与结构密切相关[10]。进化树结果表明SmMYB33聚到第2亚族,二级结构分析发现SmMYB33含有第2亚族特有的二级结构,使用双向BLAST法得到 SmMYB33的直系同源基因为 AtMYB15,以上结果表明SmMYB33属于R2R3-MYB转录因子第2亚族。在拟南芥中过表达 AtMYB15上调了莽草酸途径中所有酶基因的表达,这暗示SmMYB33可能像AtMYB15一样,能够调控苯丙烷代谢通用途径,影响丹参酚酸类物质的积累[27]。SmMYB54聚到第4亚族且含有第4亚族特有的二级结构,这表明SmMYB54属于R2R3-MYB转录因子第4亚族。SmMYB93聚到第4亚族但不含有第4亚族特有的二级结构,不能确定 SmMYB93属于哪个亚族。第4亚族的R2R3-MYB对苯丙烷代谢途径常发挥抑制作用[10],如在丹参毛状根中过表达 SmMYB39显著抑制酚酸类物质的积累[17]。SmMYB54属于第4亚族,SmMYB93与第4亚族进化距离较近,这暗示这2个转录因子可能对苯丙烷代谢通用途径有抑制作用,影响丹参酚酸类物质的积累。通过对转录因子进行结构分析,找到与它们进化距离较近的已知功能的转录因子,可以为其功能研究提供参考。
亚细胞定位结果表明,3个转录因子均可以定位在细胞核,暗示3个转录因子能够调控细胞核中靶基因的转录过程。细胞质是许多生理过程发生的场所,3个转录因子也可能参与蛋白细胞质中的一些生理过程,比如质体中的转录过程。转录因子的功能或定位情况可能会受到其他转录因子的影响[19]。类似地,某些bHLH蛋白可能和上述3个转录因子协同互作,共同调控细胞质和细胞核中的生理过程,但还需要更多的试验来验证这些猜想。
SmMYB33有自激活活性,若想利用酵母双杂交系统筛选与SmMYB33互作的蛋白,需要找到并去除其转录自激活结构域,并确认其失去自激活活性。SmMYB54和SmMYB93没有自激活活性,二者的载体可用于酵母双杂交系统筛选与其互作的蛋白。本研究中的自激活试验为进一步探索3个转录因子的功能提供依据。
参考文献Reference:
[1] CHEN H,FENG C,CHIU F C K,etal.The effect of yeast elicitor on the growth and secondary metabolism of hairy root cultures ofSalviamiltiorrhiza[J].Enzyme&MicrobialTechnology,2001,28(1):100-105.
[2] PETERSEN M,SIMMONDS M S J.Molecules of interest rosmarinic acid[J].Phytochemistry,2003,62:121-125.
[3] LIU A H,LI L,XU M,etal.Simultaneous quantification of six major phenolic acids in the roots ofSalviamiltiorrhizaand four related traditional Chinese medicinal preparations by HPLC-DAD method[J].JournalofPharmaceutical&BiomedicalAnalysis,2006,41(1):48-56.
[4] LI C J,ZHANG D M,LUO Y M,etal.Bis-sesquiterpenes and diterpenes fromChloranthushenryi[J].Phytochemistry,2008,69(16):2867-2874.
[5] DI P,ZHANG L,CHEN J,etal.C tracer reveals phenolic acids biosynthesis in hairy root cultures ofSalviamiltiorrhiza[J].AcsChemicalBiology,2013,8(7):1537-1548.
[6] PETERSEN M.Rosmarinic acid:new aspects[J].PhytochemistryReviews,2013,12(1):207-227.
[7] MA X H,MA Y,TANG J F,etal.The biosynthetic pathways of tanshinones and phenolic acids inSalviamiltiorrhiza[J].Molecules,2015,20(9):16235-16254.
[8] MARTIN C,PAZARES J.MYB transcription factors in plants[J].TrendsinGenetics,1997,13(2):67-73.
[9] DUBOS C,STRACKE R,GROTEWOLD E,etal.MYB transcription factors inArabidopsis[J].TrendsinPlantScience,2010,15(10):573-581.
[10] LIU J,OSBOURN A,MA P.MYB transcription factors as regulators of phenylpropanoid metabolism in plants[J].MolecularPlant,2015,8(5):689-708.
[11] WANG D,SONG Y,CHEN Y,etal.Metabolic pools of phenolic acids inSalviamiltiorrhizaare enhanced by co-expression ofAntirrhinummajusDelila andRosealtranscription factors[J].BiochemicalEngineeringJournal,2013,74(7):115-120.
[12] YUAN Z,YAN Y P,WANG Z Z.The Arabidopsis PAP1 transcription factor plays an important role in the enrichment of phenolic acids inSalviamiltiorrhiza[J].JournalofAgricultural&FoodChemistry,2010,58(23):12168-12175.
[13] HAO G,JIANG X,FENG L,etal.Cloning,molecular characterization and functional analysis of a putative R2R3-MYB transcription factor of the phenolic acid biosynthetic pathway inS.miltiorrhizaBge.f.alba[J].PlantCellTissue&OrganCulture,2016,124(1):151-168.
[14] ZHAO S.Enhancing diterpenoid concentration inSalviamiltiorrhizahairy roots through pathway engineering with maize C1 transcription factor[J].JournalofExperimentalBotany,2015,66(22):7211-7226.
[15] STRACKE R,WERBER M,WEISSHAAR B.The R2R3-MYB gene family inArabidopsisthaliana[J].CurrentOpinioninPlantBiology,2001,4(5):447-456.
[16] LI C,LU S.Genome-wide characterization and comparative analysis of R2R3-MYB transcription factors shows the complexity of MYB-associated regulatory networks inSalviamiltiorrhiza[J].BmcGenomics,2014,15(1):1-12.
[17] ZHANG S,MA P,YANG D,etal.Cloning and characterization of a putative R2R3 MYB transcriptional repressor of the rosmarinic acid biosynthetic pathway fromSalviamiltiorrhiza[J].PlosOne,2013,8(9):e73259.
[18] MILLAR A H,CARRIE C,POGSON B,etal.Exploring the function-location nexus:using multiple lines of evidence in defining the subcellular location of plant proteins[J].PlantCell,2009,21(6):1625-1631.
[19] PESCH M,SCHULTHEI I,DIGIUNI S,etal.Mutual control of intracellular localisation of the patterning proteins AtMYC1,GL1 and TRY/CPC inArabidopsis[J].Development,2013,140(16):3456-3467.
[20] NESI N,JOND C,DEBEAUJON I,etal.TheArabidopsisTT2 gene encodes an R2R3 MYB domain protein that acts as a key determinant for proanthocyanidin accumulation in developing seed[J].PlantCell,2001,13(9):2099-2114.
[21] BAUDRY A,HEIM M A,DUBREUCQ B,etal.TT2,TT8,and TTG1 synergistically specify the expression of BANYULS and proanthocyanidin biosynthesis inArabidopsisthaliana[J].PlantJournalforCell&MolecularBiology,2004,39(3):366-380.
[22] BAUDRY A,CABOCHE M,LEPINIEC L.TT8 controls its own expression in a feedback regulation involving TTG1 and homologous MYB and bHLH factors,allowing a strong and cell-specific accumulation of flavonoids inArabidopsisthaliana[J].PlantJournal,2006,46(5):768-779.
[23] 张顺仓.丹参酚酸类成分生源合成调控相关基因的克隆与功能研究[D].陕西杨凌:西北农林科技大学,2014.
ZHANG SH C.Cloning and characterization of related genes involved in the regulation of phenolic acids biosynthesis inSalviamiltiorrhizaBunge[D].Yangling Shaanxi:Northwest A&F University,2014.
[24] BOGS J,JAFF F W,TAKOS A M,etal.The grapevine transcription factor VvMYBPA1 regulates proanthocyanidin synthesis during fruit development[J].PlantPhysiology,2007,143(3):1347-1361.
[25] DELUC L,BOGS J,WALKER A R,etal.The transcription factor VvMYB5b contributes to the regulation of anthocyanin and proanthocyanidin biosynthesis in developing grape berries[J].PlantPhysiology,2008,147(4):2041-2053.
[26] HEPPEL S C,JAFF F W,TAKOS A M,etal.Identification of key amino acids for the evolution of promoter target specificity of anthocyanin and proanthocyanidin regulating MYB factors[J].PlantMolecularBiology,2013,82(4/5):457-471.
[27] CHEN Y,ZHANG X,WU W,etal.Overexpression of the wounding-responsive gene AtMYB15 activates the shikimate pathway inArabidopsis[J].Circuits&SystemsIRegularPapersIEEETransactionson,2004,51(10):2017-2030.

