土木香提取物抑制金黄色葡萄球菌毒力因子分泌作用的研究
汤法银,刘桓妤,李文华,邓旭明,王建锋
(1.吉林大学动物医学学院,吉林 长春 130062;2.河南牧业经济学院制药工程学院,河南 郑州 450046;3.长春中医药大学基础医学院,吉林 长春 130117)
金黄色葡萄球菌(Staphylococcus aureus),广泛分布于自然界中,是临床上常见的人兽共患病原菌,可引起人和动物的多种致死性感染,也可导致食物中毒或胃肠炎等。金黄色葡萄球菌也是奶牛乳房炎主要致病菌之一,严重威胁乳业的发展。日益严重的耐药性使得金黄色葡萄球菌感染的治疗更加复杂化。金黄色葡萄球菌致病机制相关研究结果表明,金黄色葡萄球菌在宿主体内建立感染与其分泌的各种外毒素密切相关,且金黄色葡萄球菌致病力与其表达毒力因子的能力呈正相关[1-3]。
金黄色葡萄球菌可分泌超过30余种的外毒素,包括α-溶血素、肠毒素和毒性休克综合征毒素-1(TSST-1)等[3-4]。α-溶血素是由致病性金黄色葡萄球菌分泌的一种成孔毒素,一般以单体形式分泌,可与多种宿主细胞,如红细胞、嗜中性粒细胞和上皮细胞等结合并在靶细胞细胞膜形成一个七聚体的跨膜通道,导致细胞内容物外溢及细胞死亡[5-6]。肠毒素和TSST-1是金黄色葡萄球菌分泌的超抗原蛋白,是引起金黄色葡萄球菌食物中毒和中毒性休克综合征的主要致病毒力因子。该类毒素分子量为20~30 kDa,可直接与细胞表面的MHCⅡ类分子结合,活化宿主T淋巴细胞并诱导肿瘤坏死因子(TNF-α)等细胞因子的释放[7-8]。
已有研究报道,多种天然化合物或中药提取物可抑制金黄色葡萄球菌外毒素的分泌,部分揭示了中药抗病原菌感染机制。土木香作为临床常用中药,具有健脾和胃、行气止痛的功效,化学成分丰富,药理活性多样[9-10]。然而土木香对金黄色葡萄球菌毒力因子表达的影响尚未见报道。
1 材料与方法
1.1 菌株和实验动物 耐药性金黄色葡萄球菌USA 300,购自美国模式培养物集存库(ATCC);雌性BALB/c小鼠(6~8周,体重20~22 g)购自吉林大学医学部实验动物中心。
1.2 试剂 土木香根,购自安徽亳州市;乙醇,购自天津新通精细化工有限公司;蛋白免疫印迹分析所需的抗体(抗金黄色葡萄球菌α-溶血素、肠毒素A、TSST-1多克隆抗体和HRP标记的二抗)、ECL发光液和溶葡萄球菌素,购自Sigma公司;TaKaRa RNA PCR kit(AMV)Ver.3.0和SYBR Premix Ex TaqTM来自TaKaRa公司;ELISA MAXTMStandard SET Mouse TNF-α来自Biolegend公司;脱纤维兔血,购自森贝伽(南京)生物科技有限公司。
1.3 方法
1.3.1 土木香提取物制备 土木香根粉碎过筛,称取药材20 g,加入200 mL 95%乙醇,35℃震荡(140 r/min)浸提3 h,减压抽滤,滤渣再次加入200 mL 95%乙醇,35℃震荡(140 r/min),浸提3 h,减压抽滤,合并上述两次滤液,减压浓缩得到提取物,-4℃保存备用,使用前用DMSO溶解。
1.3.2 最小抑菌浓度测定 根据CLSI(Clinical And Laboratory Standards Institute)公布的标准方法,采用肉汤微量稀释法测定土木香提取物对金黄色葡萄球菌USA 300的最小抑菌浓度(MIC)。
1.3.3 溶血试验 金黄色葡萄球菌USA 300培养于TSB培养基至对数生长前期(OD600nm值=0.3),分别加入不同浓度(16、32、64 μg/mL 和 128 μg/mL)土木香提取物,继续培养(37℃,200 r/min)至对数生长后期(OD600nm值=2.5),10 000 r/min离心1 min,收集培养物上清。 875 μL PBS、100 μL 培养物上清和25 μL脱纤维兔血反应体系混匀后置于生化培养箱内37℃孵育20 min,10 000 r/min离心1 min,收集反应体系上清并检测样品的吸光度值(OD543nm)。去离子水为阳性对照组,设定为100%溶血,PBS设定为阴性对照组,0%溶血,每组样品溶血比例与阳性对照组做比。
1.3.4 肿瘤坏死因子(TNF-α)释放试验 雌性BALB/c小鼠(6~8周,体重20~22 g)颈椎脱臼处死后,无菌操作收集小鼠脾淋巴细胞并培养于RPMI-1640完全培养基中48 h,铺板于96孔板中(1×106个细胞/孔)。
金黄色葡萄球菌USA 300过夜培养于RPMI 1640培养基中后按1∶30比例扩大培养于RPMI 1640,分别加入不同浓度土木香提取物(16、32、64 μg/mL和128 μg/mL),继续培养(37 ℃,200 r/min)4 h,离心(10 000 r/min,1 min)收集培养物上清,0.2 μm 的滤膜过滤培养物上清,-4℃保存备用。
50 μL上述培养物上清加入已铺板的96孔细胞培养孔内,培养(37℃,5%CO2)16 h,离心(1 000 r/min离心10 min)取上清,应用 Mouse TNF-α ELISA MAXTMSet Standard检测试剂盒分析样品内TNF-α含量。
1.3.5 生长曲线测定 金黄色葡萄球菌USA 300培养于TSB培养基至对数生长前期(OD600nm值=0.3),分别加入不同浓度(16、32、64 μg/mL 和 128 μg/mL)土木香提取物,继续培养(37℃,200 r/min)并每隔30 min检测每个样品的吸光度值(OD600nm)。
1.3.6 免疫印迹分析 金黄色葡萄球菌USA 300培养于TSB培养基至对数生长前期(OD600nm值=0.3),分别加入不同浓度(16、32、64 μg/mL 和 128 μg/mL)土木香提取物,继续培养(37℃,200 r/min)至对数生长后期(OD600nm值=2.5),10 000 r/min离心1 min,收集培养物上清。培养物上清上样于SDS-PAGE并应用半干式转膜仪将蛋白转至PVDF膜上,5%脱脂奶粉封闭PVDF膜2 h,一抗(抗金黄色葡萄球菌α-溶血素、肠毒素A、TSST-1多克隆抗体)常温孵育2 h,HRP标记的二抗常温孵育2 h,应用ECL发光液检测目的蛋白含量。
1.3.7 荧光定量PCR分析 金黄色葡萄球菌USA 300培养于TSB培养基至对数生长前期(OD600nm值=0.3),分别加入不同浓度(16、32、64 μg/mL 和128 μg/mL)土木香提取物,继续培养(37℃,200 r/min)至对数生长后期(OD600nm值 =2.5),10 000 r/min离心1 min,收集细菌。溶葡萄球菌素(100 μg/mL)重悬菌体孵育(37℃,10 min),应用 Qiagen RNeasy Maxi column提取菌体RNA,TaKaRa RNA PCR kit(AMV)Ver.3.0试剂盒反转录合成cDNA,SYBR Premix Ex TaqTM试剂盒 PCR扩增,通过△△Ct法分析基因的相对表达水平,以gyrBRNA为持家基因。荧光定量PCR试验引物见表1,PCR反应体系(25 μL)循环参数为:95℃ 变性30 s,95℃5 s,55℃ 30 s,72℃ 40 s,运行40个循环。

表1 荧光定量PCR引物
1.3.8 统计分析 对照组加入等量的溶剂(DMSO),数据以X±SD表示,均来自3次独立试验结果,应用Prism 5.0对组间数据进行t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 土木香提取物无抗金黄色葡萄球菌活性 最小抑菌浓度试验结果表明,土木香提取物对金黄色葡萄球菌USA 300的MIC高于1 024 μg/mL,提示土木香提取物对受试金黄色葡萄球菌无抗菌活性。当不同浓度土木香提取物(16、32、64 μg/mL和128 μg/mL)与金黄色葡萄球菌共培养后,所有药物处理组对金黄色葡萄球菌生长几乎无任何影响(图1),进一步提示土木香提取物处理对金黄色葡萄球菌生长无抑制作用。
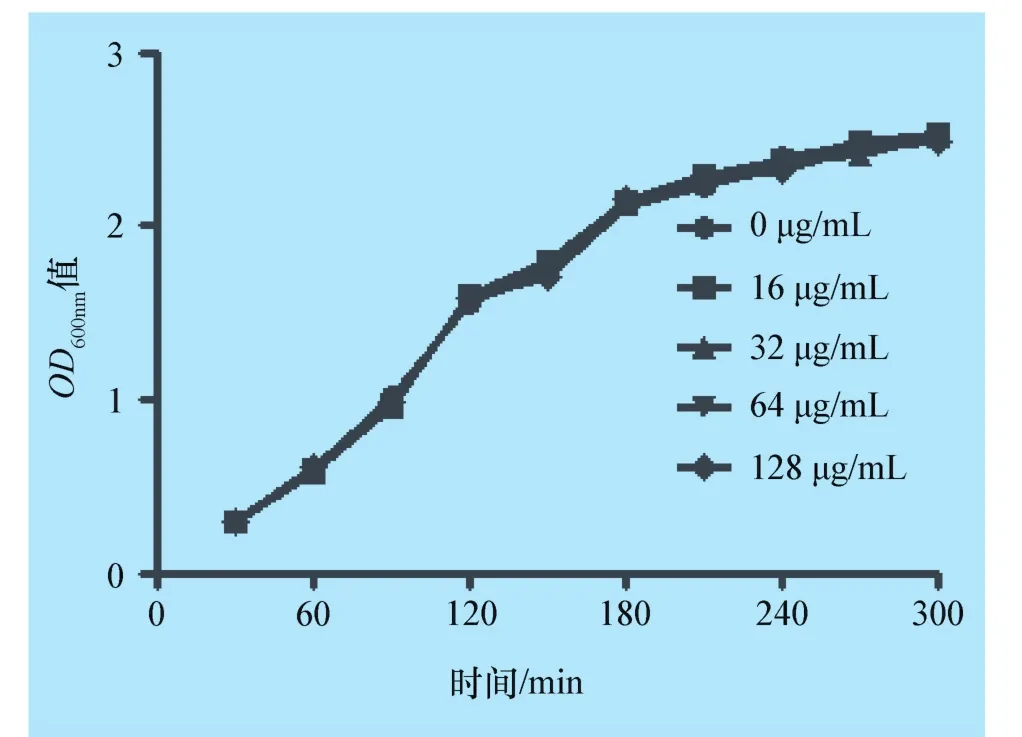
图1 土木香提取物与金黄色葡萄球菌USA 300共培养生长曲线
2.2 土木香提取物抑制金黄色葡萄球菌培养物上清溶血活性 溶血试验是筛选潜在的抗金黄色葡萄球菌α-溶血素抑制剂的经典方法。如图2所示,土木香提取物与金黄色葡萄球菌共培养后,培养物上清的溶血活性显著降低,当土木香提取物浓度为16、32、64 μg/mL 和128 μg/mL,培养物上清溶血活性从无药物处理组的89.26%(样品与100%溶血阳性对照相比)下降至 81.43%、44.19%、15.31% 和4.92%,且这一抑制作用呈现明显的剂量依赖性。
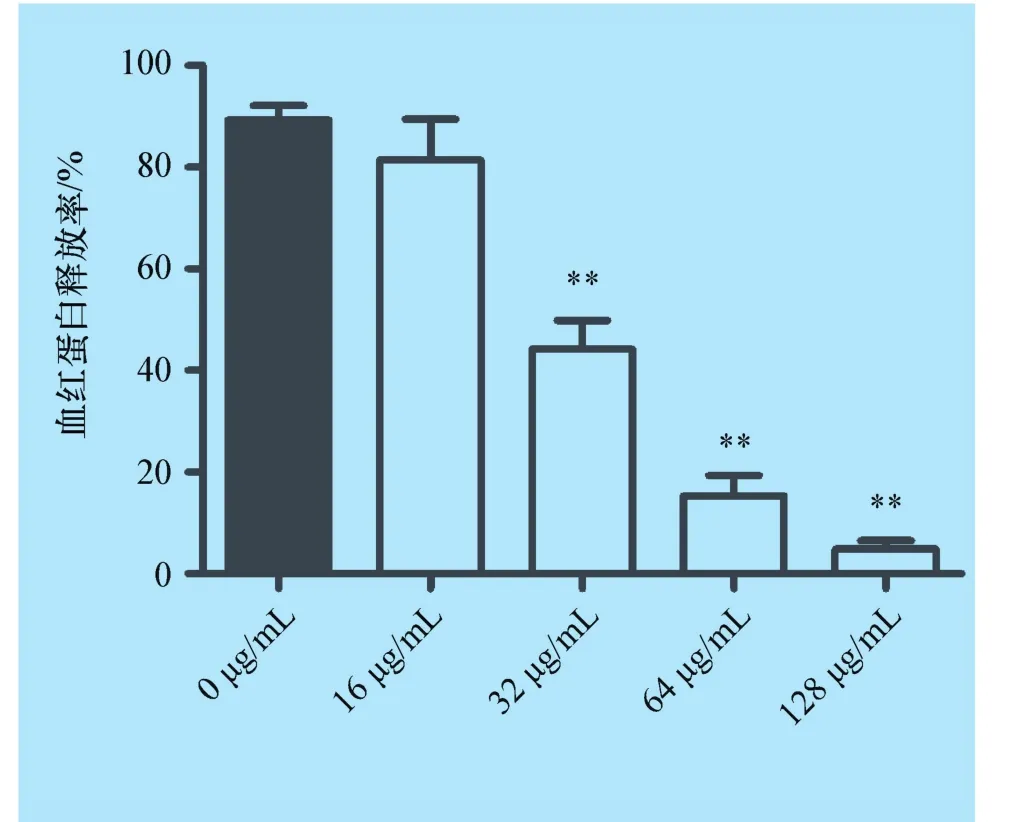
图2 土木香提取物与金黄色葡萄球菌USA 300共培养后培养物上清溶血活性
2.3 土木香提取物抑制金黄色葡萄球菌培养物上清刺激小鼠脾淋巴细胞释放TNF-α的活性金黄色葡萄球菌肠毒素和TSST-1都具有超抗原活性,可刺激脾淋巴细胞释放TNF-α。金黄色葡萄球菌USA 300培养物上清与小鼠脾淋巴细胞共培养后可显著刺激宿主细胞释放TNF-α,但土木香提取物处理后可显著降低培养物这一刺激活性,且这一作用与土木香提取物抑制细菌α-溶血素分泌作用相类似,也明显呈现浓度依赖性(图3)。
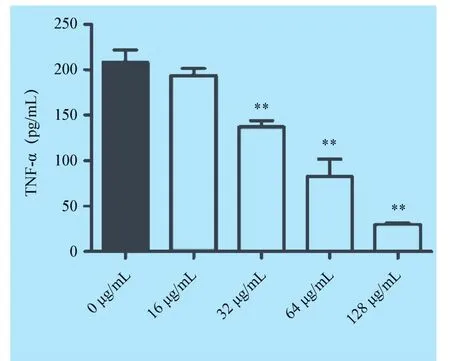
图3 土木香提取物与金黄色葡萄球菌USA 300共培养后培养物上清诱导脾淋巴细胞释放TNF-α活性
2.4 土木香提取物抑制金黄色葡萄球菌外毒素的表达 溶血试验和小鼠脾淋巴细胞TNF-α释放试验结果表明,土木香提取物处理后可降低培养物上清介导的溶血活性和刺激淋巴细胞TNF-α释放的活性。为了进一步证实上述抑制作用是否是由于土木香提取物处理抑制金黄色葡萄球菌外毒素表达,本研究通过蛋白免疫印迹试验分析了金黄色葡萄球菌培养物上清α-溶血素、肠毒素和TSST-1的含量。结果如图4所示,土木香提取物处理后显著降低金黄色葡萄球菌培养物上清α-溶血素、肠毒素和TSST-1的表达。
2.5 土木香提取物抑制金黄色葡萄球菌hla、sea、tst和agrA基因转录 金黄色葡萄球菌二元调控系统agrA是调控外毒素表达的重要的调控子,本研究进一步分析了土木香提取物对金黄色葡萄球菌α-溶血素、肠毒素A和TSST-1编码基因hla、sea和tst以及其正向调控系统agrA转录的影响。结果如图5所示,与无药物处理对照组相比,土木香提取物处理后金黄色葡萄球菌hla、sea、tst和agrA转录明显降低。 药物浓度为 128 μg/mL 时,hla、sea、tst和agrA 分别下调了 6.57、5.58、5.07 倍和 7.05 倍。 这一抑制作用与药物抑制细菌α-溶血素、肠毒素和TSST-1分泌相一致。
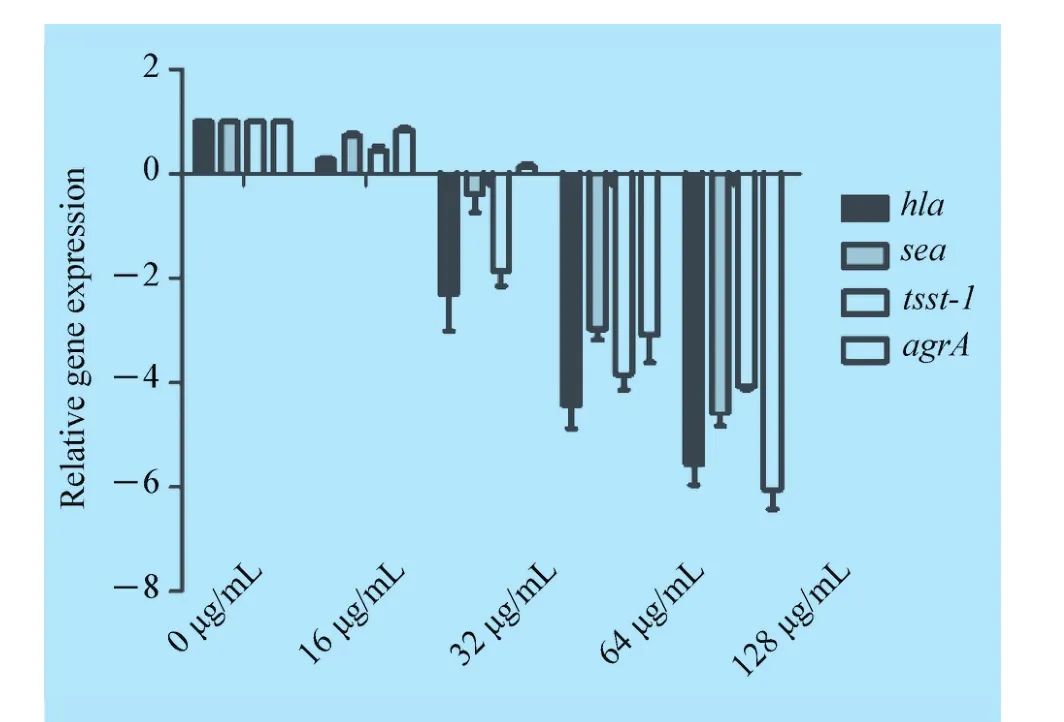
图5 土木香提取物与金黄色葡萄球菌USA 300共培养hla、sea、tst和agrA基因相对表达水平
3 讨论
抗生素主要是通过抑制靶细菌DNA、蛋白质和细胞膜的形成而清除宿主体内的病原菌,但这一作用机制给予病原菌选择压力较大,较易诱导耐药性的发生和发展。近年来由于抗生素的滥用等因素导致细菌耐药性越演越烈,已成为21世纪亟待解决的世纪性难题。万古霉素等被认为是防治金黄色葡萄球菌等耐药性病原菌感染的最后一道防线,但是随着耐万古霉素金黄色葡萄球菌及“超级细菌”的出现,临床上对于金黄色葡萄球菌感染治疗日益艰难。随着人们对病原菌致病机制的逐步深入研究,以病原菌毒力因子为靶标的抗毒力策略日益受到多个领域的科研人员关注。与传统抗生素杀菌或抑菌活性不一致,由于毒力因子常常不是细菌生命所必需的成分,因此抗毒力策略给予靶细菌选择压力较小,不易诱导细菌耐药性[11]。
本试验通过溶血试验和脾淋巴细胞TNF-α释放试验对耐药性金黄色葡萄球菌毒力因子抑制剂进行筛选,初步发现土木香提取物与金黄色葡萄球菌共培养后可显著降低金黄色葡萄球菌培养物上清中α-溶血素和超抗原(肠毒素A和TSST-1)的活性。这一抑制作用需要较高浓度的提取物,当浓度低于或等于16 μg/mL,土木香提取物对金黄色葡萄球菌培养物上清溶血活性和超抗原刺激活性无显著影响,但当浓度等于或高于32 μg/mL,土木香提取物与金黄色葡萄球菌共培养后可显著降低细菌培养物上清溶血活性和抗原刺激活性。抗菌活性试验研究表明,在土木香提取物有效活性浓度范围内(16、32、64 μg/mL 和 128 μg/mL),药物对金黄色葡萄球菌生长几乎无影响,提示这一抑制作用不是由于土木香提取物抑制金黄色葡萄球菌生长所导致的,表明土木香提取物对金黄色葡萄球菌选择压力较小,不易诱导耐药性的发生和发展。
为了进一步研究土木香提取物对金黄色葡萄球菌毒力因子作用,蛋白免疫印迹分析发现,土木香提取物与耐药性金黄色葡萄球菌USA 300共培养后,可显著抑制金黄色葡萄球菌α-溶血素、肠毒素A和TSST-1的表达,表明土木香提取物是抗金黄色葡萄球菌感染的潜在的抗毒力先导复合物。荧光定量PCR试验表明,土木香提取物处理可显著降低上述毒力蛋白编码基因(hla、sea和tst)及二元调控系统agrA的转录。金黄色葡萄球菌外毒素表达受到多个调控系统组成的调控网络控制[12-14],因此本研究结果表明,土木香提取物抑制金黄色葡萄球菌外毒素表达部分依赖于药物降低agrA二元调控系统的转录。
已有研究表明,部分传统抗生素治疗会诱导金黄色葡萄球菌外毒素分泌而加重临床感染[15],提示土木香提取物可与抗生素联合用药以改善这一不良作用。另外,土木香提取物以细菌毒力因子为靶标,对细菌选择压力小,也可减少或部分替代抗生素的使用,降低细菌耐药性及延长抗生素的使用寿命。
4 结论
土木香提取物处理可显著降低金黄色葡萄球菌USA 300主要毒力因子α-溶血素、肠毒素A和TSST-1的表达,这一抑制作用部分通过降低金黄色葡萄球菌二元调控系统agrA的转录。研究结果提示,土木香提取物是一种潜在的抗金黄色葡萄球菌感染先导复合物。
参考文献:
[1] Dragulescu E C,Codita I.Host-Pathogen Interaction In Infections Due To Staphylococcus Aureus.Staphylococcus Aureus Virulence Factors[J].Roumanian archives of microbiology and immunology,2015,74(1-2):46-64.
[2] Kumar A,Kumar A.Role of Staphylococcus aureus Virulence Factors in Inducing Inflammation and Vascular Permeability in a Mouse Model of Bacterial Endophthalmitis[J].PloS one,2015,10(6):e0128423.
[3] Zecconi A,Scali F.Staphylococcus aureus virulence factors in evasion from innate immune defenses in human and animal diseases[J].Immunology letters,2013,150(1-2):12-22.
[4] Gonzalez-Dominguez M,Seral C,Potel C,et al.Antimicrobial resistance,virulence factors and genetic lineages of hospital-onset methicillin-resistant Staphylococcus aureus isolates detected in a hospital in Zaragoza[J].Enfermedades infecciosasy microbiologia clinica,2015,33(9):590-596.
[5] Berube B J,Wardenburg J B.Staphylococcus aureus alpha-Toxin:Nearly a Century of Intrigue[J].Toxins,2013,5(6):1 140-1 166.
[6] Liu C,Chen Z J,Sun Z,et al.Molecular characteristics and virulence factors in methicillin-susceptible,resistant,and heterogeneous vancomycin-intermediate Staphylococcus aureus from central-southern China[J].J Microbiol Immunol Infect,2015,48(5):490-496.
[7] Reddy P N,Paul S,Sripathy M H,et al.Evaluation of recombinant SEA-TSST fusion toxoid for protection against superantigen induced toxicity in mouse model[J].Toxicon,2015,103:106-113.
[8] Kim Y J,Oh D H,Song B R,et al.Molecular Characterization,Antibiotic Resistance,and Virulence Factors of Methicillin-Resistant Staphylococcus aureus Strains Isolated from Imported and Domestic Meat in Korea[J].Foodborne pathogens and disease,2015,12(5):390-398.
[9] 赵永明.土木香化学成分的研究[D].石家庄:河北医科大学,2007.
[10] 赵永明,张嫚丽,霍长虹,等.土木香化学成分的研究[J].天然产物研究与开发,2009,21(4):616-618.
[11] Cegelski L,Marshall G R,Eldridge G R,et al.The biology and future prospects of antivirulence therapies[J].Nature reviews Microbiology,2008,6(1):17-27.
[12] 李天铭.AraC家族转录调节蛋白Rsp对金黄色葡萄球菌毒力的调节及机制[D].上海:复旦大学,2014.
[13] 于冰,杨光,邵宁生.金黄色葡萄球菌中二元调控系统agr及与其他二元系统相互作用的研究进展[J].军事医学,2007,31(2):187-190.
[14] 郝海红,戴梦红,王玉莲,等.甲氧西林耐药金葡菌的关键基因成分和调控系统研究进展[C]//中国畜牧兽医学会兽医药理毒理学分会第十二次学术讨论会论文集.郑州:中国畜牧兽医学会兽医药理毒理学分会,2013.
[15] Ohlsen K,Ziebuhr W,Koller K P,et al.Effects of Subinhibitory Concentrations of Antibiotics on Alpha-Toxin(hla)Gene Expression of Methicillin-Sensitive and Methicillin-Resistant Staphylococcus aureusIsolates[J].Antimicrobial Agents&Chemotherapy,1998,42(11):2 817.

