多元弱酸酸式酸根离子的水解和电离
王 明
(重庆市育才中学校 400050)
一、以书为据
仔细分析和研读教材,选修4教材第42页到43页,通过“实验3-2”,可以得出结论:①弱酸的强度可以从其K电离的大小来比较,K电离越大,酸性越强;②多元弱酸比较酸性强弱时,通常只考虑第一步电离.选修4教材第53页,“科学视野”中引入了水解平衡的相关概念和计算方法,可以得出结论:①K水解=Kw/K电离;②K水解越大,对应的离子越容易水解.所以,上面涉及到的问题,只要给出弱酸的逐级电离平衡常数,利用高中知识即可以定量计算得出多元弱酸的酸式酸根离子到底是以电离为主,还是以水解为主.
二、定量验证


化学式H2SO3H2CO3H3PO4K电离Ka1=1.3×10-2Ka2=6.3×10-8Ka1=4.2×10-7Ka2=5.6×10-11Ka1=7.6×10-3Ka2=6.3×10-8Ka3=4.4×10-13
验证过程如下:

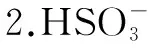


三、验证过程的推广和应用
例1 酒石酸(C4H6O6,简写为RH2)是一种重要的有机酸,广泛用于医药、食品、制革等工业.已知:25℃时,各物质的电离平衡常数(K)如下表所示:

化学式RH2H2CO3K电离K1=9.1×10-4K2=4.3×10-5K1=4.2×10-7K2=5.6×10-11
25℃时,将等物质的量浓度的RH2溶液和NaOH溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ,此时溶液中水的电离程度 纯水的电离程度(填“>”、“<”或“=”).

例2 在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-三者所占的物质的量分数(a)随溶液pH变化关系如下图所示,下列叙述错误的是( ).

A.H2R是二元弱酸,其Ka1=1×10-2
B.当溶液恰好呈中性时,c(Na+)=2c(R2-)+c(HR-)
C.NaHR在溶液中水解倾向大于电离倾向
D.含Na2R与NaHR各0.1mol的混合溶液的pH约为7.2

B中,溶液恰好呈中性时,电荷守恒得出c(H+)+c(Na+)=c(OH-)+2c(R2-)+c(HR-),中性溶液中c(H+)=c(OH-),故B 正确.

D中,Na2R与NaHR各0.1mol的混合溶液,水解和电离程度均很低,溶液中含R元素的离子主要为HR-和R2-,且c(HR-)≈c(R2-),此时pH≈7.2.故D正确.
参考文献:
[1]曹锡章,宋天佑,王杏乔.无机化学[M].北京:高等教育出版社.1994.
[2]周天泽.普通高中课程标准实验教课书化学选修(4)[M].北京:人民教育出版社.2007.

