三乙胺催化的α-硝基乙酸酯与α,β-不饱和酰基吡唑的Michael加成反应
刘莹莹,何 谦,陈 峰,李雪锋
(西南民族大学化学与环境保护工程学院,四川 成都 610041)
Michael加成反应是构建碳碳键的重要方法之一,因为高度的原子经济性而备受有机化学家的关注[1]。 近年来随着金属催化[2]和有机催化[3]的蓬勃发展,Michael加成反应也取得了一系列重要进展。总结目前的研究工作我们发现,当前报导的Michael加成反应主要以α,β-不饱和醛/酮[4]、α,β-不饱和硝基烯烃[5]以及β,γ-不饱和α-酮酸酯[6]作为受体,其它受体参与的反应相对较少。α,β-不饱和羧酸衍生物[7]因为较低的反应活性而不能有效地参与Michael加成反应,其中α,β-不饱和酰基吡唑在发生氮杂Michael加成反应时,需要在当量的催化剂下经过长时间反应,才能以满意的产率转化为加成产物[8];此外,只有双键末端含强吸电子三氟甲基的α,β-不饱和酰基吡唑才能够有效与苯硫酚发生加成反应[9]。因此,发展α,β-不饱和羧酸衍生物参与的Michael加成反应,无疑具有一定的挑战性。
α-硝基乙酸酯是一种高活性的亲核试剂,其加成产物经过简单的还原-水解处理即转化为取代的α-氨基酸,因此在合成领域受到广泛关注[10-12]。 尽管α-硝基乙酸酯已经被广泛运用于Manich反应,但是其作为给体的Michael加成反应还有待进一步开发[13-19]。我们一直致力于发展α,β-不饱和酰基吡唑参与的Michael加成反应,[20]在本论文中,我们进一步拓展给体类型,成功发展了α,β-不饱和酰基吡唑与α-硝基乙酸酯的Michael加成反应;同时我们还发现,得到的加成产物经过简单处理,即转化为相应的功能分子。
1 实验部分
1.1 药品及仪器
苯和甲醇均购至成都科龙试剂公司。3,5-二甲基吡唑、乙腈、三乙胺(TEA)和1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)购自上海泰坦科技股份有限公司。二环己基二亚胺(DCC)、4-二甲氨基吡啶(DMAP)、α-硝基乙酸乙酯、α-硝基乙酸甲酯、偶氮二异丁腈(AIBN)和三丁基氢化锡购自阿拉丁试剂有限公司。α,β-不饱和羧酸购自天津希恩思生化科技有限公司。所有溶剂和α-硝基乙酸酯未经纯化直接使用。所有试剂均为分析纯。
Varian 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标),Bruker Daltonics LCQDECA型离子阱高分辨质谱仪。
1.2 合成
1.2.1 α,β-不饱和酰基吡唑的合成[21]
α,β-不饱和酰基吡唑的合成反应式:

在100 mL圆底瓶中加入肉桂酸(1.1g, 10 mmol)和3,5-二甲基-4-氯吡唑(1.3g, 10 mmol),将混合物溶解于二氯甲烷(30 mL)后置于冰浴中冷却。然后向溶液中加入二环己基二亚胺(DCC,2.25g, 12 mmol),接着滴加4-二甲氨基吡啶(DMAP,0.123g,1 mmol)的二氯甲烷溶液(10 mL)。滴加完毕后,反应混合物继续在冰浴中搅拌30min,然后移走冰浴逐渐升至室温,并继续搅拌24h。待α,β-不饱和羧酸完全反应后,蒸除大部分溶剂,然后加入50 mL乙醚。过滤取滤液,浓缩后经柱层析得到白色粉末1.55g, 产率78%。1H NMR(400 MHz,CDCl3) δ(ppm)7.95~7.87(m,2H),7.69~7.67(m,2H),7.43~7.41(m, 3H),2.63(s,3H),2.31(s,3H);13C NMR(100 MHz,CDCl3)δ(ppm)164.9,149.2,146.8,139.5,134.6,130.8,128.9,128.7,116.8,114.8,12.6,11.8。
化合物1b-1i按照类似方法合成。
1b,黄色晶体,产率60%;1H NMR(400 MHz,CDCl3)δ (ppm) 7.88~7.77 (m,2H),7.67~7.62(m,2H),7.12~7.07(m,2H),2.60(s,3H),2.27(s,3H)。
1c,黄色晶体,产率80%;1H NMR(400 MHz, CDCl3)δ(ppm)8.35(d,J=15.6 Hz,1H ),7.90(d,J=16.0 Hz,1H ),7.85~7.83(m,1H),7.45~7.43(m,1H),7.34~7.30(m,2H),2.63 (s,3H),2.30(s,3H)。
1d,黄色晶体,产率77%;1H NMR(400 MHz, CDCl3)δ(ppm)7.84~7.83(m,2H),7.59~7.57(m,2H),7.38~7.35(m,2H),2.60(s,3H),2.28(s, 3H)。
1e,黄色晶体,产率75%;1H NMR(400 MHz,CDCl3)δ(ppm)7.89(d,J=15.6 Hz,1H ),7.82(d,J=16.0 Hz,1H ),7.56~7.26(m,4H),2.62(s,3H),2.30(s, 3H)。
1f,黄色晶体,产率83%;1H NMR(400 MHz, CDCl3)δ(ppm)7.84~7.82(m,2H ),7.54~7.52(m,2H),7.19~7.17(m,2H),2.58(s,3H),2.36(s,3H)2.27(s,3H)。
1g,黄色晶体,产率65%;1H NMR(400 MHz,CDCl3)δ(ppm)7.86(d,J=16.0 Hz,1H ),7.74(d,J=15.6 Hz,1H ),7.63~7.60(m,2H),6.93~6.89(m,2H),3.84(s,3H),2.61(s,3H), 2.29(s,3H)。
1h,黄色晶体,产率62%;1H NMR(400 MHz,CDCl3)δ(ppm)7.74(d,J=16.0 Hz,1H ),7.64(d,J=15.6 Hz,1H ),7.541~7.539(m,1H),6.74(d,J=3.2 Hz,1H)6.51~6.50(m,1H), 2.62(s,3H)2.30(s,3H)。
1i,黄色晶体,产率60%;1H NMR(400 MHz,CDCl3)δ(ppm)8.75(d,J=15.6 Hz,1H ),8.24(d,J=8.8 Hz,1H),7.96(d,J=22.8 Hz,1H),7.95(s,1H),7.88(d,J=8.4 Hz,1H),7.84(d,J=8.4 Hz,1H)7.56(t,J=7.6 Hz,1H),7.52~7.45(m,2H),2.62(s,3H),2.28(s,3H)。
1.2.2 α,β-不饱和酰基吡唑与α-硝基乙酸酯的Michael加成反应

化合物3ab-3ai, 3ba按照类似方法合成。
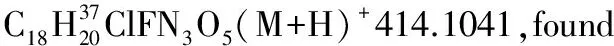


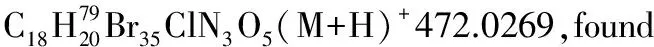





1.2.3 加成产物的醇解[22]

将3aa (39.3 mg, 0.1 mol)溶于甲醇(0.2 mL)中,然后加入DBU(10 μL,0.67 mol),并在30 ℃下搅拌过夜。薄层色谱显示3aa完全转化后,减压蒸除溶剂,残余物经乙酸乙酯/石油醚体系柱层析后得到白色固体27.0 mg, 产率96%, dr值为1∶1。1H NMR(400 MHz,CDCl3)δ(ppm)7.31~7.26(m,10H),5.55(d,J=10.0 Hz,1H), 5.47(d,J=8.8 Hz,1H),4.23~4.20(m,2H),3.84(s,3H),3.61(s,3H),3.59(s,3H),3.58(s,3H),3.00~2.81(m,4H);13C NMR(100 MHz,CDCl3)δ(ppm)170.8,170.7,163.8,163.4,137.0,136.1,129.0,128.33,128.29,128.1,127.9,91.0,90.9,53.7,53.5,51.95,51.92,42.6,42.4,36.7, 36.4;ESI-HRMS:calcd.for C13H16NO6(M+H)+282.0972,found 282.0975。
2 结果与讨论
α-硝基乙酸酯与α,β-不饱和酰基吡唑的Michael加成反应:

α-硝基乙酸酯与α,β-不饱和酰基吡唑的Michael加成反应条件及收率见表1。

表1 α-硝基乙酸酯与α,β-不饱和酰基吡唑的Michael加成反应Tab.1 Michael addition of α,β-unsaturated pyrazolamides and α-nitroacetate.
虽然早期的研究表明,α,β-不饱和酰基吡唑在Michael加成反应中活性较低;然而我们发现,如果选用活性较高的α-硝基乙酸酯作为给体,相应的Michael加成能够顺利进行,在三乙胺的催化下在较短的时间内以中等及以上产率(50%~88%)得到加成产物。反应表现出较好的底物适应性,各种电子性质的α,β-不饱和酰基吡唑都能顺利参与加成反应,只是富电子的酰基吡唑1f-1g活性比贫电子的酰基吡唑1b-1e活性略低,相应的共轭加成反应需要更长的反应时间(entries 6 and 7 vs entries 2-5)。含有杂芳基的化合物1h也能作为受体参与加成反应,只是呋喃环较大的电子云密度导致了较低的反应活性(entry 8)。含有萘环的酰基吡唑1i也是合适的受体,反应较低的转化率可能是萘环的位阻所致(entry 9)。除α-硝基乙酸乙酯2a,α-硝基乙酸甲酯2b也能够顺利参与反应(entry 10)。
加成反应得到的产物是有用的合成子,能够转化为其它的功能分子。在DBU的作用下,化合物3aa顺利发生醇解反应,以较高的产率转化为γ-位官能化的酯4(eq 3)。
3 结论
综上所述,我们成功地发展了α,β-不饱和酰基吡唑与α-硝基乙酸酯的Michael加成反应。反应表现出较好的底物适应性,一系列不同类型的α,β-不饱和酰基吡唑都能够顺利与α-硝基乙酸酯发生共轭加成。产物的结构都经过1H-NMR、13C-NMR和HRMS验证。得到的产物在温和的条件下即转化为有用的功能分子。目前我们课题组正在尝试发展相应的不对称合成方法,期待能够高对映选择性地构建一系列γ-取代的羧酸衍生物。
[1] Sibi MP,Manyem S. Enantioselective conjugate additions[J].Tetrahedron,2000,56(41):8033-8061.
[2] Christoffers J,Koripelly G,Rosiak A,Rössle M.Recent advances in metal-catalyzed asymmetric conjugate additions[J].Synthesis,2007(9):1279-1300.
[3] Almasi D, Alonso DA,Najera C.Organocatalytic asymmetric conjugate additions[J].Tetrahedron:Asymmetry,2007,18(3):299-365.
[4] Xu L W,Luo J,Lu Y.Asymmetric catalysis with chiral primary amine-based organocatalysts[J].Chemical Communications,2009(14):1807-1821.
[5] Berner O M,Tedeschi L,Enders D.Asymmetric michael additions to nitroalkenes[J].European Journal of Organic Chemistry,2002,2002(12): 1877-1894.
[6] Desimoni G,Faita G,Quadrelli P.Substituted (E)-2-Oxo-3-butenoates:Reagents for every enantioselectively-catalyzed reaction[J].Chemical Reviews,2013,113(8): 5924-5988.
[7] Desimoni G,Faita G,Quadrelli P.Enantioselective catalytic reactions with N-acyliden penta-atomic aza-heterocycles. heterocycles as masked bricks to build chiral scaffolds[J].Chemical Reviews,2015,115(18):9922-9980.
[8] Sibi M P,Itoh K.Organocatalysis in conjugate amine additions.Synthesis of β-amino acid derivatives[J].Journal of the American Chemical Society,2007,129(26): 8064-8065.
[9] Dong X Q,Fang X,Tao H Y,et al.Highly efficient catalytic asymmetric sulfa‐michael addition of thiols to trans‐4, 4, 4‐trifluorocrotonoylpyrazole[J].Advanced Synthesis & Catalysis,2012,354(6):1141-1147.
[10] Singh A,Yoder R A,Shen B,et al.Chiral proton catalysis:enantioselective br?nsted acid catalyzed additions of nitroacetic acid derivatives as glycine equivalents[J]. Journal of the American Chemical Society,2007,129(12):3466-3467.
[11] Singh A,Johnston J N.A diastereo- and enantioselective synthesis of α-substituted syn-α,β-diamino acids[J].Journal of the American Chemical Society,2008,130(18):5866-5867.
[12] Shen B,Johnston J N.A formal enantioselective acetate mannich reaction: the nitro functional group as a traceless agent for activation and enantiocontrol in the synthesis of β-amino acids[J].Organic Letters,2008,10(20):4397-4400.
[13] Lu R-j,Wei W-t,Wang J-j,et al.Organocatalytic conjugate addition of α-nitroacetates to β,γ-unsaturated α-keto esters and subsequent decarboxylation:synthesis of optically active δ-nitro-α-keto esters[J].Tetrahedron,2012,68(46):9397-9404.
[14] Wang Q,Gong J,Liu Y,et al.Chiral bifunctional squaramide catalyzed asymmetric Michael addition of ethyl α-nitroacetate to β,γ-unsaturated α-ketoesters[J].Tetrahedron,2014,70(43):8168-8173.
[15] Liu R l,Yan Y y,Zhang T,et al.A practical synthesis of optically active δ-nitro-α-ketoesters and 4-cyclohexyl-proline catalyzed by chiral squamides[J].Tetrahedron: Asymmetry,2015,26(24):1416-1422.
[16] Shirakawa S,Terao S J,He R,et al.Diastereo- and enantioselective conjugate addition of [small alpha]-substituted nitroacetates to maleimides under base-free neutral phase-transfer conditions[J].Chemical Communications,2011,47(38):10557-10559.
[17] Liu R l,Tang X Z,Zhang X J,et al.Organocatalytic asymmetric conjugate addition of t-butyl nitroacetate to o-quinone methides:synthesis of optically active [small alpha]-nitro-[small beta],[small beta]-diaryl-propionates[J].RSC Advances,2017,7(11):6660-6663.
[18] Han M Y, Zhang Y,Wang H Z,et al.Organocatalytic michael addition of nitro esters to α,β-unsaturated aldehydes: towards the enantioselective synthesis of trans-3-substituted proline derivatives[J].Advanced Synthesis & Catalysis,2012,354(14-15):2635-2640.
[19] Liu C,Lu Y.Primary amine/(+)-CSA salt-promoted organocatalytic conjugate addition of nitro esters to enones[J].Organic Letters,2010,12(10):2278-2281.
[20] Zheng Y,Yao Y,Ye L,et al.Highly enantioselective michael addition of malononitrile to α,β-unsaturated pyrazolamides catalyzed by a bifunctional thiourea[J].Tetrahedron,2016,72(7):973-978.
[21] Zhang J,Liu X,Wang R.Magnesium complexes as highly effective catalysts for conjugate cyanation of α, β‐unsaturated amides and ketones[J].Chemistry- A European Journal,2014,20(17):4911-4915.
[22] Yao Q,Wang Z,Zhang Y,et al.N, N'-Dioxide/gadolinium (III)-catalyzed asymmetric conjugate addition of nitroalkanes to alpha, beta-unsaturated pyrazoleamides[J]. Journal of Organic Chemistry,2015,80:5704-5712.

