LonP1表达与线粒体稳态以及精子活力的关联性研究
张家燕,王晓娜,李金晶,黄小圆,朱春芳,费前进,葛红山,4*
(温州医科大学 1.第二临床医学院,2.附属第二医院,3.附属第一医院,温州 325000;4.江苏泰州人民医院,泰州 225300)
在全球范围内,约有15%的夫妇面临着不孕不育的困扰,其中男性因素占了50 %[1-2]。男性不育最常见的病因是以精子活力低下为主要表现的精子功能缺陷[3]。精子活力主要取决于精子鞭毛的运动,而鞭毛运动的能量供应主要由线粒体氧化磷酸化或糖酵解提供[4]。线粒体在胞内ATP的生产和钙离子平衡的维持中起到重要的作用,该过程也是精子线粒体内活性氧(mROS)的主要来源[5]。线粒体结构和功能损伤会导致线粒体膜电位的改变,且过量的mROS会导致精子的氧化损伤,引起精子活力下降,最终导致男性不育[6]。因此线粒体稳态的维持对精子活力至关重要。
线粒体lon蛋白水解酶(又称LonP1),是维持线粒体稳态的重要蛋白之一,位于线粒体基质内,由核基因编码,具有蛋白水解酶活性、伴侣分子功能和维持线粒体DNA(mtDNA)稳定作用的ATP依赖的丝氨酸肽酶[7]。过往研究证实,LonP1的表达与人类肿瘤[8]、衰老[9]、神经退行性病变[10]、心血管疾病[11]密切相关。LonP1通过降解氧化损伤的蛋白及失去功能的线粒体,避免氧化修饰的和具有蛋白毒性的大分子蛋白在细胞内聚集,使细胞保持年轻态[2]。
那么作为调控精子活力和功能的关键器官,人类精子线粒体中是否存在LonP1蛋白的表达?LonP1蛋白与精子活力是否存在相关联系? 本研究旨在确定LonP1是否存在于精子中、该蛋白的定位,以及探究LonP1对精子线粒体稳态的维持调节作用及其可能存在的调节机制。
资料与方法
一、研究对象
选择2016年6月至2017年6月于温州医科大学附属第一医院男科实验室进行精液常规检查的标本120 份。
入选标准:禁欲2~7 d;精子浓度>20×106/ml;有2 次以上精子质量检测报告;患者年龄25~45 岁。
排除标准:不符合上述入选标准者;合并严重内外科疾病,可能影响研究结果;以及不能配合研究者。
本研究遵循的程序符合温州医科大学附属第一医院医学伦理委员会所制定的伦理学标准,得到该委员会批准,分组征得受试对象本人的知情同意,并与之签署临床研究知情同意书。
二、主要试剂/仪器
硅胶颗粒混悬液(Percoll)(Solarbio,中国);输卵管液培养液(HTF)(Quinn,美国);2-氰基-3,12-二氧代齐墩果烷-1,9(11)-二烯-28-酸甲酯(CDDO-ME)(Sigma,美国);二甲基亚砜(DMSO)(Solarbi,中国);LonP1抗体(Abcam,英国);β-actin抗体(Bioworld,美国);兔二抗(Biosharp,中国);MitoSOX Red(Life,美国);线粒体膜电位检测试剂盒(Beyotime,中国);其他化学试剂均购于中国浩丰生物技术有限公司。
主要仪器:荧光显微镜(Olympus FluoView FV500,德国);电泳仪(Biorad,美国);多功能酶标仪(Bioteck,美国);流式细胞仪(BD,美国)。
三、实验方法
1. 精液采集:男方禁欲2~7 d,通过手淫法将精液采集到无菌洁净的一次性取精杯中,静置于37℃恒温箱中液化30 min,待完全液化后进行检测和处理。
2. 分组及处理方法:精液分析经连续3 次以上的指标提示精子向前运动(PR)<50 %或A级运动的精子<25%,而精子密度及其它参数指标正常或基本正常者,诊断为弱精子症。因此根据PR差异,我们将精液标本分为正常活力精子(NS)组(48例)和弱精子症精子(AS)组(42例)。继而分别检测精子运动参数、LonP1蛋白含量、mROS含量和精子的线粒体膜电位强度(MMP)。
根据CDDO-ME作用浓度,将密度梯度离心处理后的NS组(30例)精液标本分为正常空白对照组和CDDO-ME处理组,CDDO-ME处理组分别用2种浓度梯度的CDDO-ME(2.5 μmol/L和5 μmol/L)处理2 h,之后收集样本分别检测精子运动参数、LonP1蛋白含量、mROS含量和MMP。
3. 精液梯度离心: 精液处理前首先配制80%和40%的Percoll溶液。采用密度梯度离心法处理精液标本,取1 ml 80%Percoll加入到一支15 ml离心管底部,再加入1 ml 40% Percoll,后加入2 ml液化的精液到已配制的分离层上,然后1 500 r/min离心15 min,弃上清液。将试管底部约0.3 ml液体转移至装有4 ml HTF的小离心管内,混匀,再以1 500 r/min离心10 min,弃上清液,留试管底部沉淀用HTF重悬。
4. CDDO-ME处理:将CDDO-ME粉末用DMSO配制成浓度为50 mmol/L的储存液备用。将洗涤后的精液分为两组:空白对照组(CDDO-ME浓度为0 μmol/L)和CDDO-ME处理组。参考CDDO-ME处理对其他细胞LonP1功能抑制的作用浓度[12],CDDO-ME处理组的2组培养液分别加入不同体积的CDDO-ME储存液,使其CDDO-ME作用终浓度分别为2.5 μmol/L和5 μmol/L。空白对照组和处理组的精液同时放入6%CO2培养箱培养,于第2 h收集样本进行检测。
5. 精子运动参数检测:采用计算机辅助精液分析系统(CASA) 分析精液精子密度、精子活力(PR)、活率(PR+NP)、平均路径速度(VAP)、直线速度(VSL)、曲线速度(VCL)、直线性(LIN)、前向性(STR)和精子头部侧向摆动幅度(ALH)等。
6. 免疫荧光蛋白定位:精子经PBS洗涤后做精子涂片,后经4 %多聚甲醛固定20 min,后在PBS中润洗10 min,重复3次。0.1 % Triton打孔10 min,含10 %牛血清白蛋白(BSA)封闭1 h,后室温下抗LonP1抗体孵育4 h,PBS润洗后HRP兔二抗避光孵育30 min;阴性对照用PBS代替一抗,步骤同前。摄片用共聚焦显微镜获得。
7. 蛋白免疫印迹:精子样本经离心和PBS洗涤2次后,加入100 μl SDS裂解液裂解30 min,4℃温度下17 000 r/min 离心10 min,取上清。蛋白上样量为40 μg,经10 %SDS-PAGE分离并转膜至PVDF膜(Millipore,美国)。室温下于5 %脱脂牛奶中封闭2 h,随后分别加LonP1一抗和β-actin一抗4℃摇床过夜。TBST漂洗三次,每次10 min,后室温下HRP兔二抗室温下摇床孵育2 h,经TBST洗涤后曝光。化学发光信号通过Super Signal West Pico(Pierce,美国)获得,结果通过Quantity One software(AlphaEaseFC,美国)分析。
8. 精子的线粒体膜电位(MMP)检测:精子线粒体膜电位检测采用5,5’,6,6’-四氯-1,1’,3,3’-四乙基苯并咪唑羰花青碘化物(JC-1)荧光染料法进行。膜电位高时JC-1形成聚合物于线粒体基质发红色荧光,膜电位低时形成单体发绿色荧光,因此绿色荧光/红色荧光比值越大代表膜电位越低,反之亦然。密度梯度离心法处理后的精子用培养液稀释为(1~2)×106个/ml,阳性对照CCCP(10 μmol/L)预处理20 min,后经JC-1工作液(1 mmol/L)37℃孵育30 min,然后4℃下用PBS离心洗涤3 次,加入1 ml JC-1缓冲液重悬,经流式细胞仪获取数据,每组计数10 000个精子,MMP通过绿色荧光强度和红色荧光强度的比值来表示。
9. 精子线粒体内活性氧(mROS)检测:精子线粒体活性氧检测采用线粒体超氧化物红色荧光探针荧光染料法进行。密度梯度离心法处理后的精子用培养液稀释为(1~2)×106个/ml,随后经10 μmol/L Mitosox Red 37℃下避光孵育10 min,其中阴性对照不作处理,然后PBS洗涤3 次,重悬后通过流式细胞仪计数10 000个精子,PE通道下计算平均荧光密度(MFI),计算得到mROS水平。
四、统计学分析
结 果
一、LonP1在精子中表达定位
通过免疫荧光染色发现,LonP1稳定表达于精子中段的线粒体鞘部,且NS组相较AS组,LonP1的荧光强度更强(图1)。
二、NS组和AS组精子中LonP1蛋白水平的表达差异
根据精子前向运动水平的高低,我们将精子分为了NS组和AS组,并对其进行了蛋白免疫印迹分析。结果显示,LonP1在约106 KDa位置处,有单一条带(图2A),蛋白定量分析显示NS组LonP1表达显著高于AS组(P<0.05)(图2B)。

NS组精子中LonP1荧光图(A1)和原图(A2);AS组精子中LonP1荧光图(B1)和原图(B2)图1 两组精子中LonP1的荧光表达(×40)
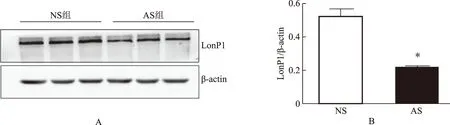
A:LonP1蛋白免疫印迹图谱;B:精子LonP1蛋白的相对定量;与NS组比较,*P<0.05图2 两组精子中LonP1的蛋白免疫印迹图和定量分析
三、精子LonP1表达与精子活力、精子MMP水平及mROS含量的关联性
通过比较NS组与AS组精子活力(图3A)、线粒体功能相关指标(图3B、C),发现MMP水平相较AS组,NS组显著增高,mROS水平则明显降低,且均具有显著性差异(P<0.05),表明LonP1表达水平越高,MMP越高,mROS含量越低,两两存在一定关联性(表1)。
初到西点军校的时候,我只有22岁,是系里最年轻的讲师。当时二战已经结束,我觉得人生就像一场刚开始的盛宴。
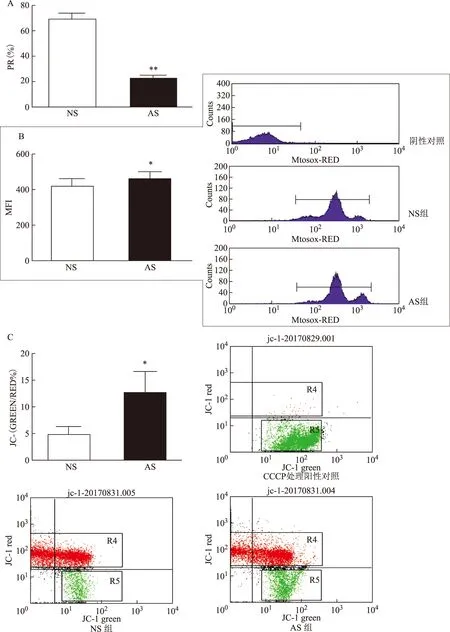
A:精子活力的差异;B:mROS的差异以及mROS检测的流式图;C:MMP的差异以及MMP检测的流式图;与NS组比较,*P<0.05,**P<0.01 图3 两组精子活力差异和线粒体稳态的差异

组别PR(%)LonP1MMP(%)mROS(MFI)NS组69.89±8.100.52±0.094.72±4.05418.85±139.61AS组26.10±13.48#0.22±0.01*12.73±10.23*460.52±123.35*
注:与NS组比较,*P<0.05,#P<0.01
四、CDDO-ME对精子LonP1功能的抑制作用
Gibellini等[12]利用2-氰基-3,12-二氧代齐墩果烷-1,9(11)-二烯-28-酸甲酯(CDDO-ME)这种抗癌分子抑制了人类癌细胞中线粒体蛋白LonP1的功能,故本研究中分别设置了0 μmol/L、2.5 μmol/L、5 μmol/L浓度梯度,发现经2 h CDDO-ME体外培养后,CDDO-ME处理组LonP1表达水平较正常空白对照组显著下降(P<0.05)(图4A、4B)。
五、LonP1功能抑制对精子线粒体稳态的影响
经CDDO-ME作用后,随着LonP1蛋白表达水平降低,JC-1绿色荧光/红色荧光比值增加,即MMP逐步降低(图5A),mROS水平增加。与空白对照组比较,5 μmol/L浓度处理组有显著改变(P<0.05)(图5B、表2)。
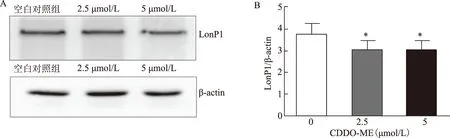
A:CDDO-ME处理后LonP1蛋白免疫印迹图谱;B:CDDO-ME处理后LonP1蛋白表达的相对定量;与空白对照组比较,*P<0.05 图4 LonP1功能抑制剂CDDO-ME处理后LonP1蛋白表达的变化

组别LonP1表达MMP(%)mROS(MFI值)空白对照组(0μmol/L)3.73±0.827.34±3.79462.26±126.842.5μmol/L组3.05±0.69*25.47±23.81537.61±183.865μmol/L组2.98±0.69*78.81±28.11*640.68±226.58*
注:与空白对照组比较,*P<0.05
六、LonP1功能抑制对精子活力的影响
经LonP1功能抑制剂CDDO-ME 0 μmol//L、2.5 μmol/L和5 μmol/L进行2 h的体外培养,与空白对照组(0 μmol//L)相比,其余两组的PR+NP无显著性变化(P>0.05),而VAP、VSL随浓度升高有显著下降(P<0.05);5 μmol/L组的PR、VCL、ALH、LIN及STR均显著性下降(P<0.05)(表3)。
讨 论
LonP1在维持线粒体稳态和细胞代谢方面的重要作用已被大量研究证实。在过去20年里,在不同的实验模型中得到的结果证明,LonP1在调节线粒体活动中具有重要作用,作为多功能酶去移除错误折叠和氧化修饰的蛋白;在蛋白质毒性,缺氧和内质网应激时支持细胞存活;以及维护和调节mtDNA的代谢[13-14]。LonP1蛋白具有很多功能,包括水解酶作用[15],伴侣分子作用[16],线粒体DNA结合蛋白作用[17]。下调LonP1能够对线粒体呼吸,mtDNA质量和数量产生重大影响,且最终影响细胞代谢[18-19]。
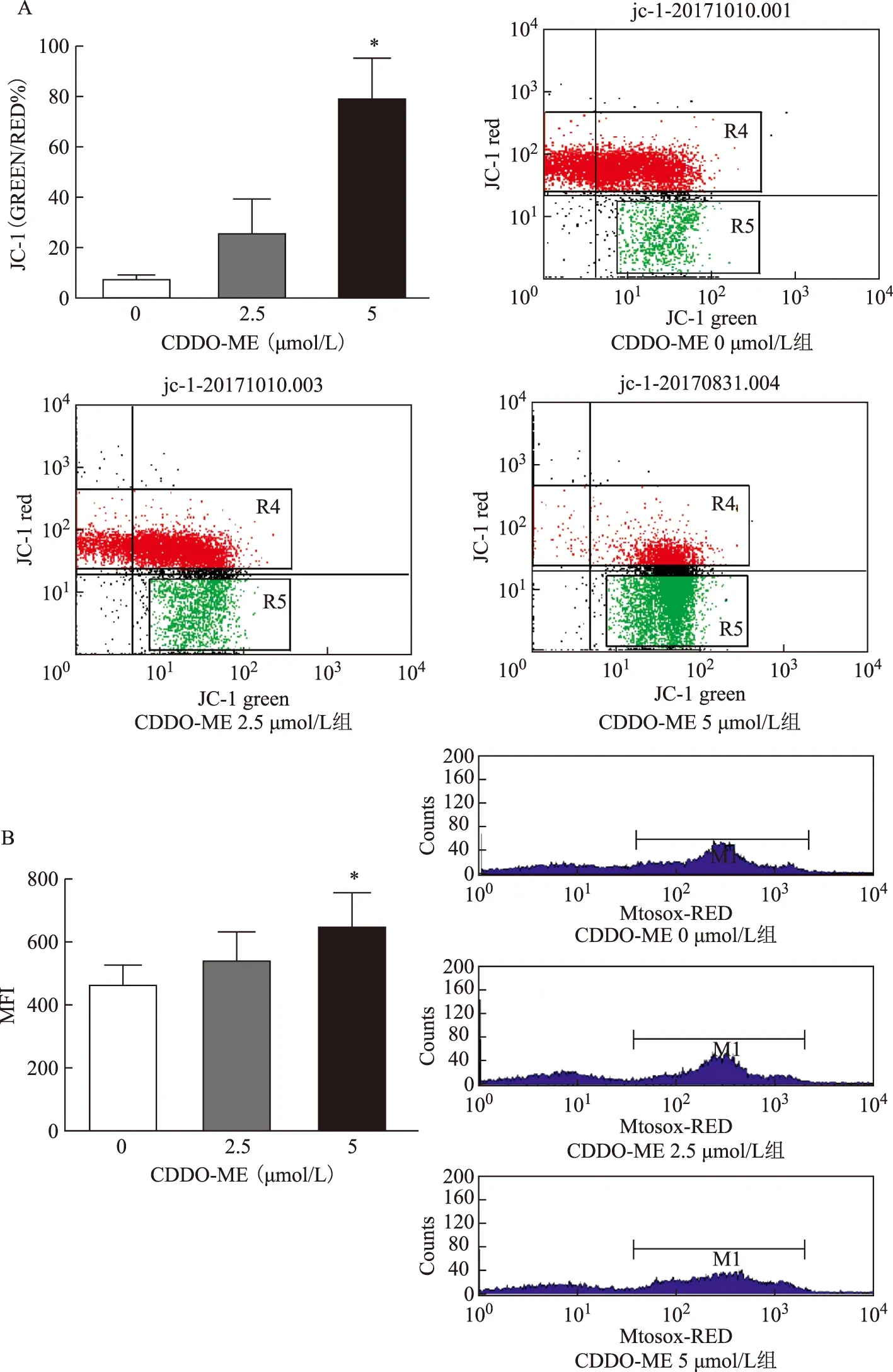
A:验证CDDO-ME处理后线粒体膜电位的变化;B:CDDO-ME处理后mROS的变化;与空白对照组比较,*P<0.05 图5 LonP1功能抑制剂CDDO-ME处理后线粒体稳态的变化
目前为止尚未有研究提出LonP1在精子线粒体中的表达,而我们实验发现,在精子线粒体鞘部存在LonP1蛋白的荧光表达,且LonP1在NS组精子中表达明显高于AS组。NS组精子线粒体功能明显优于AS组精子线粒体功能的发现,恰恰反映了LonP1蛋白与精子线粒体功能和稳态的维持存在重要联系。有大量研究证实,弱精子症患者的精子线粒体膜电位显著低于正常人的精子线粒体膜电位,线粒体ROS水平也要明显高于正常人[20]。线粒体膜电位是反映线粒体内产生能量的三羧酸循环状况的重要指标,膜电位降低将导致线粒体能量的供给障碍,使得精子的鞭毛运动没有足够的ATP支持,从而精子活力受到影响[21]。而Kumar等[22]提出氧化应激损伤与精子活力密切相关。精子内适当水平的ROS能够调节其高活跃性运动,获能及顶体反应,过量的ROS会使线粒体内膜出现非特异的通透性转运孔道,使线粒体膜电位降低,导致精子活力下降[20]。因此精子线粒体膜电位和线粒体ROS水平均与精子活力密切相关。我们在前期的预实验中发现,弱精子症病人的精液标本经后续药物处理后,由于其本身线粒体膜电位较低及线粒体ROS水平过高的原因,精子的供能和氧化损伤均受到打击,在经过LonP1功能抑制剂处理后,精子线粒体稳态进一步削弱,弱精子症病人的精子存活时间更无法比拟正常活力精子。因此为了长时间的观察后续的LonP1功能抑制效应,我们采用了正常组精液标本并通过密度梯度离心法得到活力更优的精子作为实验对象。
表3 不同浓度CDDO-ME处理2 h后精子运动参数比较(-±s)
注:与空白对照组比较,*P<0.05,#P<0.01
Berstein等[23]研究发现,在敲除LonP1在淋巴瘤细胞中的表达以及Granta细胞经CDDO抑制LonP1功能后,均可在电镜下观察发现胞内线粒体形态的缺失以及高密度电子包涵体在线粒体基质中聚集。Rawe等[24]研究表明活力低下的精子常并发精子尾部线粒体鞘数量减少及结构异常。所以我们推测,LonP1蛋白作为定位于线粒体,具备调节线粒体功能的重要多功能蛋白,其表达水平可能与精子线粒体形态完整性和线粒体数目有关。弱精子症病人的精子电镜发现其精子线粒体形态的缺失和线粒体数目较为明显的下降[25],更加合理解释了NS精子中LonP1蛋白表达高于AS组的现象。由此我们推测,LonP1表达水平越高,精子线粒体功能越稳定。
线粒体作为精子运动的主要供能器官,通过氧化磷酸化合成ATP,与精子活力息息相关[24]。那么是否LonP1表达水平越高,精子活力就越优呢?我们对NS组和AS组精子中LonP1表达水平及线粒体功能指标进行了关联性分析,并发现LonP1的表达水平与精子活力,精子线粒体膜电位及线粒体ROS水平均存在密切的关联,其中LonP1表达水平与精子活力和线粒体膜电位正相关,与线粒体ROS水平呈负相关。而CDDO-ME处理抑制LonP1功能抑制后发现精子运动参数和线粒体膜电位均存在不同程度的下降,线粒体ROS也有一定程度的增加。以上与我们前期的关联性分析结果相符,进一步证明LonP1参与调节了线粒体稳态,LonP1表达水平越高,精子线粒体稳态越稳定。
2-氰基-3,12-二氧代齐墩果烷-1,9(11)-二烯-28-酸甲酯(CDDO-ME)是一种LonP1特异性抑制剂[23]。多项研究发现,对RKO人直肠癌细胞系进行CDDO-ME处理24 h后,LonP1表达下降,并伴随着线粒体功能的变化[12,23]。而我们实验发现,CDDO-ME处理浓度为2.5 μmol/L并体外培养2 h后,相较空白对照组,药物处理组精子活力变化无明显差异,而此时LonP1表达已受到显著抑制,而在后期第24 h的精子活力检测发现,经2.5 μmol/L浓度组的精子活力下降要明显高于空白对照组,下降约47.20 %,而精子活率仅下降8.90 %。以上均表明,精子活力是在LonP1功能受到抑制后才出现下降,而并非CDDO-ME本身的药物毒性影响。Gur等[26]的研究指出,线粒体核糖体参与了精子获能过程中的蛋白转运,而精子中核编码mRNA能够被转运至精子线粒体核糖体,该过程还受到精子活力、获能及顶体反应的影响,这也就解释了为什么LonP1的蛋白表达水平能够被CDDO-ME调节。我们实验利用CDDO-ME特异性抑制精子线粒体内LonP1的功能,并通过蛋白免疫印迹验证LonP1抑制效果,并发现LonP1功能抑制后,对比空白对照组,除精子PR+NP无明显变化,大部分精子运动参数均有不同程度的下降,精子的线粒体稳态也发生了负面的改变,其中包括了线粒体ROS增加和膜电位的下降。
【参考文献】
[1] Agarwal A,Mulgund A,Alshahrani S,et al. Reactive oxygen species and sperm DNA damage in infertile men presenting with low level leukocytospermia[J]. Reprod Biol Endocrinol,2014,12: 126-133.
[2] Ugarte N,Petropoulos I,Friguet B. Oxidized mitochondrial protein degradation and repair in aging and oxidative stress[J]. Antioxid Redox Signal,2010,13: 539-549.
[3] Hajder M,Hajder E,Husic A. The Effects of Total Motile Sperm Count on Spontaneous Pregnancy Rate and Pregnancy After IUI Treatment in Couples with Male Factor and Unexplained Infertility[J]. Med Arch,2016,70: 39-43.
[4] Guthrie HD,Welch GR. Effects of reactive oxygen species on sperm function[J]. Theriogenology,2012,78: 1700-1708.
[5] Agnihotri SK,Agrawal AK,Hakim BA,et al. Mitochondrial membrane potential(MMP) regulates sperm motility[J]. In Vitro Cell Dev Biol Anim,2016,52: 953-960.
[6] Cassina A,Silveira P,Cantu L,et al. Defective Human Sperm Cells Are Associated with Mitochondrial Dysfunction and Oxidant Production[J]. Biol Reprod,2015,93: 119-128.
[7] Pinti M,Gibellini L,Liu Y,et al. Mitochondrial Lon protease at the crossroads of oxidative stress,ageing and cancer[J]. Cell Mol Life Sci,2015,72: 4807-4824.
[8] Sheth A,Escobar-Alvarez S,Gardner J,et al. Inhibition of human mitochondrial peptide deformylase causes apoptosis in c-myc-overexpressing hematopoietic cancers[J]. Cell Death Dis,2014,5: e1152-1160.
[9] Koltai E,Hart N,Taylor AW,et al. Age-associated declines in mitochondrial biogenesis and protein quality control factors are minimized by exercise training[J]. Am J Physiol Regul Integr Comp Physiol,2012,303: R127-134.
[10] Thomas RE,Andrews LA,Burman JL,et al. PINK1-Parkin pathway activity is regulated by degradation of PINK1 in the mitochondrial matrix[J]. PLoS Genet,2014,10: e1004279-1004291.
[11] Tvrda E,Tusimova E,Kovacik A,et al. Protective Effects of Quercetin on Selected Oxidative Biomarkers in Bovine Spermatozoa Subjected to Ferrous Ascorbate[J]. Reprod Domest Anim,2016,51: 524-537.
[12] Gibellini L,Pinti M,Bartolomeo R,et al. Inhibition of Lon protease by triterpenoids alters mitochondria and is associated to cell death in human cancer cells[J]. Oncotarget,2015,6: 25466-25483.
[13] Smith MA,Schnellmann RG. Mitochondrial calpain 10 is degraded by Lon protease after oxidant injury[J]. Arch Biochem Biophys,2012,517: 144-152.
[14] Pinti M,Gibellini L,Nasi M,et al. Emerging role of Lon protease as a master regulator of mitochondrial functions[J]. Biochim Biophys Acta,2016,1857: 1300-1306.
[15] Watabe S,Hara M,Yamamoto M,et al. Activation of mitochondrial ATP-dependent protease by peptides and proteins[J]. Tohoku J Exp Med,2001,195: 153-161.
[16] Ekstrand MI,Falkenberg M,Rantanen A. Mitochondrial transcription factor A regulates mtDNA copy number in mammals[J]. Hum Mol Genet,2004,13: 935-944.
[17] Matsushima Y,Goto Y,Kaguni LS. Mitochondrial Lon protease regulates mitochondrial DNA copy number and transcription by selective degradation of mitochondrial transcription factor A(TFAM)[J]. Proc Natl Acad Sci USA,2010,107: 18410-18415.
[18] Hamon MP,Bayot A,Gareil M,et al. Effects of Lon protease down-regulation on the mitochondrial function and proteome[J]. Free Radic Biol Med,2014,75 Suppl 1: S32-33.
[19] Bayot A,Gareil M,Chavatte L,et al. Effect of Lon protease knockdown on mitochondrial function in HeLa cells[J]. Biochimie,2014,100: 38-47.
[20] Wang X,Sharma RK,Gupta A,et al. Alterations in mitochondria membrane potential and oxidative stress in infertile men: a prospective observational study[J]. Fertil Steril,2003,80 Suppl 2: 844-850.
[21] 周秀芬,姜宏. 线粒体功能与精子活力[J]. 国际生殖健康/计划生育杂志,2009: 355-357.
[22] Kumar R,Venkatesh S,Kumar M,et al. Oxidative stress and sperm mitochondrial DNA mutation in idiopathic oligoasthenozoospermic men[J]. Indian J Biochem Biophys,2009,46: 172-177.
[23] Bernstein SH,Venkatesh S,Li M,et al. The mitochondrial ATP-dependent Lon protease: a novel target in lymphoma death mediated by the synthetic triterpenoid CDDO and its derivatives[J]. Blood,2012,119: 3321-3329.
[24] Rawe VY,Galaverna GD,Acosta AA,et al. Incidence of tail structure distortions associated with dysplasia of the fibrous sheath in human spermatozoa[J]. Hum Reprod,2001,16: 879-886.
[25] 印洪林,周晓军,盛春宁,等. 弱精症病人精子线粒体的电镜观察[J]. 电子显微学报,2001: 753-757.
[26] Gur Y,Breitbart H. Mammalian sperm translate nuclear-encoded proteins by mitochondrial-type ribosomes[J]. Genes Dev,2006,20: 411-416.

