β-氨基丙腈抑制机械刮宫后大鼠子宫内膜纤维化的研究
倪冬冬,徐祥波,贺斌,王蔼明
(1.第二军医大学,上海 200433;2.海军总医院,北京 100048;3. 国家卫生计生委科学技术研究所,北京 100081)
宫腔粘连(intrauterine adhesion,IUA)是指任何创伤引起的子宫内膜基底层的损伤导致子宫内膜纤维化从而形成子宫腔前后壁粘连。宫腔粘连的发生有多种,但最常见的原因是由机械性刮宫引起的子宫内膜基底层损伤,比如人工流产等宫腔内手术操作等。其临床表现为月经异常、继发性不孕等[1]。随着临床宫腔操作的增多以及宫腔镜技术的应用,IUA的发病率和诊断率显著上升[2-3]。目前研究已发现多种与宫腔粘连发生相关的因素,但宫腔粘连的发病机制尚不清楚[4],对较重的子宫内膜纤维化也无有效的治疗方法。宫腔粘连的本质是子宫内膜基底层损伤后导致的子宫内膜纤维化[5]。成九梅等[6]通过研究发现IUA患者的子宫内膜中有大量细胞外基质沉积,子宫内膜逐渐被纤维结缔组织取代,最终形成IUA。赖氨酰氧化酶(1ysyl oxidase,LOX)是由细胞分泌的、作用于细胞外基质胶原和弹性蛋白的赖氨酸残基从而产生分子交联的一种胺氧化酶,参与胶原纤维与弹性纤维共价交联的形成过程[7-8]。共价交联的形成对胶原纤维的稳定至关重要[9-10],它在肝脏、肺脏等多个器官纤维化的过程中发挥重要作用[11]。β-氨基丙腈作为赖氨酰氧化酶抑制剂能够逆转肝脏的纤维化[12]。因此探索β-氨基丙腈是否对大鼠子宫内膜纤维化有逆转作用以及最佳的使用剂量,将为宫腔粘连的发生机制及治疗方法的研究提供重要实验基础。
材料与方法
一、实验动物及试剂
1.实验动物:8周龄雌性Wistar大鼠(北京维通利华实验动物有限公司),体重180~230 g,大鼠饲养于国家卫生计生委科学技术研究所SPF级实验动物中心,环境温度20~22℃,光照/黑暗周期为12/12 h,自由进食正常饲料。所有大鼠实验操作均遵守国家卫生计生委科学技术研究所伦理委员会的相关规定。
2.主要试剂:β-氨基丙腈(beta-aminopropionitrile,BAPN)(Sigma,美国);Masson染色试剂(北京索莱宝);羟脯胺酸试剂盒(南京建成生物)。
二、实验方法
1.实验动物分组:54只雌性Wistar大鼠用随机数字表法分为正常组(6只),不给予任何处理;对照组(12只),建立大鼠子宫机械损伤致宫腔纤维化粘连模型;实验组(36只),建立大鼠子宫机械损伤致宫腔粘连模型,并立即腹腔注射β-氨基丙腈。
2.β-氨基丙腈剂量组:曾有研究采用100 mg/kg/d剂量β-氨基丙腈作为赖氨酰氧化酶抑制剂来研究赖氨酰氧化酶在大鼠的不同作用[13-14]。因此,我们以100 mg/kg/d剂量为实验用最低剂量,按照每天注射β-氨基丙腈剂量不同分为3个剂量组:100 mg/kg、200 mg/kg、300 mg/kg,每组12只。
3.大鼠子宫机械损伤致宫腔纤维化粘连模型的建立及标本收集:将大鼠用2%戊巴比妥钠(2 ml/kg)麻醉后,在超净工作台上实施刮宫手术,在双侧背部备皮消毒后切开,取出子宫,在子宫角近卵巢约5 mm处剪开一小口,用12-18号不锈钢针头自制刮勺,探入宫腔反复搔刮子宫,至刮出子宫内膜碎屑宫腔面粗糙,缝合子宫,逐层缝合关闭大鼠背部切口。对照组自然愈合,实验组搔刮后立即腹腔每日一次注射 100 mg/kg、200 mg/kg、300 mg/kg的β-氨基丙腈。对照组和实验组分别于搔刮后72 h、7 d用0.2%苯巴比妥麻醉后每组各取6只大鼠双侧子宫,观察记录子宫大体形态后,部分损伤子宫4%多聚甲醛固定,部分损伤子宫液氮冷冻后放入-80℃冰箱保存,取材后大鼠断颈处死。
4.苏木精-伊红(HE)染色:选取正常组、对照组和实验组损伤子宫中段组织,常规石蜡包埋,5 μm连续切片,切片常规脱蜡、水化,苏木素染液中浸染5 min后用清水洗去多余染液,用1%盐酸酒精将组织切片分化30 s,流水冲洗返蓝,放入伊红染液中浸染20~30 s,清水洗去多余伊红染液,将组织切片常规梯度脱水、透明,最后用中性树胶封片。
5.Masson染色:将组织切片常规脱蜡至水,用配制好的Weigert铁苏木素染色液染色5~10 min,用酸性乙醇分化液分化5~15 s,水洗后Masson蓝化液返蓝3~5 min,蒸馏水洗1 min;丽春红品红染色液染色5~10 min,用弱酸工作液洗1 min,磷钼酸溶液洗1~2 min后再用弱酸工作液洗1 min;放入苯胺蓝染色液中染色1~2 min后弱酸工作液洗1 min,95%乙醇快速脱水,无水乙醇脱水3次,每次5~10 s,最后用二甲苯透明,中性树胶封片。
6.大鼠子宫胶原含量检测:羟脯氨酸是胶原蛋白中特有的氨基酸,通过羟脯氨酸的测定,可以反映胶原蛋白的含量。取大鼠子宫冻存组织100 mg,等分两份。一份组织剪碎后放入试管中,加入5 mg/ml的胃蛋白酶和0.5 mol/L的三氯乙酸4℃过夜消化后以2 000 rpm、4℃低温离心,上清含有可溶性胶原,离心后的沉淀含有不可溶性胶原[13]。用羟脯胺酸测试盒按说明书操作检测上清液中羟脯胺酸含量。简要操作步骤:将离心后的上清液中加水解液1 ml,混匀,加盖后放入95 ℃或沸水中20 min,调pH值至6.0~6.8,取3~4 ml稀释的水解液加适量活性炭(约20~30 mg,以上清液离心后澄清无色为准),3 500 rpm离心10 min,然后取上清1 ml在550 nm处检测吸光度,用测得的OD值按公式计算出羟脯胺酸含量从而得到可溶性胶原含量。然后将另一份等量大鼠子宫组织,剪碎后直接加入水解液1 ml,之后按上述相同方法测得上清液中的羟脯胺酸含量来计算出总胶原的含量,最后用总胶原量减去可溶性胶原量即得到不可溶性胶原量。
三、统计学方法
结 果
一、大鼠一般情况
在子宫搔刮后及愈合过程中,对照组大鼠一般情况良好;实验组大鼠中给予β-氨基丙腈100 mg/kg、200 mg/kg剂量组大鼠一般情况及精神状态均良好,给予300 mg/kg剂量组大鼠一般状况差,大鼠消瘦、精神状态萎靡,运动迟缓;实验过程中β-氨基丙腈300 mg/kg剂量组有1只死于第5天,2只死于第7天。
二、大鼠子宫大体形态学结果
子宫大体形态学观察结果显示:与大鼠正常组未损伤子宫(图1A)相比,对照组子宫搔刮损伤后72 h呈现轻微挛缩且子宫表面凸凹不平结节样(图1B),至7 d时子宫僵硬挛缩明显且子宫表面苍白(图1C)。
与对照组相比,实验组各剂量组在子宫搔刮损伤后72 h时大体外观基本正常,无明显萎缩、淤血,有轻度水肿(图1D、E、F);至7 d时,实验组各剂量组大鼠子宫与正常大鼠子宫(图1A)未见明显差异,色泽红润,组织弹性好(图1G、H、I)。
三、大鼠子宫组织形态学结果
HE染色结果显示,与正常组未损伤子宫(图2A)相比,对照组大鼠子宫搔刮损伤后72 h可见损伤的子宫腔被上皮细胞完全覆盖,但子宫内膜很薄(图2B);至搔刮损伤后7 d,对照组大鼠子宫腔萎缩最严重,内膜薄,腺体少,宫腔狭小,内膜基质纤维组织增生(图2C)。
搔刮损伤后72 h,实验组BAPN 100 mg/kg剂量组大鼠子宫腔被上皮细胞完全覆盖,子宫内膜较厚,内膜基质纤维组织增生较对照组少,腺体数量较对照组多(图2D);BAPN 200 mg/kg剂量组大鼠子宫腔被上皮细胞完全覆盖,子宫内膜较其他实验组及对照组大鼠子宫内膜厚,内膜基质纤维组织增生少,腺体数量较100 mg/kg剂量组多(图2E);300 mg/kg剂量组大鼠子宫内膜薄,腺体数量较200 mg/kg剂量组少(图2F)。
至搔刮损伤后7 d时,实验组100 mg/kg剂量组大鼠子宫腔大部分被上皮细胞覆盖,子宫内膜较薄,腺体数量较200 mg/kg剂量组少(图2G);200 mg/kg剂量组大鼠子宫内膜较其他实验组及对照组大鼠子宫内膜厚,腺体数量较多(图2H);300 mg/kg剂量组大鼠子宫内膜薄,腺体数量减少,腺腔狭小(图2I)。

A:正常大鼠子宫;B:搔刮损伤后72 h对照组大鼠子宫;C:搔刮损伤后7 d对照组大鼠子宫;D、E、F:分别是100 mg/kg、200 mg/kg、300 mg/kg剂量组连续给药72 h的实验组大鼠子宫;G、H、I:分别是100 mg/kg、200 mg/kg、300 mg/kg剂量组连续给药7 d的实验组大鼠子宫图1 各组大鼠子宫的大体形态结果
四、Masson染色结果
与正常组未损伤子宫(图3A)相比,对照组搔刮损伤后72 h(图3B)及7 d时(图3C)子宫内膜组织中蓝染胶原纤维逐渐增多,提示在子宫损伤后愈合过程中伴有明显的纤维化。与对照组相比,在子宫搔刮损伤后72 h,实验组各剂量组(图3D、E、F)子宫内膜组织中蓝染胶原纤维含量减少,以200 mg/kg及300 mg/kg剂量组较为明显;至7 d时,实验组各剂量组(图3G、H、I)子宫内膜组织中蓝染胶原纤维含量比对照组(图3C)明显减少。
五、羟脯胺酸试剂盒检测胶原含量结果
羟脯氨酸检测结果显示,在子宫搔刮损伤后72 h,对照组不可溶胶原纤维含量[(5.61±0.31) μg/mg]显著高于实验组三个剂量组(P<0.01),而实验组中200 mg/kg剂量组不可溶胶原纤维含量低于100 mg/kg剂量组[(1.88±0.33) μg/mg vs.(3.59±0.27)μg/mg,P<0.05)],但与300 mg/kg剂量组[(1.91±0.21)μg/mg]无显著差异(P>0.05)(表1)。
搔刮损伤后第7天,对照组大鼠子宫不可溶胶原纤维含量[(6.18±0.23)μg/mg]显著高于正常组(P<0.01);实验组三个剂量组尽管也高于正常组(P<0.05),但显著低于对照组(P<0.01),其中实验组200 mg/kg剂量组不可溶胶原纤维含量显著低于100 mg/kg组[(1.90±0.31)μg/mg vs.(3.98±0.22)μg/mg,P<0.05)],但与300 mg/kg剂量组无显著差异(P>0.05)(表1)。
对照组和300 mg/kg剂量组的可溶性胶原含量在损伤后72 h和7 d时显著高于正常组(P<0.05),而对照组与实验组间、实验组各剂量组间的可溶性胶原含量无统计学差异(P>0.05)(表1)。
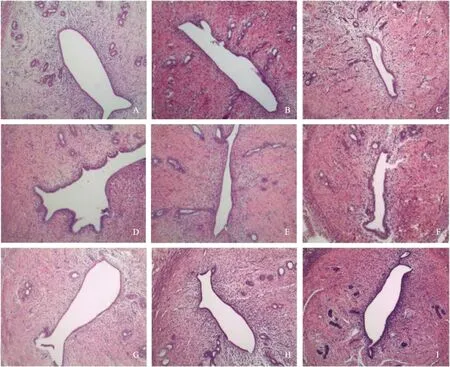
A:正常大鼠子宫;B:搔刮损伤后72 h对照组大鼠子宫;C:搔刮损伤后7 d对照组大鼠子宫;D、E、F:分别是搔刮损伤后72 h实验组100 mg/kg、200 mg/kg、300 mg/kg剂量组的大鼠子宫;G、H、I:分别是搔刮损伤后7 d实验组100 mg/kg、200 mg/kg、300 mg/kg剂量组的大鼠子宫图2 各组大鼠子宫横切面组织学结果(HE染色,×100)
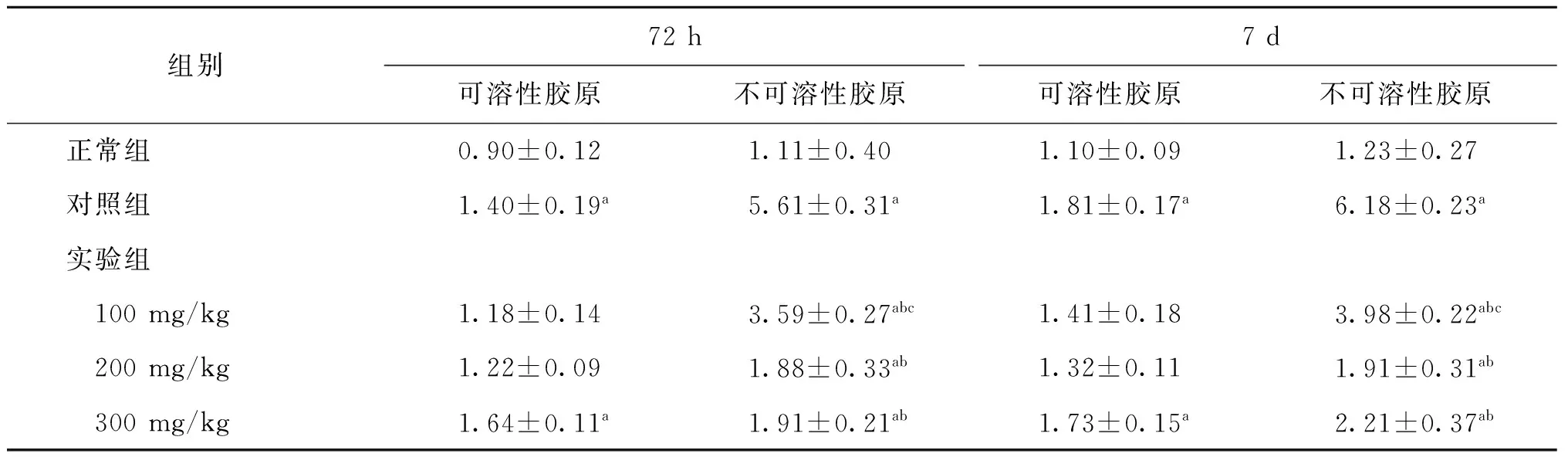
组别72h7d可溶性胶原不可溶性胶原可溶性胶原不可溶性胶原正常组0.90±0.121.11±0.401.10±0.091.23±0.27对照组1.40±0.19a5.61±0.31a1.81±0.17a6.18±0.23a实验组 100mg/kg1.18±0.143.59±0.27abc1.41±0.183.98±0.22abc 200mg/kg1.22±0.091.88±0.33ab1.32±0.111.91±0.31ab 300mg/kg1.64±0.11a1.91±0.21ab1.73±0.15a2.21±0.37ab
注:与正常组比较,aP<0.05;与对照组比较,bP<0.05;与实验组中其他剂量组比较,cP<0.05

A:正常大鼠子宫;B:搔刮损伤后72 h对照组大鼠子宫;C:搔刮损伤后7 d对照组大鼠子宫;D、E、F:分别是搔刮损伤后72 h实验组100 mg/kg、200 mg/kg、300 mg/kg剂量组的大鼠子宫;G、H、I:分别是搔刮损伤后7 d实验组100 mg/kg、200 mg/kg、300 mg/kg剂量组的大鼠子宫图3 各组大鼠子宫横切面Masson染色结果(×200)
讨 论
IUA是由于各种原因导致的子宫内膜基底层损伤。IUA主要发生于妊娠期的宫腔操作后及其他疾病行宫腔手术治疗之后[14]。宫腔粘连可导致不孕、月经量减少、闭经、腹痛等症状[15]。目前宫腔粘连的发病机制不清楚,重度宫腔粘连的治疗效果差。因此,探索 IUA 的发病机制,寻求有效治疗靶点来阻断子宫内膜纤维化的发生、预防宫腔粘连的形成显得尤为重要。
本实验通过大鼠子宫机械性搔刮损伤建立大鼠子宫搔刮损伤后纤维化修复模型,在此基础上探讨β-氨基丙腈在抑制大鼠子宫内膜损伤后纤维化中的作用及最佳使用剂量。赖氨酰氧化酶(lysyl oxidase,LOX)是一种细胞外依赖铜的氨基酸氧化酶,参与细胞外基质中胶原和弹性蛋白赖氨酸残基交联,在胶原和弹性蛋白由可溶性单体转变为不溶性纤维过程的初始阶段发挥重要作用,对维持细胞外基质的结构和功能正常、组织器官发育、创伤修复、细胞运动等都具有重要意义[16]。β-氨基丙腈通过与赖氨酰氧化酶家族的活性位点形成共价加合物来抑制赖氨酰氧化酶家族的活性从而导致其无法催化胶原交联的形成,是特异性的、不可逆的LOX抑制剂[17-18]。研究表明赖氨酰氧化酶家族在多个器官纤维化过程中发挥重要作用[12,19-21]。
本文以BAPN抑制赖氨酰氧化酶,探索β-氨基丙腈在抑制子宫内膜纤维化中的作用以及最佳使用剂量。因此,我们以100 mg/kg/d剂量为实验用最低剂量,并同时研究其二倍及三倍剂量在抑制子宫内膜纤维化中的作用效果,寻找最佳抑制大鼠子宫内膜纤维化的β-氨基丙腈用量。我们的研究结果表明大鼠子宫内膜损伤后使用不同剂量的赖氨酰氧化酶抑制剂β-氨基丙腈后,在各观察时间点,大鼠子宫大体形态学都有改善,好于对照组,组织学观察也发现用药后子宫内膜恢复更好,腺体数量较对照组增加。Masson染色结果也表明用药组的胶原含量较对照组低,而且以200 mg/kg剂量给药效果最佳。同时,组织器官内的胶原主要包括可溶性与不可溶性胶原,其中不可溶性胶原在组织器官的纤维化形成中发挥重要作用,不可溶性胶原的过多沉积可引起组织器官纤维化形成。羟脯胺酸为胶原所特有,约占胶原蛋白的13.4%,测定羟脯胺酸的含量可以反映出胶原蛋白的含量。因此,我们定量检测了正常组,实验组及对照组大鼠子宫的不可溶性胶原的含量,结果表明实验组的不可溶性胶原含量低于对照组,且以200 mg/kg β-氨基丙腈腹腔注射对大鼠子内膜不可溶性胶原纤维的抑制作用最佳,而300 mg/kg剂量组的不可溶性胶原与200 mg/kg剂量组无差异,但300 mg/kg剂量组尽管有改善子宫纤维化的作用,但给药后大鼠子宫内膜较薄,腺体数量较少而且此剂量导致大鼠死亡率明显上升,而且对胶原纤维的抑制作用并不优于200 mg/kg剂量组。以上结果说明β-氨基丙腈能够较好抑制大鼠子宫内膜机械性损伤后导致的胶原沉积,减轻纤维化。
我们推测β-氨基丙腈用量过大可能会影响大鼠机体正常功能从而导致组织修复能力下降,治疗效果差。因此我们认为β-氨基丙腈可以有效抑制Wistar大鼠子宫内膜纤维化,200 mg/kg给药量对机械刮宫后大鼠子宫内膜纤维化的抑制效果最佳。同时我们的研究结果也表明LOX家族可能参与了机械损伤后大鼠子宫内膜的纤维化过程。这些发现为进一步研究赖氨酰氧化酶家族与宫腔粘连的相关性以及赖氨酰氧化酶家族在机械损伤后大鼠子宫内膜纤维化过程中的作用机制,为宫腔粘连的治疗和发生机制的研究奠定了基础,提供了新的研究思路和方向。
【参考文献】
[1] Conforti A,Alviggi C,Mollo A,et al. The management of Asherman syndrome:a review of literature[J]. Reprod Biol Endocrinol,2013,11:118.
[2] March CM. Management of Asherman’s syndrome[J/OL]. Reprod Biomed Online,2011,23:63-76.
[3] 曹兴凤,王蔼明,赵勇,等. 宫腔操作对育龄女性的影响[J]. 生殖医学杂志,2014,23:435-441.
[4] 刘彩姣,王蔼明,赵勇. 细胞因子在宫腔粘连发病机制中的作用[J]. 生殖医学杂志,2017,25:575-579.
[5] Yu D,Wong YM,Ying C,et al. Asherman’s syndrome-one century later[J]. Fertil Steril,2008,89:759-779.
[6] 成九梅,段华,夏恩兰.宫腔粘连患者子宫内膜基质金属蛋白酶-9(MMP-9)表达的研究[J].中国妇幼保健,2007,22:2574-2576.
[7] Kagan HM,Li W. Lysyl oxidase: properties,specificity and biological roles inside and outside of the cell[J]. J Cell Biochem,2003,88:660-672.
[8] Csiszar K. Lysyl oxidases: a novel multifunctional amine oxidase family[J]. Prog Nucleic Acid Res Mol Biol,2001,70:1-32.
[9] Fogelgren B,Polgár N,Szauter K M,et al. Cellular fibronectin binds to lysyl oxidase with high affinity and is critical for its proteolytic activation[J]. J Biol Chem,2005,280:24690-24697.
[10] Kumari S,Panda TK,Pradhan T. Lysyl oxidase: its diversity in health and diseases[J]. Indian J Clin Biochem,2017,32:134-141.
[11] Kagan HM. Lysyl oxidase: mechanism,regulation and relationship to liver fibrosis[J]. Pathol Res Pmct,1994,190:910-919.
[12] Barryhamilton V,Spangler R,Marshall D,et al. Allosteric inhibition of lysyl oxidase-like-2 impedes the development of a pathologic microenvironment[J]. Nature Medicine,2010,16:1009-1017.
[13] Miana M,Galán M,Martínez-Martínez E,et al. The lysyl oxidase inhibitor β-aminopropionitrile reduces body weight gain and improves the metabolic profile in diet-induced obesity in rats[J]. Dis Model Mech,2015,8:543-551.
[14] Martínez-Martínez E,Rodríguez C,Galán M,et al. The lysyl oxidase inhibitor(β-aminopropionitrile) reduces leptin probrotic effects and ameliorates cardiovascular remodeling in diet-induced obesity in rats[J]. J Mole Cell Cardiol,2016,92:96-104.
[15] Xia XD,Lee J,Khan S,et al. Suppression of phosphatidylinositol 3-kinase/akt signaling attenuates hypoxia-induced pulmonary hypertension through the downregulation of lysyl oxidase[J]. DNA Cell Biol,2016,35:599-606.
[16] Dalton VK,Saunders NA,Harris IH,et a1.Intrauterine adhesions after manual vacuum aspiration for early pregnancy failure[J]. Fertil Steril,2006,85:1823.e1-3.
[17] Schenker JG,Margalioth EJ. Intrauterine adhesions: an updated appraisal[J].Fertil Steril,1982,37:593-610.
[18] Payne SL,Hendrix MJ,Kirschmann DA. Paradoxical roles for lysyl oxidases in cancer--a prospect[J]. J Cell Biochem,2007,101:1338-1354.
[19] Tang SS,Trackman PC,Kagan HM. Reaction of aortic lysyl oxidase with beta-aminopropionitrile[J]. J Biol Chem,1983,258:4331-4338.
[20] Ho YY,Lagares D,Tager AM,et al. Fibrosis--a lethal component of systemic sclerosis[J]. Nat Rev Rheumatol,2014,10:390-402.
[21] Van Bergen T,Marshall D,Van de Veire S,et al. The role of LOX and LOXL2 in scar formation after glaucoma surgery[J]. Invest Ophthalmol Vis Sci,2013,54:5788-5796.

