鸡β-防御素7的克隆及表达
易道生,魏晓东,缪永建,陈燕飞
(韶关学院英东生命科学学院,广东 韶关 512005)
抗菌肽是具有抗菌、抗病毒作用的小分子多肽,防御素是一类重要的抗菌肽,抗菌肽广泛存在于动物、植物和微生物中,哺乳动物防御素包括α-防御素、β-防御素和θ-防御素三亚类[1-2]。研究表明,防御素有很强的抑菌活性,能有效灭杀细菌、真菌以及病毒(如HIV病毒)等病原微生物[3-5]。目前,人类对微生物的抵抗主要使用化学药剂和抗生素,但滥用抗生素容易导致动物性食品抗生素超标和耐药菌株的出现,直接威胁人类的健康和安全[6]。使用生物体本身产生的抗菌物质——抗菌肽,既能达到抗菌目的,又可降解无残留,符合未来生态安全的发展趋势。
鸡体内有多种防御素,均属于β-防御素家族,其中命名为Gal-7的鸡β-防御素7主要存在于鸡骨髓中[7],在抵抗微生物侵害的防御过程中发挥重要作用[8]。改革开放以来,养殖业发展迅猛,集约化养殖条件下,病原微生物更易导致动物发病,为了降低动物的发病率,保护养殖业主的利益和保证动物源食品的质量安全,急需向养殖业引入新的绿色高效抗菌药物。如果用传统方法从鸡体内提取防御素或通过化学方法合成防御素,不但过程繁杂,且效率低、成本高,必将制约其大规模应用。采用基因工程的技术方法生产防御素为解决这个难题提供了一种高效低成本的手段。原核表达系统能高效表达小分子蛋白,并且能保持重组蛋白质的活性和保护其免疫原性。近年来,鸡防御素基因的克隆表达逐渐增多,但从鸡体内克隆Gal-7基因的研究国内还未见报道。Milona[9]采用大肠杆菌表达系统,表达了重组鸡Gal-7。李民欢等[10]化学合成了Gal-7,构建工程菌体外表达的Gal-7对葡萄球菌、沙门氏菌等多种病原菌都具有较强的抑制作用,为Gal-7的应用展示出诱人前景。本试验通过RT-PCR法克隆了Gal-7基因,构建了pET32a-Gal7表达载体,通过原核表达系统,大量表达Gal-7融合蛋白,为进一步研究Gal-7的生物学特性和结构功能关系奠定了基础,也为Gal-7天然抗菌药剂的应用提供了理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株 E.coli DH5α、E.coli BL21(DE3)、金黄色葡萄球菌。
1.1.2 载体及引物 pET32a、pUC18-T载体,购自上海生工生物工程技术服务有限公司;引物由上海生工生物工程技术服务有限公司合成。
1.1.3 酶与化学试剂 PCR试剂盒、DNA胶回收试剂盒、T载体克隆试剂盒、镍柱、核酸内切酶BamHⅠ和HindⅢ、T4 DNA Ligase、DL2000 DNA Marker、氨苄青霉素、IPTG、咪唑,均购自上海生工生物工程技术服务有限公司;Yeast extract、Tryptone购自OXOID公司;SDS-PAGE标准蛋白质Marker购自上海升正生物技术有限公司;琼脂糖、琼脂粉、GoldView Acid stain、Tris、Tris-酚,均为国产分析纯。
1.1.4 仪器设备 无菌操作台(苏州佳宝净化工程设备有限公司),振荡培养箱(哈尔滨市东联电子技术开发有限公司),TC-XX/H(b)型Ferrotec基因扩增仪(杭州大和热磁电子有限公司),电泳仪、紫外分析仪(北京市六一仪器厂),SP-752型紫外可见分光光度计(上海光谱仪器有限公司),台式离心机、高速冷冻离心机(上海安亭科学仪器厂),智能型超声波细胞粉碎机(上海之信仪器有限公司)。
1.2 试验方法
1.2.1 引物设计 以GenBank公布的Gal-7基因序列(NM_001001194)设计1对引物,
P1:gTggAT CCT TCA TTA TgAggC CTA TTg,P2:AgAAgC TTA gTT ATC AgC TCC TCC ATC。
上游引物加酶切位点BamHⅠ,下游引物加酶切位点HindⅢ 。
1.2.2 PCR扩增 用鸡脊髓成熟Gal-7基因为模板,用上述引物进行扩增。
反应体系:第一链cDNA模板1 μL,P1(50 pmol/L)0.5 μL,P2(50 pmol/L)0.5 μL,2× PCR Plus Master Mix 25 μL,添加无DNase双蒸水补足至50 μL,混匀,离心10 s。
反应条件:95℃预变性5 min;95℃变性30 s、52℃ 退火 30 s、72℃延伸 30 s,共 35 个循环;72℃延伸10 min。
扩增产物经胶回收与T载体连接后,导入E.coli DH5α扩增。
1.2.3 表达载体构建 提取DH5α阳性菌中的T- Gal7,用限制性核酸内切酶Hind III 和BamH I对T-Gal7质粒与pET32a载体分别进行双酶切,经电泳鉴定及胶回收纯化后,各取适量并加入T4 DNA Ligase连接,操作参照试剂盒说明书和《分子克隆实验指南》[11]实验方法进行。连接产物用于转化E.coli BL21(DE3),涂布于有氨苄青霉素选择性的LB平板上37℃培养。
1.2.4 阳性菌株的筛选与基因表达 挑取典型菌落,经质粒酶切、PCR扩增和上海生工生物公司测序,鉴定阳性菌落。测序正确的菌落,接种于液体培养基,1.0 mmol/L IPTG诱导表达5 h。1.2.5 表达产物纯化及鉴定 对诱导表达结束的菌液进行离心,收集菌体,菌体重悬于磷酸盐缓冲液(PBS)中,超声裂解细胞,离心收集上清液,经微孔滤膜(0.22 μm)过滤后,采用NTA-Ni亲和柱层析分离纯化蛋白,重组蛋白用SDS-PAGE电泳检测纯度,用紫外分光光度法测定蛋白含量。
1.2.6 鸡Gal-7重组蛋白的抗菌活性 Gal-7融合蛋白的抗菌活性以金黄色葡萄球菌为受试菌,采用混菌琼脂平板打孔扩散法[12]。金黄色葡萄球菌划线接种于LB平板培养基,37℃过夜培养后置于4℃冰箱作为菌种备用。无菌工作台内,用内径约6 mm的打孔器在金黄色葡萄球菌指示菌平板上均匀打孔,每孔加50 μL不同浓度纯化的鸡Gal7重组蛋白,对照孔加入50 μL无菌水,吸收后置37℃培养,24 h后观察结果。
2 结果与分析
2.1 鸡Gal-7基因扩增
以来自鸡脊髓的Gal-7成熟单链DNA为模版,P1、P2为引物,经PCR扩增,得到125 bp目的产物(图1)。PCR产物经T载体连接和大肠杆菌扩增,测序后与GenBank公布的鸡Gal-7基因比对,同源性为99%,核酸和预测的氨基酸序列如图2所示。

图1 鸡Gal-7基因PCR扩增产物电泳结果

图2 鸡Gal-7基因序列及预测的氨基酸序列
2.2 重组表达载体的构建与鉴定
DH5α扩增的Gal-7基因和pET32a质粒,经过提纯、双酶切,提取、连接,转化于E.coli BL21(DE3),选择抗氨苄青霉素阳性的菌落扩增,再次提取质粒酶切鉴定,在5 000、125 bp处出现条带(图3),表明提取的质粒含有Gal-7目的基因,表达质粒pET32a- Gal7构建成功。
2.3 重组鸡Gal-7蛋白的表达纯化与活性检测
将表达载体pET32a-Gal7导入E.coli BL21(DE3),经过1 mmol/L IPTG诱导表达5 h,表达产物达到产量显著增加,收集菌体经过超声破细胞、NTA-Ni亲和柱纯化分离,获得该表达产物,经SDS-PAGE电泳鉴定,大小和纯度与预测一致(图4)。使用金黄色葡萄球菌为指示菌,用打孔法检测重组蛋白的活性,结果表明,本试验获得的鸡Gal-7重组蛋白,有很强的抗金黄色葡萄球菌活性,最低抑菌浓度为0.10 mg/mL(图 5)。
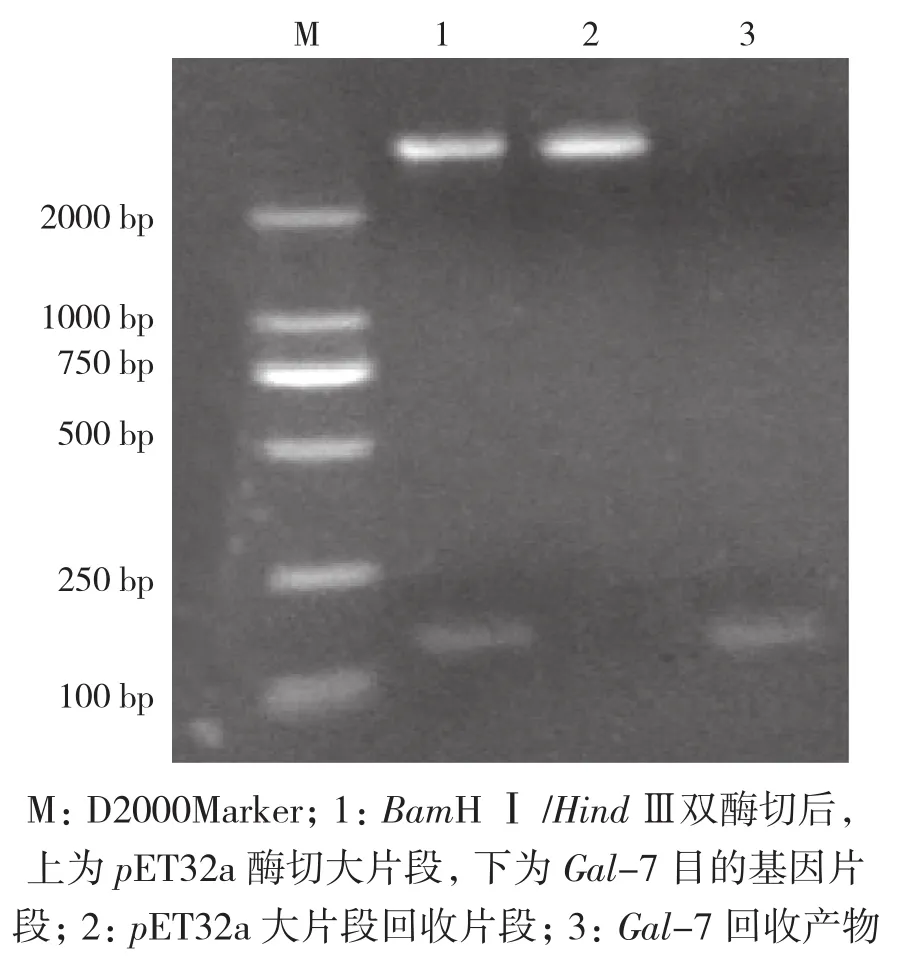
图3 pET32a-Gal7表达载体构建

图4 Gal-7融合蛋白纯化前后对比
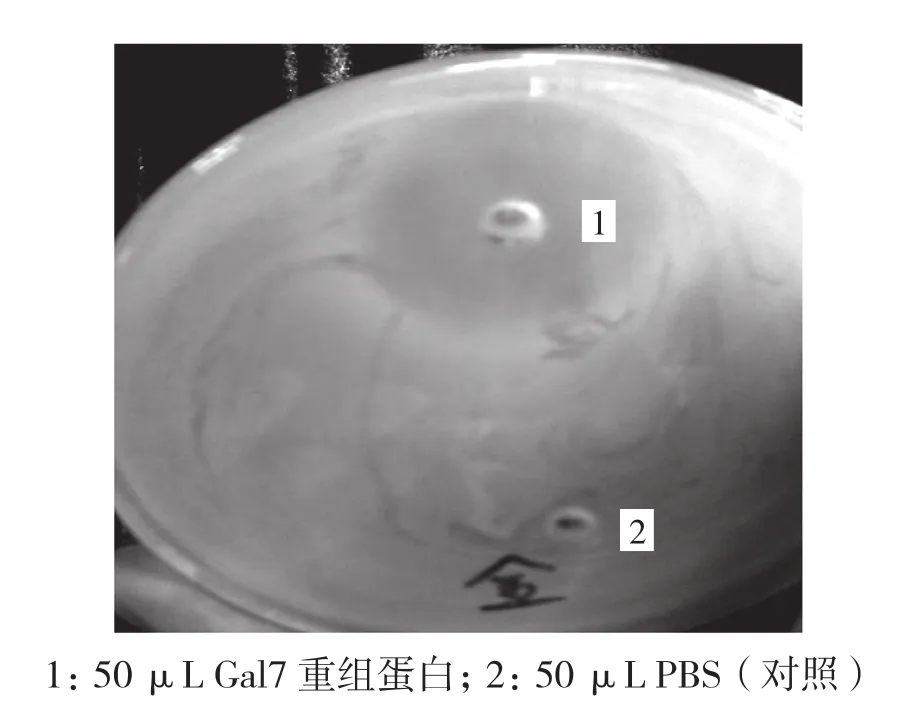
图5 Gal-7重组蛋白的抗菌活性
3 结论与讨论
鸡β-防御素家族是一群由18~50个氨基酸残基构成、分子量约3~5 ku、富含半胱氨酸、带正电荷的阳离子多肽,一般分布在染色体的3q3.5~3q3.7位置,其表达有种属与组织特异性[13]。防御素家族具有抗革兰氏阳性菌、革兰氏阴性菌、原生动物、部分真菌、被膜病毒、支原体、某些肿瘤等多种功能,是构成机体天然非特异性黏膜免疫的重要组成分子,抗菌能力大小与α-螺旋结构的长度、正电荷多寡呈正相关,防御素的表达还受到炎性分子等的诱导效应[4-5,9-10,14]。防御素的抗菌机理主要是静电效应,抗菌肽作用于细菌的细胞膜,与细菌表面负电荷相互作用,导致膜的通透性增大,以此穿透、杀灭细菌[3,15-16]。郭峰等[14]经过对防御素处理过的细菌进行电镜观祭,发现防御素作用于细菌后,破坏了细胞壁,在细菌外壁形成了囊泡,细菌质壁分离,内容物泄漏,导致细菌裂解死亡,推测细菌细胞壁和膜上都存在防御素的作用位点。由DNA序列推测的氨基酸排列表明,鸡β-防御素分子中包含6个半胱氨酸残基,从防御素分子的组成结构和抗菌机理分析,有学者认为成熟肽分子中的3 对二硫键对活性至关重要[17-18],Lin[19]对二硫键的研究也证明了二硫键在抗菌方面起到关键作用。本研究利用大肠杆菌原核表达系统表达纯化得到的重组鸡β-Gal7 抑菌活性较强,且蛋白质含有6个半胱氨酸,理论上可形成3对二硫键。
本研究通过大肠杆菌表达系统表达鸡Gal-7,采用常温、低转速、低IPTG 浓度诱导表达,得到了大量的可溶性蛋白。随后通过一系列的纯化过程获得鸡Gal-7 蛋白并进行电泳鉴定,而重组鸡Gal-7的体外抑菌试验的初步研究表明,对金黄色葡萄菌有较强的抑菌作用,最低有效浓度达到0.10 mg/mL。本研究结果为新型环保抗菌添加剂的研究提供了可靠途径,为进一步研究防御素的抗菌功能和机理奠定了基础。
参考文献:
[1]Cheng Y Y,Prickett M D,Gutowsk W,et al.Evolution of the avian β-defensin and cathelicidin genes[J].BMC Evolutionary Biology,2015,15:188-205.
[2]Tang K Y,Wang X,Wan Q H,et al.A crucial role of paralogous β-defensin genes in the Chinese alligator innate immune system revealed by the first determination of a Crocodilia defensin cluster[J].Developmental & Comparative Immunology,2018,81:193-203.
[3]Mukhopadhyay C S,Kumar R,Brah G S.Gallinacin and fowlicidin:Two promising antimicrobial peptides in chickens-A review[J].Veterinary World,2010,3(6):297-300.
[4]Lee M O,Jang H J,Rengaraj D,et al.Tissue expression and antibacterial activity of host defense peptides in chicken[J].BMC Veterinary Research,2016,12(81):231-240.
[5]Tereza Chrudimská,Jiřina Slaninová,Nataliia Rudenko,et al.Functional characterization of two defensin isoforms of the hard tick Ixodes ricinus[J].Parasites & Vectors,2011,4:63-72.
[6]周莉,高其双,陈志华,等.鸡防御素基因Gal-2的克隆及其真核表达载体的构建[J].上海畜牧兽医通讯,2015(1):6-8.
[7]Xiao Y J,Hughes A L,Ando J,et al.A genomewide screen identifies a single β-defensin Gene cluster in the chicken:implications for the origin and evolution of mammalian defensins[J].BMC Genomics,2004,5(1):56.
[8]Ewa M K,Paweł L,Justyna J,et al.Cathelicidins:family of antimicrobial peptides.A review[J].Mol Biol Rep,2012,39:10957-10970.
[9]Milona P,Townes C L,Bevan R M,et al.The chicken host peptides gallinacins 4,7,and 9 have antimicrobial activity against salmonella serovars[J].Biochemical and Biophysical Research Communications,2007,356(1):169-174.
[10]李民欢,祁克宗,涂健,等.鸡β-防御素7 在大肠杆菌中的表达及活性分析[J].微生物学通报,2012,39(12):1778-1786.
[11]萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].第3版.北京:科学出版社,2013.
[12]Tang Y Q,Yuan J,Ösapay G,et al.A cyclic antimicrobial peptide produced in primate leukocytes by the ligation of two truncated α-defensins[J].Science,1999,286(5439):498-502.
[13]谭仕旦,李 杨,曾璐瑶,等.鸡防御素基因及其与沙门菌抗性关系的研究进展[J].中国家禽,2017,4(39):37-41.
[14]郭峰.人β-防御素的改构及活性研究[D].石河子:石河子大学,2013.
[15]Bailleul G,Kravtzoff A,Joulin-Giet1 A,et al.The unusual resistance of avian defensin AvBD7 to proteolytic enzymes preserves its antibacterial activity[J].PLOS ONE,2016,11(8):1-20.
[16]Yang M,Zhang C Y,Zhang X H,et al.Structurefunction analysis of Avian β-defensin-6 and β-defensin-12:role of charge and disulfide bridges[J].BMC Microbiology,2016,16:210-228.
[17]Wang Y T,Zeng ZY,Zhang XH,et al.Identification and characterization of a novel defensin from Asian green mussel Perna viridis[J].Fish and Shellfish Immunology,2018,74:242-249.
[18]Małgorzata B,Monika S,Paulina Z,et al.Natural antimicrobial peptides as inspiration for design of a new generation antifungal compounds[J].Journal of Fungi,2017,46(3):1-36.
[19]Lin Y H,Teng K L,Huan L D,et al.Dissection of the bridging pattern of bovicin HJ50,a lantibiotic containing a characteristic disulfide bridge[J].Microbiological Research,2011,166(3):146-154.

