2016~2017年胶东地区商品肉鸡H9N2亚型禽流感病毒HA基因序列分析
董伟峰
(山东莱州市文昌路畜牧兽医站,山东 莱州 261400)
禽流感是正黏病毒科A型流感病毒属成员,我国自1994年首次在广东省分离到H9N2亚型AIV以来,该亚型的流感病毒一直在我国鸡群中广泛流行[1]。近年来H7N9、H10N8感染人群的相关研究报道显示,H9N2在这些病毒的重组演化过程中为其提供了内部基因,对病毒的变异起到了关键的作用[2,3]。山东地区是全国重要的肉鸡规模化养殖大省,近年来冬春季节H9N2的发病率居高不下,感染禽临床表现上呼吸道感染、支气管栓塞、气囊炎等症状,与其它病原体共感染时,还可引起免疫抑制[4],导致鸡群生长缓慢,死亡率增加,给商品肉鸡养殖造成巨大的经济损失。
HA蛋白是流感病毒表面最重要的糖蛋白,是流感病毒的主要保护抗原,可以诱导产生中和抗体。基于抗原性和HA基因血凝素分析,H9N2在国内被划分为三种主要的遗传分支:①A/Chicken/Beijing/1/94(BJ94)或the A/Duck/Hong Kong/Y280/97(Y280);② A/Quail/Hong Kong/G1/97(G1); ③ A/Duck/Hong Kong/Y439/97(Y439)。研究报道,近几年在中国的鸡群中一种由A/chicken/Zhejiang/HJ/2007为代表的新的基因型(G57分支)占到主导地位[5]。BJ94型病毒主要在鸡中流行,而在华东和华南地区已经被A/Ck/Shanghai/F/98(F98)所代表的F98型病毒逐渐取代[6]。
当前H9N2灭活疫苗在山东地区商品肉鸡中广泛应用,但临床发病仍然居高不下,为了在分子水平上阐述当前山东地区商品肉鸡H9N2的遗传变异特征,本研究对2016~2017年从山东省胶东地区发病肉鸡分离的13株AIV(H9N2亚型)的HA基因进行了序列分析,以期从分子生物学角度了解山东省H9N2亚型禽流感病毒的变异规律,为商品肉鸡H9N2禽流感的预防提供参考。
1 材料和方法
1.1 毒株 13株H9N2亚型禽流感病毒流行株由山东省农业科学院家禽研究所按照参考文献中的方法进行分离、鉴定及纯化[1]。其毒株代表号依次为XT31、XT33、XT34、XT35、XT39、XT43、XT44、XT46、XT205、XT208、XT211、MHS3、MHS5。
1.2 主要试剂 SPF鸡和鸡胚均由山东省农业科学院家禽研究所SPF鸡研究中心提供。Trizol、DNA回收试剂盒、质粒提取试剂盒、pMD18-T Vector、限制性内切酶和一步法RT-PCR试剂盒均购自大连宝生物有限公司。
1.3 引物合成 参考GenBank上已发表的H9N2亚型禽流感病毒HA基因序列,利用Oligo6.0软件设计了两对引物,由上海生工生物工程有限公司合成,用于扩增HA基因全长序列。
HA1片段预计扩增长度为574bp,引物序列为:
HA1-U:AGCAAAAGCAGGGGAATTTCAC;HA1-L:CTCTATTATTTGTGTATTGGGCGTC。
HA2片段预计扩增长度为1353bp,引物序列为:
HA2-U:ACTAAGGTCACTTTTTAGCTCTGCT;HA2-L:AGTAGAAACAAGGGTGTTTTTGC。
1.4 病毒 RNA的提取及HA基因的RT-PCR扩增 按照Trizol试剂盒说明书提取病毒RNA,取适量DEPC处理的超纯水溶解RNA。RT-PCR采用大连宝生物工程有限公司的一步法提取试剂盒,按说明书进行。
1.5 PCR产物的克隆与序列分析 凝胶提取试剂盒回收阳性产物,将回收物连接pMD18-T Vector,16℃,1.5h, 后转化至感受态 DH5α,37℃震荡1h后,均匀涂布含Amp、IPTG和X-gal的LB固体培养基平板,37℃培养14~16h。挑取白色菌落37℃培养过夜,提取质粒做EcoRⅠ酶切和PCR扩增双重鉴定。将所得的两段HA序列拼接,并结合GenBank上已发表的16株H9N2禽流感病毒株的HA基因序列,毒株具体信息及登录号详见表1。
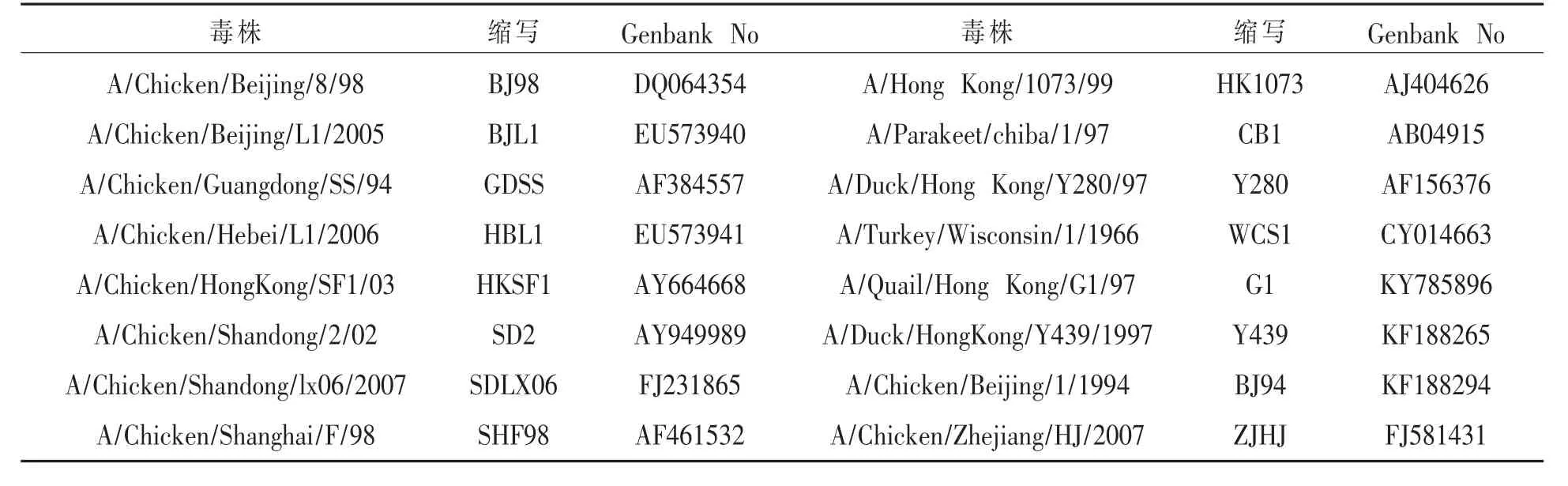
表1 H9N2毒株及其具体信息和基因登录号
取HA基因的全长氨基酸片段对分离株和参考株进行基因分型,利用DNASTAR和Mega5.10软件,分析H9N2的HA1/HA2裂解位点氨基酸序列,比较分离毒株与国内外近期发生的不同宿主源H9N2的HA基因的同源性,绘制系统进化发育树,从而对上述毒株的HA基因分子遗传变异情况进行分析。
2 结果与分析
2.1 RT-PCR结果 RT-PCR产物在0.01g/ml的琼脂糖凝胶中电泳,发现HA1在600bp处出现特异条带,HA2在1300bp处出现特异条带,电泳结果与预期大小一致。
2.2 重组质粒限制性内切酶鉴定结果 将提取的质粒通过PCR和酶切后获得两条电泳带,分别为600bp和1300bp左右,初步表明HA基因分段扩增获得了阳性克隆。
2.3 分离株HA基因核苷酸和氨基酸序列分析与比较 将双向测序结果用Dnaman软件拼接,获得13株H9N2亚型AIV的HA基因的cDNA全序列,全长1742bp,ORF全长为1683个核苷酸,位置为34~1716位核苷酸,编码560个氨基酸。将13个分离株与GenBank上发表的参考毒株进行核苷酸序列和氨基酸序列的同源性比较,结果如图1、图2所示。分离株与BJ94参考毒株HA基因的核苷酸之间的同源性为89.1%~91.3%,氨基酸序列之间的同源性为90.0%~93.4%;与A/chicken/Zhejiang/HJ/2007(G57分支)参考毒株 HA基因的核苷酸之间的同源性为89.1%~91.3%,氨基酸序列之间的同源性为93.6%~97.0%;而分离株之间的HA基因核苷酸同源性为94.1%~99.8%,氨基酸序列之间的同源性为94.3%~100%。
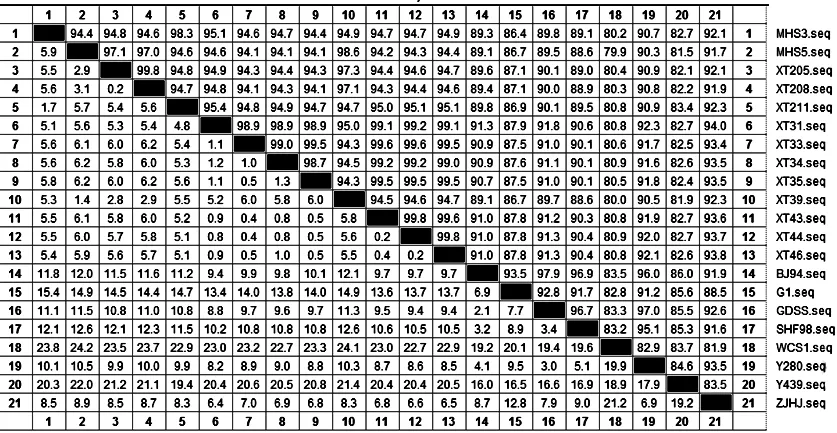
图1 H9N2分离株与参考株HA基因核苷酸同源性比较
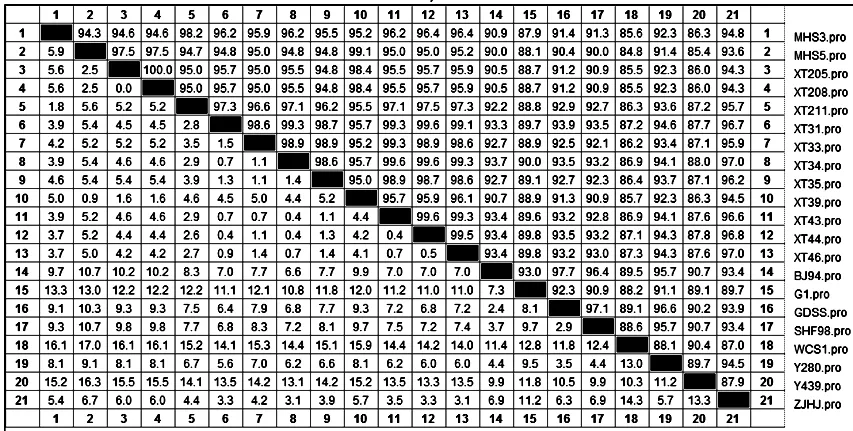
图2 H9N2分离株与参考株HA基因氨基酸同源性比较
通过DNAStar软件对所分离毒株的氨基酸序列进行分析,包括HA裂解位点附近的氨基酸序列、构成受体结合位点的氨基酸序列和潜在的糖基化位点,具体结果见表2、表3。

表2 分离株HA基因裂解位点序列及潜在糖基化位点分析

表3 H9N2分离株与参考株HA基因序列关键位点的比较
所有分离株的HA裂解位点均为RSSR↓GLF,有 6~8个潜在的糖基化位点(N-X-T/S,X 为除 P外的氨基酸),XT39毒株在 218~220位和313~315位出现糖基化位点双缺失,XT205和XT208毒株在218~220位糖基化位点缺失,XT33和MHS3毒株在 551~553位潜在糖基化位点缺失。13株分离株构成HA唾液酸受体结合位点的氨基酸在191位非常保守,为N(天冬酰胺),与经典的禽流感国内分离株一致。13株分离株中有3株在198位上变异为A (丙氨酸),6株变异为T(苏氨酸),1株变异为M(甲硫氨酸)三种形式。13株分离毒在234位受体结合位点均为L(亮氨酸),具有与哺乳动物唾液酸a,2-6受体结合的特征,该类毒株的流行在公共卫生上应值得重视。
2.4 HA基因进化分析 利用 Mega5.10软件,结合已发表的16株H9N2禽流感参考毒株的HA基因序列对HA基因的遗传进化关系进行分析,并绘制了基因进化树(图3)。由图3可知新分离株同属于欧亚分支中的A/Chicken/Beijing/1/1994(A/Duck/Hong Kong/Y280/97)亚群,与近年在中国鸡群中流行的由A/chicken/Zhejiang/HJ/2007为代表新的基因型(G57分支)遗传关系最近,推测是由其进化演变而来。

图3 H9N2AIV分离株和参考毒株HA基因氨基酸序列的系统进化树
3 讨论
自1966年首次分离获得H9N2亚型AIV以来,目前该亚型病毒已普遍存在于世界各国禽群中,对养禽业造成巨大的经济损失。鉴于HA基因在病毒的吸附、穿膜过程以及病毒的致病力方面均起着关键作用,因此持续开展对H9N2亚型禽流感病毒的HA基因变异分析的研究具有重要的现实意义。本研究对 2016~2017年来源于山东省商品肉鸡样品中分离鉴定的13株H9N2亚型AIV的HA基因进行扩增和测序。结果表明,分离株与BJ94参考疫苗毒株HA基因核苷酸之间的同源性为89.1%~91.3%,氨基酸序列之间的同源性为90.0%~93.4%;与 A/chicken/Zhejiang/HJ/2007(G57分支)参考毒株HA基因的核苷酸之间的同源性为89.1%~91.3%,氨基酸之间的同源性为93.6%~97.0%;而13株分离株之间的HA基因核苷酸同源性为94.1%~99.8%,氨基酸序列之间的同源性为94.3%~100%。结果显示与当前疫苗毒株具有较大差异。13株分离毒HA基因均与A/chicken/Zhejiang/HJ/2007(G57分支)在同一分支,这是否是当前商品肉鸡免疫失败引起临床发病的原因还需进一步研究。
HA裂解位点的氨基酸序列是决定AIV毒力的关键因素。研究表明,高致病力禽流感在机体内可被多种蛋白酶识别和裂解,具有广泛的组织嗜性,而低致病力毒株的HA在其裂位点附近通常只有一个精氨酸,只能被消化道和呼吸道内有限的蛋白酶识别,通常只引起这些组织的局部感染[7]。本研究中所分离的13株毒株的裂解位点氨基酸序列均为RSSR↓GLF,符合低致病性禽流感裂解位点的氨基酸序列特征。
HA基因除了决定病毒的致病力外,还决定其宿主范围。Matrosovich等[8]研究表明人源和禽源禽流感病毒在HA糖基化程度及受体不同成分结合能力均存在差异,禽流感HA上的受体结合位点呈 袋 状 , 由 109、151、163、191、198、202、203 和146~150、232~237aa 构成,这些位点的氨基酸相当保守,其中191aa(组氨酸)被认为是13种亚型的AIV病毒HA中都十分保守的一个氨基酸[9],本研究中分离株191aa均为天冬酰胺,与叶贺佳等[10]报道的一致。而198aa的变异为A、T、M。其他构成受体结合位点袋状结构的氨基酸在H9亚型内都很保守。刘金华等[11]报道可以感染哺乳动物和人类的H9N2亚型禽流感病毒在HA的234位为L(亮氨酸),具有与哺乳动物唾液酸α,2~6受体结合的特征,不能使人致病的H9N2亚型禽流感病毒HA基因的234位氨基酸是Q(谷氨酰胺),而本研究中所有分离株在234位为L(亮氨酸),因此商品肉鸡场中该类型毒株的流行在公共卫生上更值得重视。
HA上潜在的糖基化位点对病毒的受体亲和力、病毒毒力等多种生物学特性有影响。受体结合位点附近的糖基化会影响AIV和宿主细胞的结合水平,裂解位点附近的糖基化位点还可能影响到蛋白酶对HA前体蛋白的裂解。本研究中所有分离毒株在245~247位糖基化位点缺失,但在313~315位出现了一个新的潜在糖基化位点,糖基化位点的对本毒株毒力的影响尚需进一步验证。分离株HA基因与16株参考株的HA基因遗传系统进化关系表明,分离株与A/chicken/Zhejiang/HJ/2007(G57分支)分离株遗传关系最近,与疫苗株关系已远,怀疑该病毒可能是通过某种方式从长三角地区传递过来的。禽流感H9N2病毒也是多个片段共同作用的结果,除HA外,NA、NS、PB2等基因均可影响该分离株的致病力和抗原性,这些基因的变异能否改变病毒的毒力有待进一步研究。
本研究中通过对分离株分子生物学特征进行分析表明,目前H9N2病毒亚型呈现变异趋势,尽管裂解位点序列为RSSR↓GLF,显示仍为低致病力毒株。但生产中不断出现的商品肉鸡发病,给我们的临床防控工作带来了一定的难度,同时给我们的疫苗开发和疫情监测提出了更高的要求。因此,我们应该加强H9N2病毒的分子流行病学监测工作,及时了解掌握该病毒的变异趋势和进化规律,更好地为生产一线防控工作提供依据和指导。
参考文献:
[1] 陈伯伦,张泽纪,陈伟斌.禽流感研究 I:鸡A型禽流感病毒的分离与血清学初步鉴定[J].中国兽医杂志,1994,22(10):3-5.
[2] Watanabe T,Kiso M,Fukuyama S,et al.Characterization of H7N9influenza A viruses isolated from humans[J].Nature,2013,501(7468):551-5.
[3] Chen H,Yuan H,Gao R,et a.Clinical and epidemiologicalcharacteristics ofa fatalcase of avian influenza A H10N8 virus infection:a descriptive study[J].Lancet,2014,383(9918):714-721.
[4] 刘红旗,彭大新,程坚,等.H9N2亚型禽流感病毒血凝素基因的遗传变异[J].扬州大学学报:农业与生命科学版,2002,23(2):6-9.
[5] Pu J,Wang S,Yin Y,et al.Evolution of the H9N2influenza genotype thatfacilitated the genesis of the novel H7N9virus[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(2):548.
[6] 石火英,孙蕾,陈素娟,等.H9N2亚型禽流感病毒复制特性的基因分析[J].畜牧兽医学报,2008,39(2):189-194.
[7] Rohm C,Horimoto T,kawaoka Y,et al.Do hemagglutinin genes ofhighly pathogenic avian influenza virus constitute unique phylogenetic lineages?[J].Virology,1995,209(2):664-670.
[8] M N Matrosovich,A S Gambaryan,S Teneberg,et al.Avian influenza A viruses differ from human viruses by recognition of sialyloligosaccharides and gangliasides and by a higher conservation of the HA receptor-binding site[J].Virology,1997,233:224~234.
[9] Nobusawa E,Aoyama T,Kato H.Comparison of complete amino acid sequences and receptor-binding propertiesamong13 serotypeofhemagglutinin of influenza A virus[J].Virology,1991,182:475-485.
[10] 叶贺佳,梁昭平,彭特,等.2012~2015年 H9N2亚型AIV分离株HA基因的克隆及序列分析 [J].中国畜牧兽医,2016,43(5):1148-1155.
[11] 刘金华,吴清民,陈福勇,等.鸡源株与人源株H9N2流感病毒血凝素受体结合位点氨基酸比较与分析[J].中国预防兽医学报,2003,25(6):416~418.

