空气辅助微生物改变地层岩石与流体性质的能力研究
程明明 雷光伦 耿孝恒 张再旺 李学平 李甲亮 钟豪健
1.滨州学院资源与环境工程学院2.中国石油大学(华东) 石油工程学院
微生物在油层中繁殖,会伴随产生各种各样的化学、生物等反应,如酶促反应、原油降解等。在这些反应过程中,会产生气体、酯、酮类、有机酸、聚合物等[1-3],这些物质的存在会给储层地质特性及地层中的原油性质带来很大的改变。这些改变有利于提高采收率,如稠油降黏后可以大幅度提高原油在孔隙中的流动能力[4-5]。然而,油藏环境是极端缺氧的环境,微生物生长繁殖对氧含量极为敏感,注入地层的微生物繁殖效率低,限制了微生物提高采收率的进一步推广应用。因此,开展空气辅助微生物改变地层岩石与流体性质的研究,可为提高微生物采收率应用效果奠定研究基础[6-7]。
1 菌种来源
菌种分离自三叠系长6 油藏油样和井旁的油污土壤[8],在油藏温度下富集培养,取最终富集的培养液,稀释涂布后,利用油平板反复分离纯化,将不同形态的单菌落挑出,保存于斜面培养基上[9],于4℃冷藏备用。为了解菌种情况,对混合菌液进行了分离鉴定,分离得cq-1、cq-2、cq-3三株菌株。
2 空气辅助微生物改变地层岩石与流体性质的实验研究
2.1 空气辅助微生物改变岩石表面润湿性实验
将石英切片打磨后完全浸没入油品中,浸泡3天,使岩片与油充分接触。将5份菌株按体积分数3%的接种量接种于用模拟地层水配制的培养液中。同时,取同等质量的模拟地层水作为对照实验组。向菌液中通N210 min,去除菌液中溶解氧。通过空气泵向菌液中通入氧气,并通过气体流量控制仪使培养液中的氧气质量浓度分别达到0.5 mg/L 、1.5 mg/L、3.0 mg/L 、4.5 mg/L、6.5 mg/L。以常规模拟地层水为对照试验。将预处理过的石英切片放入菌液及空白对比水中,于油藏温度下培养。间隔24 h,测试接触角。
2.2 空气辅助微生物改变油水界面张力效率实验
用上述实验方法配制微生物菌液,使培养液中的氧气质量浓度分别达到0.5 mg/L 、1.5 mg/L、3.0 mg/L 、4.5 mg/L、6.5 mg/L。以常规模拟地层水为对照试验。向配制好的微生物菌液以及作为对照实验的模拟地层水中加入50 mL试验区原油,将培养瓶置于油藏温度下恒温培养10天,培养过程中保持试验瓶静置,避免扰动。测定不同时间的界面张力,研究不同溶氧条件下微生物生长时界面张力的变化[10-11]。
2.3 空气辅助微生物改变岩石毛管力和黏附功变化实验
微生物作用使岩石与水相的接触角减小,接触角越小,水相的黏附功越大,油相的黏附功越小,即油藏岩石越易水湿,注入水越易剥落滞留在岩石表面的油滴或油膜,利于提高采收率。
储层岩石由于跟原油、地层水等长期接触,这些流体中的某些组分(主要为胶质、石蜡等)会慢慢吸附在岩石表面,对岩石的性质造成一定的影响,主要表现为:大多数岩石从最初的亲水性慢慢转变为亲油性,因此大多数油藏具有亲油性,剩余油滞留在岩石表面、孔隙喉道和小毛细管中。适宜的溶氧量增强了微生物改变岩石表面性质的能力,使岩石表现为更强的水湿性,这样的结果对于提高原油采收率具有有利作用[12-13]。通过测定不同溶氧含量的菌液与岩石接触角及油水界面张力,可确定微生物生长时毛管力及黏附功的变化。
2.4 不同溶氧条件下微生物作用后的原油组分变化
地层中的微生物可以以原油中蜡为碳源,在以原油为碳源进行繁殖代谢过程中,消耗掉原油中的蜡。原油蜡含量减小,表现为原油黏度减小,凝固点降低,原油结蜡现象减弱,这也是微生物的防蜡机理。通过微生物作用后蜡含量分析,研究微生物作用前后原油蜡含量变化,确定微生物“吃蜡”能力。
用上述实验方法配制微生物菌液,使培养液中的氧气质量浓度分别达到0.5 mg/L 、5.5 mg/L、6.5 mg/L。向配制好的微生物菌液中加入50 mL试验区原油,将培养瓶置于油藏温度下恒温培养10天,培养结束后利用吸附色谱法测定原油胶质、沥青质含量,研究氧含量对微生物降解原油能力的影响。
3 实验结果与分析
3.1 菌株鉴定及结果
观察菌落的形态特征,进行生理生化特性试验,根据《伯杰细菌鉴定手册》(布坎南R E等 1984)和《常见细菌系统鉴定手册》(东秀珠等 2001)对筛选到的菌株进行初步鉴定[12]。
由表1可知:三株菌液中一株为假单胞菌(Pseudomonas),为好氧菌,有极强分解有机物的能力,可以将多种有机物作为能量来源,代谢产物主要由中性脂、糖脂和脂肽组成;一株为肠杆菌(Enterobacter xiangfangenis),为厌氧菌,化能有机营养,易于培养,繁殖快,可通过氧化多种简单有机化合物或发酵糖、多元醇、有机酸来获取生长代谢所需能量,糖类发酵的一种代谢主要终产物为混合有机酸,包括甲酸、乙酸、琥珀酸和乳酸,另一代谢主要终产物为中性溶剂,包括乙醇和丁二醇等;一株为地衣芽孢杆菌(Bacillus licheniformis),为兼性厌氧菌,生命力旺盛,耐酸耐碱、耐高低温、存活力极强,不受外界干扰。缺氧条件下,由三株菌复配的混合菌液中厌氧菌肠杆菌(Enterobacter xiangfangenis)会迅速繁殖,产生有效代谢产物。富氧条件下,混合菌液中处于休眠状态的好氧菌假单胞菌(Pseudomonas)和兼性好氧菌地衣芽孢杆菌(Bacillus licheniformis)迅速繁殖扩张,占领空间优势,产生多种有效代谢产物,包括脂肽类、肽聚糖、肽类、核酸类、磷酸类、腐殖酸类等。

表1 三株供试细菌的16SrDNA序列的Blast结果Table1 Blastresultofthetestedbacteriastrains'16SrDNA待鉴定菌株参比菌株编号NCBI登录号名称NCBI登录号同源性/%鉴定结果cq3-1KJ782614PseudomonasveroniiCIP104663CIP10466399.93Pseudomonascq3-2KJ782615Enterobacterxiangfangenis10-1710-1799.78Enterobacterxiangfangeniscq3-3KJ782616BacilluslicheniformisATCC14580ATCC1458098.86Bacilluslicheniformis

3.2 溶氧条件对微生物改变岩石润湿性的影响
微生物改变岩石润湿性的主要机理包括:极性基团之间的相互作用、微生物的沉淀效应、酸性基团之间的相互作用和离子之间的相互缔合作用。石英试片在对比水和不同溶氧条件下的菌液作用后的润湿角见图1。
由图1可知,石英试片经原油润湿处理后,水滴在试片上呈近球形,试片为油湿。生物作用后的试片表现出与之前不同的润湿性。通过观察可发现,水滴的高度比之前有所减小,而长度却有所增加,这说明试片的亲水性在增强。试片浸泡的时间越久,水滴越呈现出扁平状,其亲水性增强。在对比水中作用后的试片,水滴高度也减小,亲水性有增强,但强度均小于在菌液中,即微生物菌液对岩石润湿性的改变效率明显高于水。

由图2可知,试片对润湿角的作用效果与微生物作用的时间有关,时间越久,微生物在岩石表面产生的酸性物质越多,会使得润湿角发生一定程度的减小,然而这种减小的幅度却是不一样的。最终结果显示,与水相比,在改变润湿性方面菌液效果更好,也就意味着可以从岩石洗下更多量的原油。实验条件下,地层水对石英试片的润湿角降低23.21%左右,5.5 mg/L溶氧条件下菌液使润湿角降低56.94%,4.5 mg/L溶氧条件下菌液中试片润湿角降低50.14%,常规模拟水条件下菌液中试片润湿角降低43.98%。
3.3 不同溶氧条件下油水界面张力变化
微生物及其代谢产物在油水界面吸附是个动态平衡过程。微生物代谢产生的表面活性物质具有两亲性,亲水基是极性基团,亲油基是碳氢链,表面活性物质会借助其水溶性在孔隙水中溶解,在静电引力及分子间力的双重作用下,其亲水的基团插入水中,疏水的基团富集在油水界面上,形成定向排列的单分子层[14]。将水相的表面转变成了亲油基紧密排列的表面,油水界面张力显著降低。
不同溶氧浓度下,菌液作用前后原油的界面张力随时间变化曲线见图3。
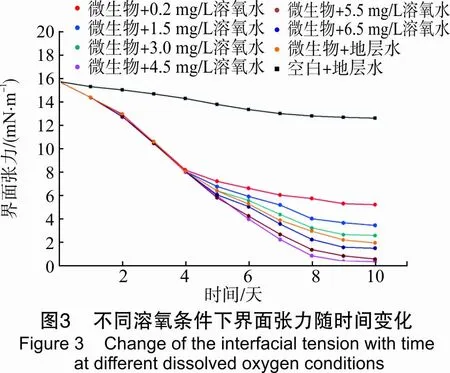
图3表明,实验过程中测得油与空白水的界面张力略有减小,表明水与原油接触时,界面张力基本不变化。在微生物生长实验过程中,测得的菌液与原油的界面张力不断减小,且在5天前界面张力几乎呈直线降低,5天后下降程度减缓。这是由于:5天前微生物大量生长繁殖,其代谢的活性剂、醇、酮、酸等溶剂迅速增加,并作用在油水界面上,这些两性物质在界面上的分布造成界面张力减小。10天时测得的模拟地层水作用的原油界面张力下降了19.81%,与0.5 mg/L溶氧条件下菌液作用后原油界面张力下降66.75%,与4.5 mg/L溶氧条件下菌液作用后原油界面张力下降80%以上。这表明,4.5 mg/L溶氧条件下,细菌生长繁殖迅速,产生表面活性物质较多,显著降低油水界面张力。所以,增加水中溶氧含量,有利于提高菌液降低油水界面张力的能力。
3.4 微生物改变岩石毛管力与黏附功大小计算
水及微生物与岩石作用毛管力变化曲线见图4。
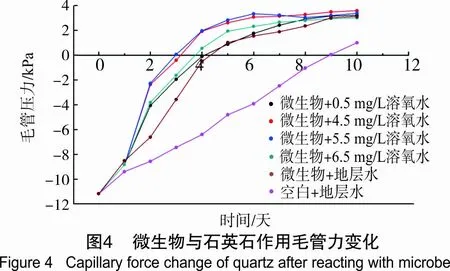
由图4可看出,由于原油长期与岩石接触,油中的胶质、石蜡、沥青质等有机组分吸附在岩石表面,使岩石具有亲油特性。实验开始时,测得的驱油毛管力均为负值,毛管力将阻止水、菌液进入毛细管,是驱油阻力,但水驱的毛管阻力比菌液驱的毛管阻力大。菌液与岩石接触两天后,菌液驱的毛管阻力下降程度远比水驱时大,即菌液比水更容易注入地层驱油。在菌液作用两天后,菌液驱的毛管力从负变为正,即从阻力变为动力。地层水、菌液与岩石持续作用3天后,对比水作用下的毛管力也变为正,且持续增加,即在纯水作用下油水界面力在变化很小的情况下,岩石变为亲水时,水驱油毛管力变为动力并增加很快,表明长时间水驱时,水的流动速度会越来越大,造成水的指进,形成明显的优势通道,对渗透率较低的孔道中的油波及较少,使得水驱采收率较低,残余油饱和度较。而菌液驱时,水指进减缓。在4.5~5.5 mg/L溶氧条件下,菌液驱毛管力由负变正,增加最快,表明溶氧量显著影响微生物改变岩石毛管力的能力,在适宜的溶氧条件下,微生物繁殖效率高,可较早突破适应期,进入对数生长期,大量菌体沉积在岩石表面,形成生物膜,改变岩石润湿性,另外代谢的有效活性物质增多,也有利于毛管力从阻力变为动力。对比水及微生物与岩石作用黏附功变化曲线见图5。
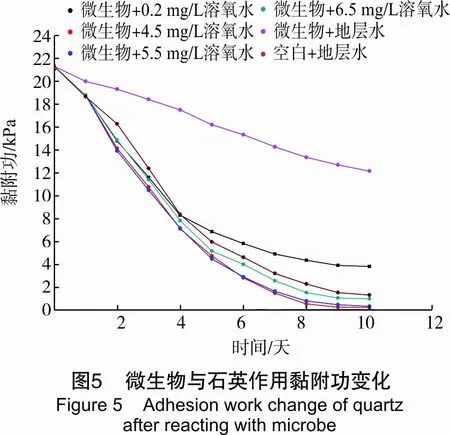
由图5可知,实验过程中测得与地层水接触岩石上油的黏附功有所降低。这一结果说明,地层水与岩石长期接触时,也能使岩石从油湿转变为水湿,即油易于从岩石表面脱落。在微生物生长实验过程中,测得的菌液与岩石的黏附功不断减小,且在前4天黏附功几乎呈直线降低,5天后下降程度减缓。原因是此段时间内微生物在繁殖过程中产生大量的代谢物,这些代谢物中含有的大量有机物质(醇、酮、酸等)吸附在油水界面上,使黏附功有所降低,原油易于剥落[15-16];6天时测得石英岩在模拟地层水作用下的黏附功下降了28.14%,在5.5 mg/L溶氧菌液作用下下降了86.52%以上。这表明,菌液降低黏附功的能力很强,即微生物驱时,很容易洗下岩石表面吸附的原油。增加溶氧,有利于提高微生物洗出原油的能力。
3.5 微生物改变原油性质能力分析
对0.5 mg/L、5.5 mg/L、6.5 mg/L溶氧条件下微生物作用原油以及对照原油的油、蜡质以及胶质含量测定结果见表2。
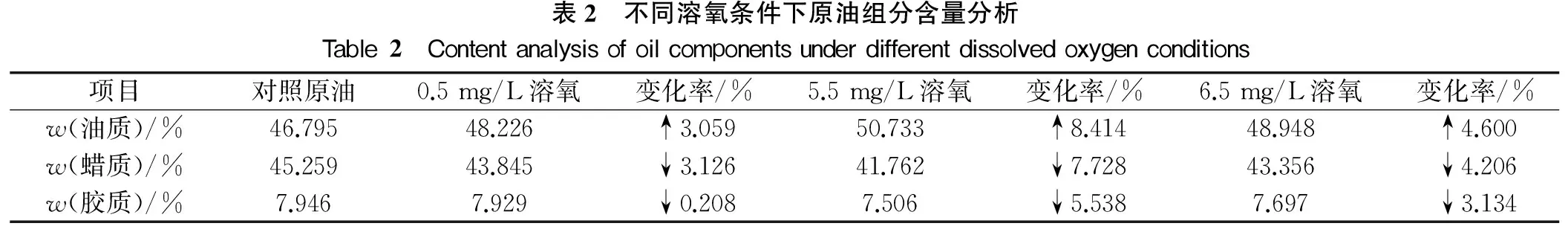
表2 不同溶氧条件下原油组分含量分析Table2 Contentanalysisofoilcomponentsunderdifferentdissolvedoxygenconditions项目对照原油0.5mg/L溶氧变化率/%5.5mg/L溶氧变化率/%6.5mg/L溶氧变化率/%w(油质)/%46.79548.226↑3.05950.733↑8.41448.948↑4.600w(蜡质)/%45.25943.845↓3.12641.762↓7.72843.356↓4.206w(胶质)/%7.9467.929↓0.2087.506↓5.5387.697↓3.134
由表2可看出,与对照原油相比,不同溶氧条件下微生物作用原油的油质都有所增加,蜡质以及胶质含量有所降低,溶氧含量不同,变化程度不同。其中,5.5 mg/L溶氧条件下微生物作用原油油质含量增加最高,达8.414(w)%,0.5 mg/L溶氧条件下微生物作用原油胶质含量降低程度最低,为0.208%(w)。说明增加溶氧能提高微生物的活性,提高微生物以原油为碳源的繁殖能力。可能的原因是在富氧环境中,好氧与兼性菌生长繁殖迅速,在加氧酶催化作用下,通过末端氧化或者次末端氧化等羟化途径,将氧分子的两个氧原子结合到长链烷烃或者芳烃的芳环内,将高碳烃转化为脂肪酸等物质进入三羧酸循环,使原油的高碳烃含量降低。
4 结 论
(1) 空气辅助可提高微生物菌液改变石英表面润湿角速度:接触7天后,模拟地层水中润湿角降低23.21%,未加氧的微生物菌液中润湿角降低43.98%;溶氧4.5~5.5 mg/L菌液中润湿角降低50.14%~56.94%。
(2) 溶氧浓度越高,菌液与原油作用后的界面张力下降越大:作用7天后,与模拟地层水接触的原油界面张力下降明显,与0.5 mg/L溶氧条件下菌液作用后原油界面张力下降66.75%,与4.5 mg/L溶氧条件下菌液作用后原油界面张力下降80%。
(3) 溶氧能加速原油在岩石表面吸附的黏附功下降,7天后,石英表面对原油的黏附功在模拟地层水中下降28.14%,在溶氧5.5 mg/L的菌液中下降达86.52%。
(4) 微生物降解原油后,油质组分增加,蜡质组分、胶质组分减小。与含溶氧0.5 mg/L培养的微生物作用后原油胶质组分降低0.208%;与含溶氧5.5 mg/L培养的微生物作用后,原油胶质组分降低5.538%。表明适宜的溶氧含量有利于提高微生物降解原油能力。
[1] 王红旗, 熊樱, 陈延君. 土壤中石油污染物微生物修复动力学和机理初探[J]. 环境化学, 2008, 27(3): 339-344.
[2] 马涛, 汤达祯, 张贵才, 等. 表面活性剂在油水界面的吸附行为[J]. 应用化工, 2007, 36(10): 1017-1020.
[3] 王红旗, 熊樱, 陈延君. 土壤中石油污染物微生物修复动力学和机理初探[J]. 环境化学, 2008, 27(3): 339-344.
[4] GIEG L M, DUNCAN K E, SUFLITA J M. Bioenergy production via microbial conversion of residual oil to natural gas[J]. Applied & Environmental Microbiology, 2008, 74(10): 3022-3029.
[5] 张明露, 马挺, 李国强, 等. 一株耐热石油烃降解菌的细胞疏水性及乳化、润湿作用研究[J]. 微生物学通报, 2008, 35(9): 1348-1352.
[6] 马秋莎, 刘硕, 王继富, 等. 石油污染湿地中长链烷烃的微生物降解研究进展[J]. 湿地科学, 2014, 12(2): 243-250.
[7] CCRAVO-LAUREAU C, LABAT C, JOULIAN C, et al. Desulfatiferula olefinivorans gen. nov., sp. nov., a long-chain n-alkene-degrading, sulfate-reducing bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(11): 2699-2702.
[8] JONES D M, HEAD I M, GRAY N D, et al. Crude-oil biodegradation via methanogenesis in subsurface petroleum reservoirs[J]. Nature, 2008, 451(7175): 176-180.
[9] 杨智. 石油降解菌的筛选及生物学特性研究[D]. 甘肃: 兰州理工大学, 2013.
[10] PATHAK K V, KEHARIA H. Application of extracellular lipopeptide biosurfactant produced by endophytic Bacillus subtilis K1 isolated from aerial roots of banyan (Ficus benghalensis) in microbially enhanced oil recovery (MEOR)[J]. 3 Biotech, 2014, 4(1): 41-48.
[11] 陈昊宇, 缪巍, 汪卫东, 等. 油田回注水微生物腐蚀贡献率的研究[J]. 石油与天然气化工, 2013, 42(1): 78-82.
[12] SANTINA S, CAPPELLO S, CATALFAMO M, et al. Biodegradation of crude oil by individual bacterial strains and a mixed bacterial consortium[J]. Brazilian Journal of Microbiology, 2015, 46(2): 377-387.
[13] 程明明, 夏添, 雷光伦, 等. 低渗透油藏多段塞微生物驱开发指标预测[J]. 中国石油大学学报(自然科学版), 2014, 38(6): 113-120.
[14] 高建波, 王乔怡如. 高界面活性微乳液型助排剂AO-4的制备及效果评价[J]. 石油与天然气化工, 2016, 45(3): 67-71.
[15] 雷光伦, 程明明, 高雪梅, 等. 注入参数对微生物提高采收率的影响研究[J]. 石油与天然气化工, 2014, 43(3): 287-291.
[16] 李佳, 罗一菁, 张忠智, 等. 微生物絮凝剂对油田采出液污水絮凝效果的研究[J]. 石油与天然气化工, 2012, 41(3): 341-345.

