桦木酸对环磷酰胺致小鼠肠道氧化损伤的影响
王喜红,朱利娟,易想炼,赵 静,向思亭,谭柱良,袁志航*,易金娥,2*
(1.湖南农业大学动物医学院,长沙 410128; 2.湖南畜禽安全生产协同创新中心,长沙 410128)
随着养殖业的迅速发展,氧化应激已经成为当代畜牧业热议的话题。肠道不仅是营养物质吸收的主要场所,也是动物机体内最大的免疫器官和分泌器官[1-2]。有文献报道,氧化应激能引起胃肠道功能障碍,导致畜禽免疫力下降,生产性能降低,肉品品质下降,甚至引起死亡[3],这给养殖效益带来了不言而喻的损害。因此,寻找纯天然的抗氧化剂及预防和修复肠道氧化损伤的方法迫在眉睫。
桦木酸(betulinic acid, BA)是一种植物源性五环三萜类物质,广泛分布在自然界的各种植物中。早在两百年以前,美国人常用白桦树皮来泡茶,用于益气养身以及治疗胃肠道疾病和痢疾[4-5]。随后研究发现,BA具有抗炎、抗氧化应激、提高机体免疫力等多种生物活性[6-11]。此外,BA具有极低的毒性,即使使用剂量高达500 mg·kg-1时,机体并没有出现明显的毒性现象[5,12]。我们前期试验发现,BA对地塞米松诱导的淋巴细胞凋亡具预防性的保护作用,该保护作用与BA能提高抗氧化酶活性,抑制自由基和脂质过氧化物产生,提高抗氧化力有关;进一步研究发现,BA阻断活性氧(reactive oxygen species,ROS)对线粒体膜通透性的影响和膜通透性下降,有效清除ROS对细胞的损伤,通过抗氧化应激从线粒体信号转导通路和内质网信号转导通路减少淋巴细胞凋亡,从而对淋巴细胞起到保护作用[13-15],证实BA的免疫调节作用有赖于抗氧化应激机能的发挥。BA对肠道氧化损伤调节是否具有改善作用,还未见报道。本试验采用腹腔注射环磷酰胺(cyclophosphamide, Cy)诱导小鼠肠道氧化损伤模型,研究BA对肠道氧化损伤的保护作用,旨在为建立缓解畜禽肠道氧化应激及预防和修复肠道氧化损伤的新方法提供理论依据和探索新的途径,为畜禽肠道健康的研究提供理论依据。
1 材料与方法
1.1 实验试剂
BA以白桦树皮(2016年春季收集于吉林省长春市,经60 ℃烘干后贮藏在黑暗、干燥处备用)为原料,从白桦树皮中提取桦木醇,经琼斯试剂氧化制备中间产物桦木酮酸后,用硼氢化钠还原合成BA,具体按文献方法[16]制备,HPLC测定BA纯度为96.53%;注射用Cy(批号:12042725)购自江苏恒瑞医药股份有限公司;小鼠分泌型免疫球蛋白α(secretory immunoglobulin a, SIgA)ELISA试剂盒购自上海博谷生物科技有限公司;超氧化物歧化酶(superoxide dismutase, SOD)、还原型谷胱甘肽(glutathione, GSH)和丙二醛(malondialdehyde, MDA)试剂盒均购自南京建成生物工程研究所。
1.2 试验方法
将25只健康KM小鼠,4~5 周龄,SPF级,体重(20±2)g,放置在相对湿度为50%~70%,温度为21~25 ℃的饲养房中预饲养1 W后,随机分为5组:即对照(NC)组、Cy组、0.5 mg·kg-1BA组、5.0 mg·kg-1BA组和50.0 mg·kg-1BA组。整个试验期间观察小鼠的生长状况,称量小鼠的初体重和末体重。NC组和Cy组给予等量的1%可溶性淀粉,其余组分别按0.5、5.0、50.0 mg·kg-1BA给药,将BA混悬于1%的可溶性淀粉中,按每20 g体重0.2 mL灌胃,1次·d-1,连续灌胃14 d。在第15、16天,除NC组外,其余各组连续2 d腹腔注射Cy(50 mg·kg-1),建立小鼠肠道黏膜损伤模型,NC组注射等量的生理盐水,禁食16 h(自由饮水)后,眼眶采血扑杀,收集血液,分离血清,置于-80 ℃冰箱保存备用。颈椎脱臼处死小鼠,取肝、脾和胸腺,分别称取器官质量(精确至0.000 1)。打开腹腔,剥离小肠,剪取两段空肠,一段在无菌生理盐水中轻轻晃动除净肠道内容物,截取空肠中部,置于冰上,沿肠管纵向剪开,用冰冷的PBS冲洗肠组织,用玻璃切片刮取空肠黏膜,检测SIgA的分泌。另一段空肠组织按组织与预冷生理盐水的质量体积比为1︰9制成10%组织匀浆,3 000 r·min-1离心15 min,收集上清液,检测SOD、GSH和MDA水平。
1.3 检测指标
1.3.1 BA对小鼠脾、胸腺、肝指数的测定 计算脾指数、胸腺和肝指数,单位以g·g-1表示。根据以下公式计算脏器器官指数。
脏器器官指数=(脏器器官/体重)×100(g·g-1)
1.3.2 小肠黏膜SIgA分泌水平的检测 严格按照试剂盒说明书操作,采用ELISA法检测肠黏膜SIgA分泌水平。
1.3.3 血清和肠道抗氧化能力的测定 采用硫代巴比妥酸法检测MDA的含量;二硫代二硝基苯甲酸法测定GSH含量;黄嘌呤氧化酶法测定SOD的活性。MDA、GSH和SOD水平的检测均按试剂盒说明书严格操作。
1.4 数据分析与处理
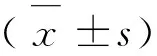
2 结 果
2.1 BA对小鼠器官指数的影响
BA连续灌胃14 d,小鼠表现未见异常反应,也无死亡现象,表明BA对小鼠并无显著毒性。由表1可知,与NC组相比,Cy组小鼠脾指数显著降低(P<0.05),胸腺指数和肝指数极显著降低(P<0.01),说明Cy导致免疫器官和肝萎缩。与Cy组相比,BA低、中剂量组脾指数和胸腺指数有所增加,但差异不显著(P>0.05);BA低、中剂量组能剂量依赖性提高肝指数,中剂量组升高显著(P<0.05)。
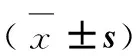
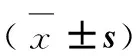
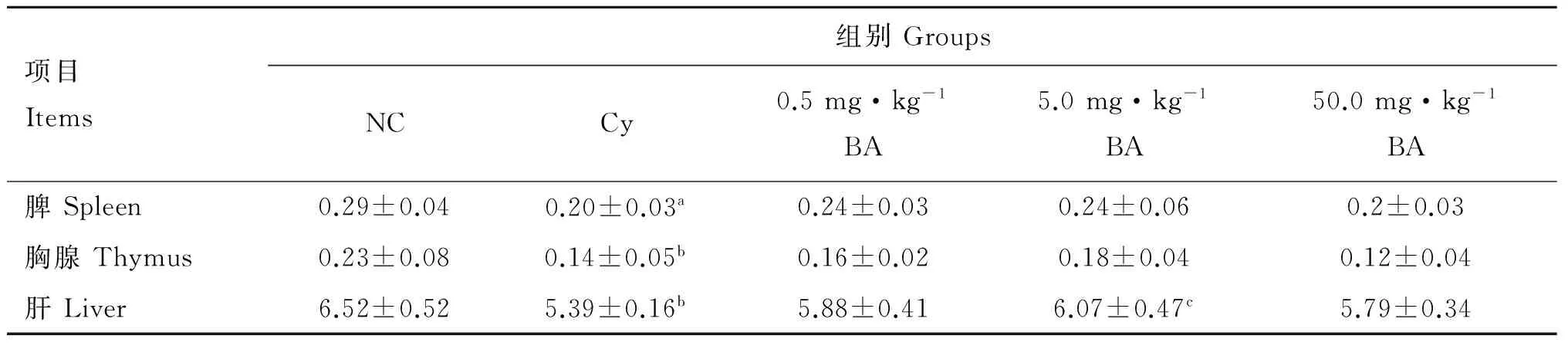
与NC组相比,a表示P<0.05,b表示P<0.01;与Cy组相比,c表示P<0.05
a.P<0.05, b.P<0.01 as compared with the NC group; c.P<0.05 as compared with the Cy group
2.2 BA对小鼠肠道黏膜SIgA分泌的影响
由表2可知,与NC组相比,Cy组SIgA的含量显著下降(P<0.05)。与Cy组相比,BA各剂量组SIgA的含量呈上升趋势,尤其以BA中剂量组差异极显著(P<0.01)。这说明BA对Cy抑制肠黏膜SIgA的分泌具有改善作用。
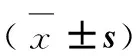
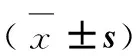
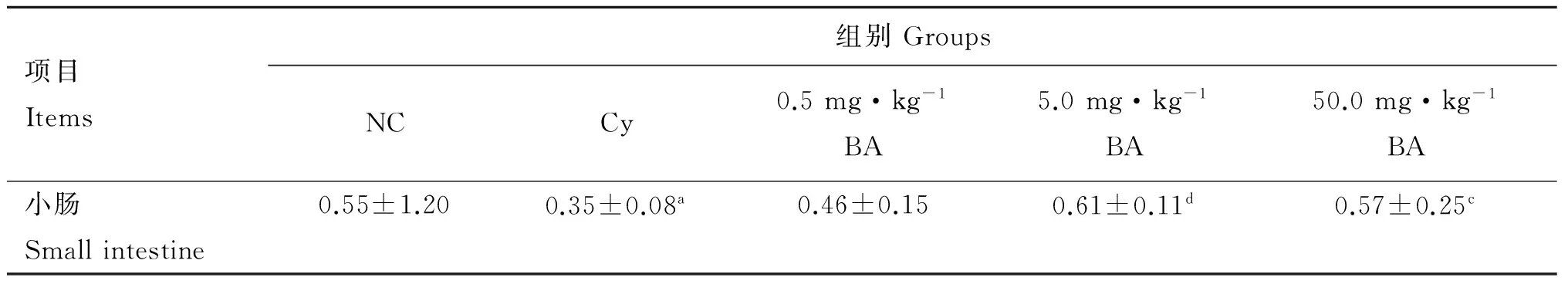
与NC组相比,a表示P<0.05;与Cy组相比,c表示P<0.05,d表示P<0.01
a.P<0.05 as compared with the NC group; c.P<0.05, d.P<0.01 as compared with the Cy group
2.3 BA对小鼠血清和肠道抗氧化能力的影响
由表3可知,与NC组相比,Cy组血清中MDA含量显著升高(P<0.05),SOD和GSH活性变化无明显影响;与Cy组比较,BA各剂量组中MDA有下降趋势,但差异不显著(P>0.05),SOD和GSH活性无显著性差异(P>0.05)。
由表4可知,与NC组相比,Cy组小肠组织中MDA含量升高,但差异不显著(P>0.05),SOD活性未见明显变化,但GSH含量显著上升(P<0.05)。与Cy组比较,BA各剂量组肠道MDA含量呈下降趋势,但差异不显著(P>0.05),SOD和GSH活性无明显变化(P>0.05)。
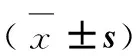
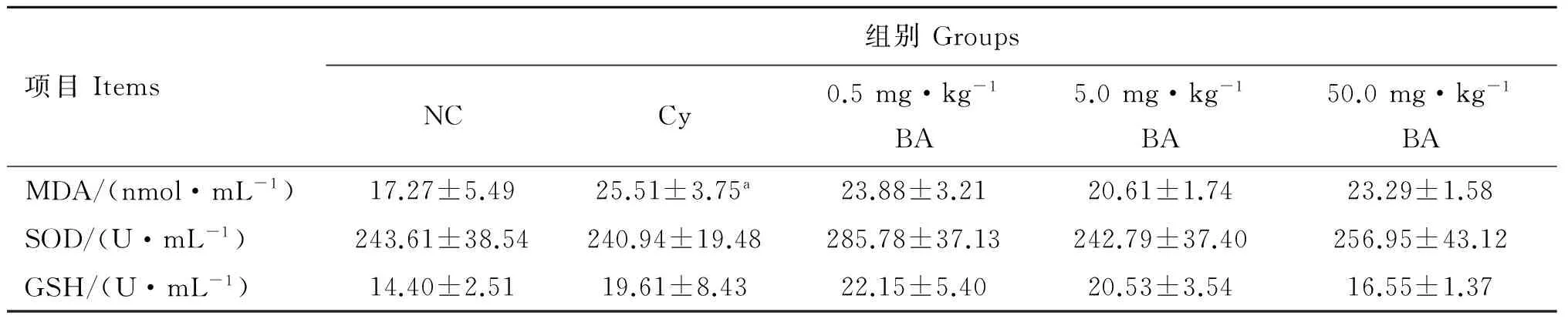
项目Items组别GroupsNCCy0.5mg·kg-1BA5.0mg·kg-1BA50.0mg·kg-1BAMDA/(nmol·mL-1)17.27±5.4925.51±3.75a23.88±3.2120.61±1.7423.29±1.58SOD/(U·mL-1)243.61±38.54240.94±19.48285.78±37.13242.79±37.40256.95±43.12GSH/(U·mL-1)14.40±2.5119.61±8.4322.15±5.4020.53±3.5416.55±1.37
与NC组相比,a表示P<0.05
a.P<0.05 as compared with the NC group
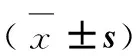
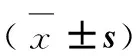

项目Items组别GroupsNCCy0.5mg·kg-1BA5.0mg·kg-1BA50.0mg·kg-1BAMDA/(nmol·mg-1)1.13±0.261.84±0.971.24±0.601.06±0.261.22±0.42SOD/(U·mg-1)0.96±0.261.07±0.350.99±0.440.93±0.241.23±0.16GSH/(U·mg-1)4.68±0.107.32±1.59a6.71±1.396.43±1.687.72±2.03
与NC组相比,a表示P<0.05
a.P<0.05 as compared with the NC group
3 讨 论
Cy是常用的一种免疫抑制剂,尤其是对胃肠道的毒副作用最为明显,例如造成呕吐、腹泻等,主要原因是Cy能够促进机体释放更多的自由基,促进肠道氧化损伤,破坏肠黏膜结构的完整性,降低机体免疫力[17-20]。脾和胸腺是机体最重要的免疫器官[21-22]。肝是最重要的代谢兼排毒器官,国内外研究报道肝也是免疫器官之一[23-25]。有文献报道,机体免疫力的强弱可以通过免疫器官质量与体重的比值来反映[26]。另有文献报道,动物发生应激并且免疫力低下会加剧对肠道的损伤[27]。在我们前期研究中已经发现,BA能增强免疫器官的抗氧能力和免疫力,并对酒精性肝损伤有预保护作用,而这种作用依赖于BA的抗氧化应激机能的发挥[13,28]。本试验发现,Cy能显著降低脾、胸腺、肝器官指数,这说明Cy成功诱导氧化应激模型,在氧化应激状态下引起免疫器官萎缩,用BA预处理后缓解了Cy引起的降低趋势,尤其是中剂量效果最好。说明BA对Cy诱导的脏器萎缩有一定的保护作用,进而保护了肠道黏膜屏障,增强了肠道的抗氧化能力。
黏膜免疫是机体的第一道免疫防线,而肠黏膜免疫的主效因子是SIgA[29-30]。SIgA能调控肠道内微生态平衡,干扰并阻止致病抗原附着宿主细胞、减轻病原菌毒力,从而减少病原体的传播及感染[31]。有文献报道,SIgA分泌增加可以增强肠黏膜免疫力和抗病力,在免疫防御系统中占有非常重要的作用[32]。另有文献报道,SIgA明显下降,肠道免疫屏障受损,与肠道脂质过氧化增强有关[33]。在以往的研究中发现,BA具有很强的抗氧化能力和免疫调节能力,且通过清除活性氧自由基,对Dex诱导的氧化损伤中脂质过氧化有一定的调节作用[10-11,34]。本试验结果显示,Cy显著降低小鼠肠道SIgA的含量,说明Cy引起的肠道氧化应激进一步造成小鼠肠黏膜免疫屏障损伤;当用BA预处理后,能明显提高SIgA含量,说明BA对小鼠肠黏膜氧化损伤时SIgA的分泌有改善作用,从而对肠道免疫屏障起到一定保护作用,尤其是中剂量效果最好,进一步促进肠道增强抗氧化能力。
MDA属于不饱和脂肪酸过氧化产物中的一种,含量的高低可以反映脂质过氧化程度的强弱[11]。我们前期研究发现,BA预处理后,通过降低肝组织MDA含量、提高GSH水平,增强GSH-Px和SOD活性,保护酒精诱导的肝损伤,并且这种保护作用可能与BA自身的抗氧化性有关[13]。本试验MDA结果与其相似,BA预处理后,血清和小肠中MDA含量均呈下降趋势,但是,可能由于小鼠个体差异较大,每组小鼠仅5只,导致MDA差异不显著,说明BA对Cy导致的脂质过氧化具有预保护作用。SOD是机体重要的抗氧化酶,可以调节机体氧化和抗氧化平衡[10,35],而本试验中血清和小肠中SOD活力并未见明显变化,有可能是BA和50 mg·kg-1Cy对SOD活力并不起作用,也有可能由于小鼠个体差异较大所导致的误差,具体原因有待后续试验进一步验证。GSH是机体重要的抗氧化剂,通过清除活性氧,保护机体的细胞膜结构以及其功能的完整性[36],而值得注意的是,本试验Cy处理后,小肠中GSH含量显著上升,血清中GSH含量也呈上升趋势,可能是机体的一种代偿反应,由于Cy造肠道急性氧化应激模型,刺激肠道分泌过量GSH,维持机体氧化系统平衡。崔筱琳等根据近年来谷胱甘肽防治疾病研究进展的报道中提出假设观点,当组织发生病变,将降解GSH抵抗氧化应激带来的损伤,机体捕捉到相关信号后,迅速促进组织中合成和释放大量GSH来适应新环境,随着组织病变的不断发展,GSH的消耗率将大于合成率,所以在发病初期,组织中GSH水平要比正常组织高[37]。BA处理后,血清和肠道的GSH水平变化无显著影响,但BA低、中剂量组小肠中GSH水平呈量效递减关系,使其表达量逐步趋于正常,BA高剂量未起到一个积极的作用。总体表明,BA具有提高动物体抗氧化能力和缓解Cy导致的脂质过氧化的潜力,尤其是中剂量效果最好。BA通过清除机体内过量ROS,缓解肠道和机体脂质过氧化,维持机体氧化系统平衡,提高动物机体和肠道的抗氧化能力。
4 结 论
BA通过缓解免疫器官萎缩,促进肠黏膜SIgA的分泌,降低机体及肠道组织局部MDA水平,增强机体和肠道组织局部的抗氧化功能,减轻Cy引起的氧化损伤。说明BA对Cy诱导的肠道氧化损伤具有预保护作用,其具体机制有待后续进一步研究。
参考文献(References):
[1] 孙怡燕. 浅谈肠道的重要功能[J]. 医药前沿, 2012(22): 283.
SUN Y Y. Talking about the important function of gut[J].FrontiersofMedicine, 2012(22): 283. (in Chinese)
[2] 李 维, 孙开济, 孙玉丽, 等. 乳酸菌缓解肠道氧化应激研究进展[J]. 动物营养学报, 2016, 28(1): 9-14.
LI W, SUN K J, SUN Y L, et al. Research progress in relieve effect of lactobacillus in intestinal oxidative stress[J].ChineseJournalofAnimalNutrition, 2016, 28(1): 9-14. (in Chinese)
[3] 杨雪芬, 周桂莲. 氧化应激对鸡肠道健康的影响研究[J]. 中国家禽, 2011, 33(24): 7-11.
YANG X F, ZHOU G L. Study of oxidative stress on intestinal health effects[J].ChinaPoultry, 2011, 33(24): 7-11. (in Chinese)
[4] 刘妙娜, 王 腾, 李 巍, 等. 桦木酸抗肝纤维化作用的实验研究[J]. 华中科技大学学报: 医学版, 2015, 44(6): 682-685, 690.
LIU M N, WANG T, LI W, et al. Effect of betulinic acid on carbon tetrachloride-induced liver fibrosis in rats[J].ActaMedicinaeUniversitatisScientiaeetTechnologiaeHuazhong, 2015, 44(6): 682-685, 690. (in Chinese)
[5] 易金娥, 邬 静, 文利新, 等. 桦木酸的药理作用研究进展[J]. 中草药, 2014, 45(14): 2118-2124.
YI J E, WU J, WEN L X, et al. Research progress on pharmacological activities of betulinic acid[J].ChineseTraditionalandHerbalDrugs, 2014, 45(14): 2118-2124. (in Chinese)
[6] CICHEWICZ R H, KOUZI S A. Chemistry, biological activity, and chemotherapeutic potential of betulinic acid for the prevention and treatment of cancer and HIV infection[J].MedResRev, 2004, 24(1): 90-114.
[8] YI J E, OBMINSKA-MRUKOWICZ B, YUAN L Y, et al. Immunomodulatory effects of betulinic acid from the bark of white birch on mice[J].JVetMedSci, 2010, 11(4): 305-313.
[9] 易金娥, 袁莉芸, 文利新, 等. 桦木酸对小鼠淋巴细胞及巨噬细胞的影响分析[J]. 畜牧兽医学报, 2011, 42(1): 124-130.
YI J E, YUAN L Y, WEN L X, et al. Effects of betulinic acid on lymphocyte and macrophage in mice[J].ActaVeterinariaetZootechnicaSinica, 2011, 42(1): 124-130. (in Chinese)
[10] 易金娥, OBMINSKA-MRUKOWICZ B, 杜金艳, 等. 桦木酸对巨噬细胞免疫功能和抗氧化作用的研究[J]. 营养学报, 2010, 32(3): 281-285.
YI J E, OBMINSKA-MRUKOWICZ B, DU J Y, et al. Effects of betulinic acid on immune function and antioxidant activity of mouse peritoneal macrophages[J].ActaNutrimentaSinica, 2010, 32(3): 281-285. (in Chinese)
[11] 易金娥, 屠 迪, 邬 静, 等. 桦木酸对小鼠免疫器官抗氧化能力的影响[J]. 动物营养学报, 2012, 24(4): 786-790.
YI J E, TU D, WU J, et al. Effects of betulinic acid on antioxidant ability of immune organs in mice[J].ActaZoonutrimentaSinica, 2012, 24(4): 786-790. (in Chinese)
[12] ZUCO V, SUPINO R, RIGHETTI S C, et al. Selective cytotoxicity of betulinic acid on tumor cell lines, but not on normal cells[J].CancerLett, 2002, 175(1): 17-25.
[13] 夏 伟, 朱若岑, 蒋维维, 等. 桦木酸对小鼠酒精性肝损伤的保护作用[J]. 营养学报, 2015, 37(1): 68-72.
XIA W, ZHU R C, JIANG W W, et al. Protection of betulinic acid against liver injury induced by alcohol in mice[J].ActaNutrimentaSinica, 2015, 37(1): 68-72. (in Chinese)
[14] YI J E, ZHU R C, WU J P, et al.Invivoprotective effect of betulinic acid on dexamethasone induced thymocyte apoptosis by reducing oxidative stress[J].PharmacolRep, 2016, 68(1): 95-100.
[15] YI J E, ZHU R C, WU J P, et al. Ameliorative effect of betulinic acid on oxidative damage and apoptosis in the splenocytes of dexamethasone treated mice[J].IntImmunopharmacol, 2015, 27(1): 85-94.
[16] 易金娥, 文立新, 袁莉芸, 等. 白桦树中桦木醇的提取与桦木酸合成研究[J]. 湖南农业大学学报: 自然科学版, 2010, 36(3): 574-580.
YI J E, WEN L X, YUAN L Y, et al. Study on extraction of betulin from the white birch and synthesis of betulinic acid[J].JournalofHunanAgriculturalUniversity:NaturalSciences, 2010, 36(3): 574-580. (in Chinese)
[17] 张志远, 王海莉, 苗明三. 扶正中药复方对环磷酰胺所致免疫功能低下小鼠免疫器官和肠黏膜CD3+、CD4+、CD8+的影响[J]. 中医研究, 2008, 21(12): 17-20.
ZHANG Z Y, WANG H L, MIAO M S. Effect ofFuzhengHerbal Compound on CD3+, CD4+and CD8+of immune organs and intestinal mucosa in immunodeficient mice induced by cyclophosphamide[J].TraditionalChineseMedicinalResearch, 2008, 21(12): 17-20. (in Chinese)
[18] 吴 皓, 林洪生, 裴迎霞, 等. 人参皂甙Rg3对荷瘤及环磷酰胺化疗小鼠黏膜免疫力影响[J]. 中国肿瘤, 2006, 15(6): 369-371.
WU H, LIN H S, PEI Y X, et al. Effect of ginsenosid Rg3 on the mucosal immunity in tumor-bearing mice treated with cyclophosphamide[J].BulletinofChineseCancer, 2006, 15(6): 369-371. (in Chinese)
[19] 严胜泽, 马玉芳, 廖吕燕, 等. 太子参多糖对环磷酰胺所致肠道黏膜损伤小鼠SIgA、IL-2、IL-6含量的影响[J]. 中国畜牧兽医, 2015, 42(5): 1187-1192.
YAN S Z, MA Y F, LIAO L Y, et al. Effect of pseudostellaria polysaccharides on SIgA,IL-2 andIL-6 contents of intestinal mucosal injured mice caused by cyclophosphamide[J].ChinaAnimalHusbandry&VeterinaryMedicine, 2015, 42(5): 1187-1192. (in Chinese)
[20] 曹 露. 鱿鱼墨多糖对环磷酰胺所致小鼠肠道黏膜上皮细胞损伤的保护作用研究[D]. 青岛: 中国海洋大学, 2013.
CAO L. Protective Effects of polysaccharides from the ink of ommastrephes bartrami on cyclophosvnamide-induced mucosa epithelial cell’s injury in mice small intestine[D]. Qingdao: Ocean University of China, 2013. (in Chinese)
[21] 郭登方. 脾切除自体移植脾组织血管、神经再生及对脾功能恢复调控意义的研究[D]. 福州: 福建医科大学, 2015.
GUO D F. Study on the regeneration of blood vessels, nerves and their regulation for immune function in auto-transplanted spleen[D]. Fuzhou: Fujian Medical University, 2015. (in Chinese)
[22] 宋金星, 薛协超, 党冰怡, 等. 0~28日龄SPF仔大鼠免疫功能变化规律的研究[J]. 黑龙江畜牧兽医, 2017(9): 245-247.
SONG J X, XUE X C, DANG B Y, et al. Study on the change of immune function in 0~28-day- old SPF rats[J].HeilongjiangAnimalScienceandVeterinaryMedicine, 2017(9): 245-247. (in Chinese)
[23] SHETH K, BANKEY P. The liver as an immune organ[J].CurrOpinCritCare, 2001, 7(2): 99-104.
[24] TRIGER D R. The liver as an immunological organ[J].Gastroenterology, 1976, 71(1): 162-164.
[25] 闫 蕾, 赵彩彦. 肝脏—一个新的免疫器官[J]. 国际内科学杂志, 2009, 36(4): 206-210.
YAN L, ZHAO C Y. Liver-a new immune organ[J].InternationalJournalofInternalMedicine, 2009, 36(4): 206-210. (in Chinese)
[26] 苗明三, 顾丽亚, 方晓艳, 等. 当归补血汤多糖对气血双虚大鼠胸腺、脾脏的影响[J]. 中国组织工程研究, 2005, 9(3): 162-163.
MIAO M S, GU L Y, FANG X Y, et al. Effect of Danggui Buxue Tang polysaccharide on thymus and spleen of rats with the deficiencies of both Qi and blood[J].ChineseJournalofClinicalRehabilitation, 2005, 9(3): 162-163. (in Chinese)
[27] 徐元庆, 史彬林, 郭祎玮, 等. 壳聚糖对断奶仔猪免疫器官及胃肠道发育的影响[J]. 饲料工业, 2013, 34(3): 32-35.
XU Y Q, SHI B L, GUO Y W, et al. Effects of chitosan on the development of immune organs and gastrointestinal tracts in weaned piglets[J].FeedIndustry, 2013, 34(3): 32-35. (in Chinese)
[28] YI J E, XIA W, WU J P, et al. Betulinic acid prevents alcohol-induced liver damage by improving the antioxidant system in mice[J].JVetSci, 2014, 15(1): 141-148.
[29] 王定越, 徐盛玉, 宋 洁, 等. 分泌性免疫球蛋白A与肠道黏膜免疫的关系及其分泌的营养调控[J]. 动物营养学报, 2012, 24(10): 1854-1860.
WANG D Y, XU S Y, SONG J, et al. Secretory immunoglobulin A: Relationship with intestinal mucosal immunity and nutritional regulation of its secretion[J].ActaZoonutrimentaSinica, 2012, 24(10): 1854-1860. (in Chinese)
[30] 宝 中, 冉多良, 童贻刚. 分泌型免疫球蛋白A的研究进展[J]. 生物技术通讯, 2009, 20(2): 263-265.
BAO Z, RAN D L, TONG Y G. Advances in research on secretory immunoglobulin A[J].LettersinBiotechnology, 2009, 20(2): 263-265. (in Chinese)
[31] 李 伟, 陈庆森. 肠道黏膜免疫屏障及其菌群与机体健康关系的研究进展[J]. 食品科学, 2008, 29(10): 649-655.
LI W, CHEN Q S. Research progress of relationship of human health with intestinal mucosal immunity and microflora[J].FoodScience, 2008, 29(10): 649-655. (in Chinese)
[32] 谢全喜, 张建梅, 谷 巍. 植物乳杆菌对肉鸡生长性能、免疫功能和抗氧化能力的影响[J]. 中国饲料, 2013(14): 26-30.
XIE Q X, ZHANG J M, GU W. Effects of lactobacillus plantarum on growth performance, immune function and antioxidant of broilers[J].ChinaFeed, 2013(14): 26-30. (in Chinese)
[33] 李 生, 杨 勇, 丁百静, 等. 非酒精性脂肪性肝炎大鼠肠道分泌液sIgA的变化[J]. 胃肠病学和肝病学杂志, 2011, 20(2): 124-127.
LI S, YANG Y, DING B J, et al. Changes of sIgA of intestinal mucosal fluid in the progress of non-alcoholic steatohepatitis in rats[J].ChineseJournalofGastroenterologyandHepatology, 2011, 20(2): 124-127. (in Chinese)
[34] 朱若岑, 夏 伟, 谭柱良, 等. 桦木酸对Dex致小鼠氧化损伤的保护作用[J]. 中国兽医学报, 2016, 36(2): 305-309.
ZHU R C, XIA W, TAN Z L, et al. Protective effect of betulinic acid on oxidative damage induced by dexamethasone in mice[J].ChineseJournalofVeterinaryScience, 2016, 36(2): 305-309. (in Chinese)
[35] 帅学宏, 胡庭俊, 陈炅然, 等. 鬼臼多糖对小鼠免疫功能和抗氧化能力的影响[J]. 畜牧兽医学报, 2008, 39(7): 1000-1004.
SHUAI X H, HU T J, CHEN J R, et al. Effects of podophyllum emodi polysaccharide on immune function and antioxidant capability in mice[J].ActaVeterinariaetZootechnicaSinica, 2008, 39(7): 1000-1004. (in Chinese)
[36] 李晓玲. 香烟提取物对肺间质纤维化的影响机制以及还原型谷胱甘肽的干预作用[D]. 石家庄: 河北医科大学, 2014.
LI X L. The mechanism of the cigarette smoke extract effects on pulmonary fibrosis and the intervention effect of the reduced glutathione[D]. Shijiazhuang: Hebei Medical University, 2014. (in Chinese)
[37] 崔筱琳, 王凤山. 谷胱甘肽防治疾病的研究进展[J]. 中国现代应用药学, 2017, 34(4): 631-636.
CUI X L, WANG F S. Research progress of glutathione in the prevention and treatment of diseases[J].ChineseJournalofModernAppliedPharmacy, 2017, 34(4): 631-636. (in Chinese)

