RELMα/FIZZ1信号通路对血管新生影响的细胞学研究*
储 新, 李 彤, 杨永曜
(1贵州医科大学附属人民医院心内科, 2贵州省人民医院消化内镜科, 3贵州省人民医院心内科, 贵州 贵阳 550000)
近年来,易损血管(vulnerable vessel),即 “易于出现血管内皮损伤、脂质浸润和血管壁炎症,动脉粥样硬化发生和发展迅速,进而导致心肌缺血症状或发展成为易损斑块的血管”的概念提出后,易损血管中斑块不稳定及不良血管功能导致的心、脑血管事件,如心肌梗塞和脑卒中等已成为全球的主要死因[1-2],日益受到重视。因此,寻找新的治疗靶点,改善易损血管中易损斑块的成份及血管舒缩功能,使其向稳定性斑块方向逆转,成为防治急性心血管事件的重要内容。FIZZ1属于抵抗素(resistin)样分子家族成员,因此又命名为抵抗素样分子α(resistin-like molecule α,RELMα),在选择性激活的巨噬细胞、缺氧的肺血管壁和炎症的肉芽组织中均有表达,具有促增殖、血管收缩、血管新生和类趋化因子的作用。Chen等[3]研究提示FIZZ1通过激活Raf-ERK1/2-p38 MAPK信号转导通路收缩气道平滑肌,而RELMα/FIZZ1 与动脉粥样硬化血管新生的关系及其机制报道甚少,因此,本文探讨RELMα/FIZZ1对易损的小鼠主动脉血管平滑肌细胞MOVAS及小鼠主动脉内皮细胞(mouse aortic endothelial cell,MAEC)的血管生成的影响及其相关机制。
材 料 和 方 法
1 材料
MAEC和MOVAS细胞购自广州吉妮欧生物科技有限公司;胎牛血清和DMEM培养基购自Gibco;聚凝胺(polybrene)购自上海吉凯制药技术有限公司;兔抗鼠FIZZ1(RELMα)、钙调蛋白(calmodulin,CaM)和肌球蛋白轻链激酶(myosin light chain kinase,MLCK)抗体购自Abcam;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG购自博士德公司;pGSadeno-HK、pGSadeno-RELMα/FIZZ1、pGSadeno-shRNA control和pGSadeno-shRNA RELMα/FIZZ1腺病毒表达载体均由美国约翰霍普金斯大学医学院Angelini教授惠赠;Ca2+检测试剂盒购自凯基公司;Matirgel购自Corning;逆转录试剂盒和real-time PCR 试剂盒购自TaKaRa;FIZZ1(RELMα)、CaM和MLCK引物均由上海吉凯制药技术有限公司合成。
2 方法
2.1腺病毒感染细胞 通过免疫荧光法对2种细胞进行鉴定,其中MAEC以vWF抗体免疫荧光进行鉴定,MOVAS细胞以α-SMA免疫荧光进行鉴定。2株细胞均培养至对数生长期,消化收集细胞,按照每孔4×105个接种于6孔培养板,生长至80%左右时,将腺病毒液加入培养的细胞中,并加入5 mg/L的polybrene进行病毒感染;同时取未感染细胞作为对照(control)组,混匀、过夜感染后换成正常的完全培养基。感染72 h后观察荧光,判断感染效率,并检测 FIZZ1/RELMα蛋白的表达。
2.2MTT实验和活细胞计数检测细胞的增殖能力 腺病毒分别感染MAEC 和MOVAS细胞,培养72 h后将各组细胞接种于96孔板,每孔接种3×103个细胞, 5% CO2、37 ℃培养0、24、48和72 h,设3个复孔,收集各个时点细胞,每孔加入 20 μL 5 g/L MTT检测试剂,置于培养箱培养4 h,检测波长490 nm处各孔的吸光度(A),同时通过人工计数的方法检测各时点活细胞数,以103为数量级计数。
2.3MAEC基质胶管腔形成的观察 96孔板中每孔加人50 μL Matrigel,轻轻摇晃培养板使其铺平于孔内,37 ℃放置2 h,使Matrigel凝固。MAEC感染腺病毒,培养72 h后,收集细胞,每孔加入1×104个细胞,37 ℃、5% CO2培养24 h,倒置显微镜下观察各组细胞的管腔形成情况。在特定的时点采集图片,并且进行图像分析(Wimasis全自动分析软件),统计成环数、细胞覆盖面积和结点。
2.4MOVAS细胞内Ca2+浓度变化的检测 腺病毒感染MOVAS细胞72 h后,用胰酶将细胞消化成单细胞悬液,加入离心管中,1 000 r/min 离心5 min,弃上清;用1×PBS重悬细胞,1 000 r/min离心5 min,弃上清;用1 mL 1×PBS重悬细胞;加入5 μmol/L Fluo-3 AM-DMSO,混匀,置入37 ℃水浴箱中避光孵育30 min;1 000 r/min离心5 min,弃上清,1×PBS洗涤2次, 1 mL 1×PBS重悬细胞,流式细胞仪检测细胞内Ca2+浓度。
2.5Western blot检测MOVAS细胞内CaM与MLCK蛋白的表达 腺病毒感染MOVAS细胞,培养72 h后,消化收集细胞,用细胞裂解液提取细胞总蛋白,BCA法检测总蛋白浓度,蛋白经溴酚蓝处理后进行SDS-PAGE,上样量为20 μg,浓缩胶60 V电泳60 min,分离胶120 V电泳70 min,湿转法转膜100 V 60 min,5% BSA封闭60 min用相应的I抗(根据说明书稀释)4 ℃孵育过夜,后加入II抗(羊抗兔IgG, 1∶5 000)室温孵育1 h。ECL化学发光,X线底片显影。
2.6Real-time PCR检测MOVAS细胞内CaM与MLCK的mRNA表达 腺病毒感染培养72 h后,弃去原培养基,使用预冷的PBS洗涤细胞;TRIzol法提取细胞总RNA,以提取的总RNA为模板,逆转录成cDNA,反应体系为70 ℃保温10 min后迅速在冰上冷却2 min、42 ℃ 60 min、72℃ 15 min。按照Real-Time PCR试剂盒(RR420A)进行扩增,扩增 40 个循环周期,每个标本3个复孔。检测CaM和MLCK的mRNA相对表达量。引物序列见表1。
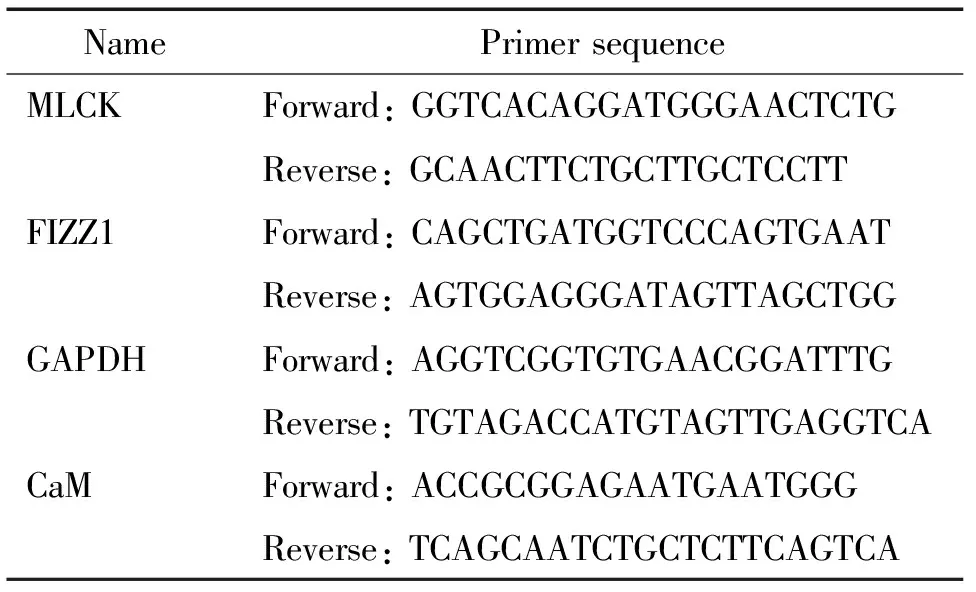
表1 Real-time PCR引物序列
3 统计学处理
采用SPSS 17.0统计软件进行数据分析。计量资料用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间多重比较采用SNK法,以P<0.05表示差异有统计学意义。
结 果
1 腺病毒感染细胞的鉴定结果
MAEC 和MOVAS 细胞感染腺病毒,其感染效率较高,Western blot检测显示过表达RELMα/FIZZ1组中RELMα/FIZZ1蛋白表达显著升高,而干扰组中RELMα/FIZZ1蛋白表达显著减低(P<0.05),见图1。
2 MTT法检测RELMα/FIZZ1对MAEC和MOVAS细胞增殖能力的影响
细胞活力检测结果表明,以MAEC为研究对象,过表达RELMα/FIZZ1可显著提高细胞活力,而干扰RELMα/FIZZ1的表达则显著抑制细胞活力(P<0.05);以MOVAS细胞为研究对象,过表达RELMα/FIZZ1可显著提高细胞活力,而干扰RELMα/FIZZ1的表达则显著抑制细胞活力(P<0.05);显示过表达RELMα/FIZZ1可促进MAEC和MOVAS的生长,干扰 RELMα/FIZZ1抑制MAEC和MOVAS的生长,见表2。活细胞计数结果与MTT法检测结果趋势相同,随实验进行,与过照组比较, RELMα/FIZZ1过表达组活细胞数量显著升高,具有统计学意义(P<0.05);而干扰RELMα/FIZZ1则活细胞数量升高受抑制(P<0.05),显示过表达RELMα/FIZZ1可促进MAEC和MOVAS细胞的增殖,干扰 RELMα/FIZZ1抑制MAEC和MOVAS细胞的生长,见表3。
3 MAEC管腔形成的观察
管腔形成实验结果示,与对照组比较,过表达RELMα/FIZZ1使MAEC管腔形成数目显著增加,而干扰RELMα/FIZZ1的表达,MAEC管腔形成数显著减少(P<0.05),见图2。
4 MOVAS细胞内Ca2+浓度的变化
各组细胞内Ca2+平均荧光强度结果显示,与对照组比较,RELMα/FIZZ1过表达可显著提高MOVAS细胞内Ca2+浓度,而干扰RELMα/FIZZ1则细胞内Ca2+浓度显著降低(P<0.05),见图3。
5 RELMα/FIZZ1对MOVAS细胞内CaM与MLCK蛋白表达的影响
过表达RELMα/FIZZ1上调MOVAS的CaM与MLCK表达(P<0.05);干扰RELMα/FIZZ1抑制MOVAS的CaM与MLCK表达(P<0.05),见图4。
6 RELMα/FIZZ1对MOVAS细胞内CaM与MLCK mRNA表达的影响
过表达RELMα/FIZZ1上调MOVAS胞内CaM与MLCK的mRNA表达(P<0.05);干扰RELMα/FIZZ1抑制MOVAS胞内CaM与MLCK的mRNA表达(P<0.05),见图5。

Figure 1. The cell infection rate and the results of Western blot detection in the cells infected with adenovirus for 72 h. Mean±SD.n=3.*P<0.05vspGSadeno-HK group;#P<0.05vspGSadeno-shRNA control group.
图1腺病毒感染72h细胞感染率与Westernblot检测结果的比较
表2MTT法检测感染腺病毒后MAEC和MOVAS细胞活力的变化
Table 2. MTT assay was used to detect the viability of the MAEC and MOVAS cells infected with adenovirus (A490value. Mean±SD.n=3)

CellsGroup0h24h48h72hMAECpGSadeno⁃HK0.348±0.0030.417±0.0041.040±0.0151.347±0.023pGSadeno⁃RELMα/FIZZ10.354±0.0060.538±0.006∗1.286±0.016∗1.743±0.011∗pGSadeno⁃shRNAcontrol0.349±0.0020.428±0.0051.084±0.0391.348±0.017pGSadeno⁃shRELMα/FIZZ10.341±0.0020.396±0.0060.818±0.005#0.99±0.011#MOVASpGSadeno⁃HK0.359±0.0020.437±0.0050.942±0.0101.278±0.023pGSadeno⁃RELMα/FIZZ10.355±0.0030.502±0.005∗1.187±0.013∗1.538±0.008∗pGSadeno⁃shRNAcontrol0.367±0.0050.448±0.0040.979±0.0071.298±0.009pGSadeno⁃shRELMα/FIZZ10.352±0.0030.405±0.006#0.796±0.005#0.907±0.004#
*P<0.05vspGSadeno-HK group;#P<0.05vspGSadeno-shRNA control group.
表3活细胞计数法检测感染腺病毒的MAEC和MOVAS细胞增殖能力的变化
Table 3. The viable cell number counting was udes to detect the proliferation ability the MAEC and MOVAS cells infected with adenovirus (×103viable cell numbers. Mean±SD.n=3)
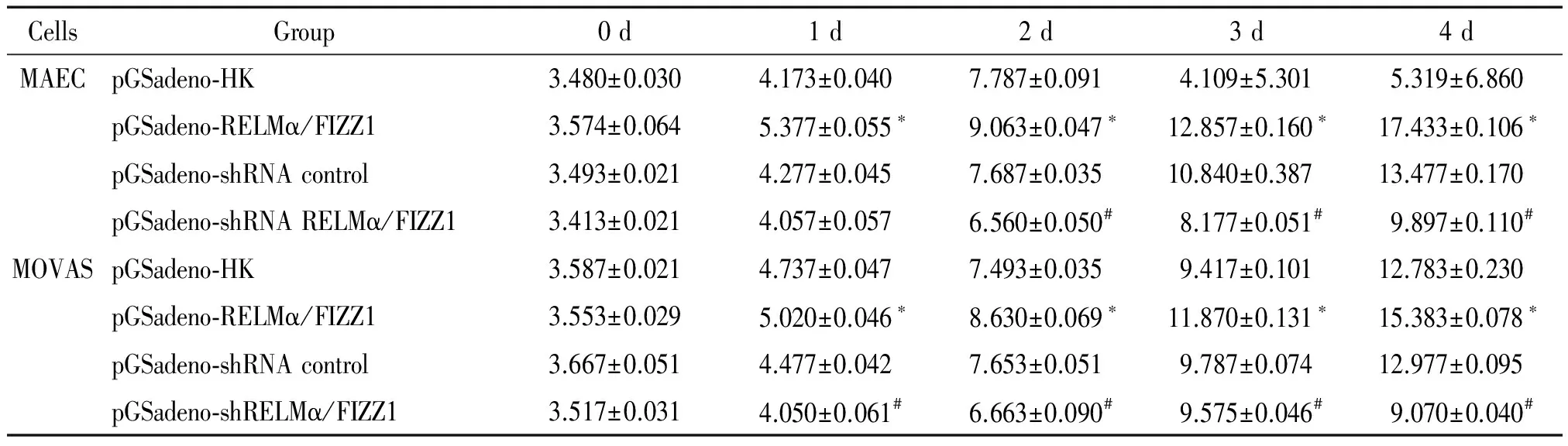
CellsGroup0d1d2d3d4dMAECpGSadeno⁃HK3.480±0.0304.173±0.0407.787±0.0914.109±5.3015.319±6.860pGSadeno⁃RELMα/FIZZ13.574±0.0645.377±0.055∗9.063±0.047∗12.857±0.160∗17.433±0.106∗pGSadeno⁃shRNAcontrol3.493±0.0214.277±0.0457.687±0.03510.840±0.38713.477±0.170pGSadeno⁃shRNARELMα/FIZZ13.413±0.0214.057±0.0576.560±0.050#8.177±0.051#9.897±0.110#MOVASpGSadeno⁃HK3.587±0.0214.737±0.0477.493±0.0359.417±0.10112.783±0.230pGSadeno⁃RELMα/FIZZ13.553±0.0295.020±0.046∗8.630±0.069∗11.870±0.131∗15.383±0.078∗pGSadeno⁃shRNAcontrol3.667±0.0514.477±0.0427.653±0.0519.787±0.07412.977±0.095pGSadeno⁃shRELMα/FIZZ13.517±0.0314.050±0.061#6.663±0.090#9.575±0.046#9.070±0.040#
*P<0.05vspGSadeno-HK group;#P<0.05vspGSadeno-shRNA control group.
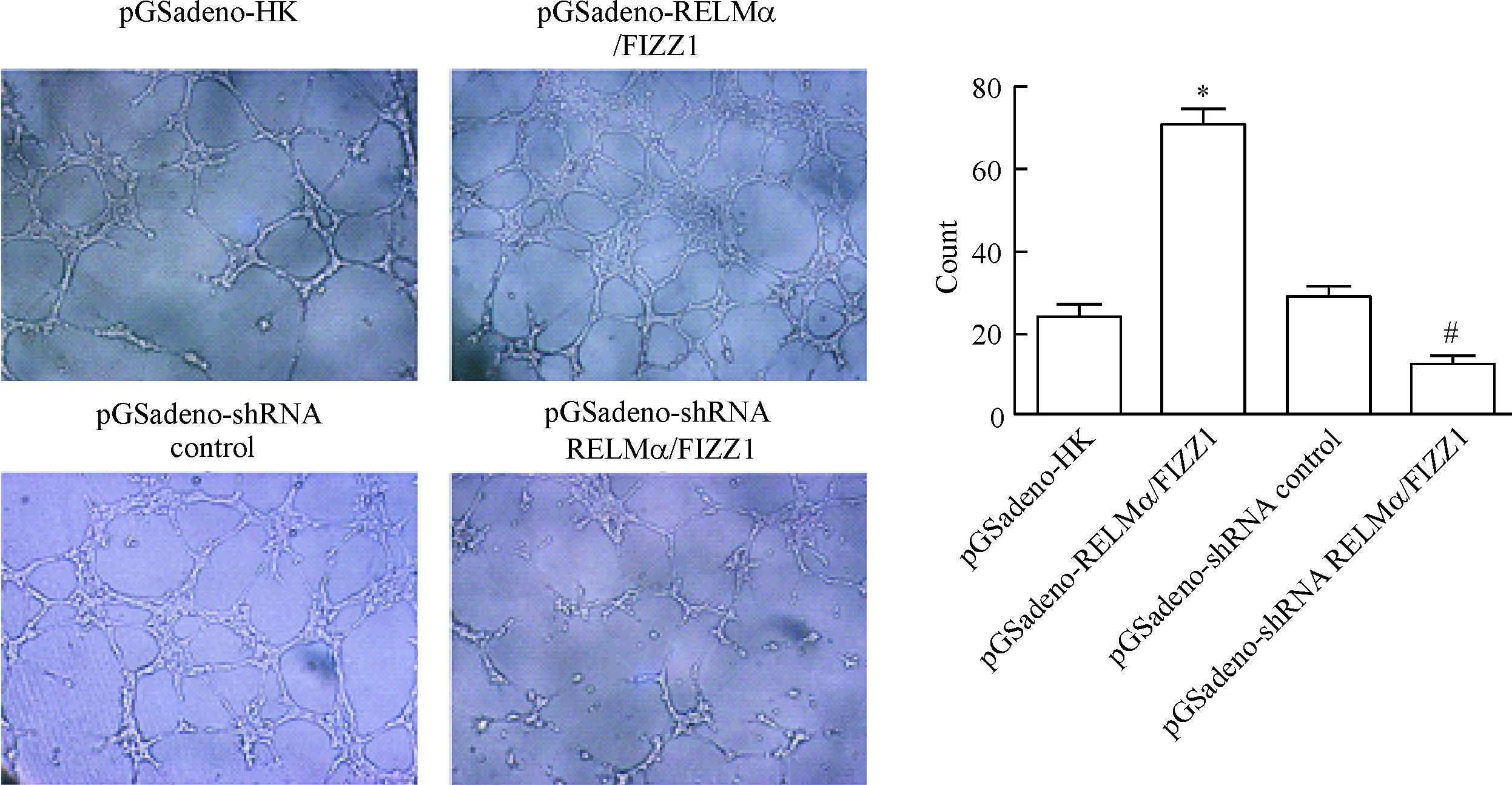
Figure 2. The angiogenesis of the MAEC (×100). Mean±SD.n=3.*P<0.05vspGSadebo-HK group#P<0.05vspGSadeno-shRNA control group.
图2MAEC的血管生成情况

Figure 3. The changes of Ca2+concentration in the MOVAS cells. Mean±SD.n=3.▲P<0.05vspGSadeno-HK group;△P<0.05vspGSadeno-shRNA control group.
图3MOVAS细胞内Ca2+浓度的变化
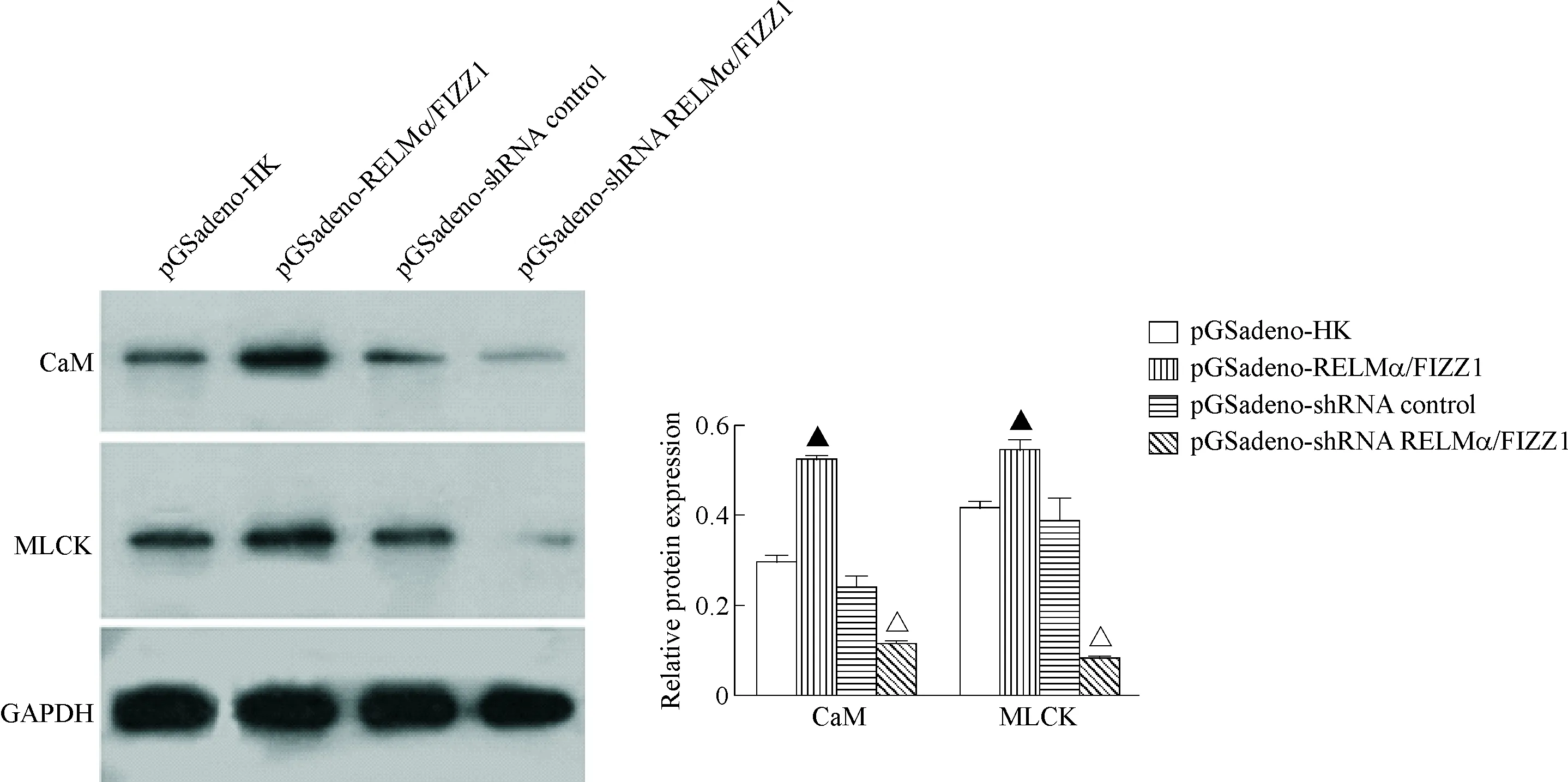
Figure 4. The effects of RELMα/FIZZ1 on the protein expression of CaM and MLCK in the MOVAS cells. Mean±SD.n=3.▲P<0.05vspGSadeno-HK group;△P<0.05vspGSadeno-shRNA control group.
图4RELMα/FIZZ1对MOVAS细胞内CaM与MLCK蛋白表达的影响

Figure 5. The effects of RELMα/FIZZ1 on the mRNA expression of CaM and MLCK in the MOVAS cells. Mean±SD.n=3.▲P<0.05vspGSadeno-HK group;△P<0.05vspGSadeno-shRNA control group.
图5RELMα/FIZZ1对MOVAS细胞内CaM与MLCKmRNA表达的影响
讨 论
易损斑块(vulnerable plaque)是动脉粥样硬化斑块(atheromatous plaque)的重要类型,是动脉血管壁上的病理性结构。斑块改变了血管壁的组织结构,使得血管管腔狭窄,血流阻力增加;血流动力学也发生改变,流体剪切力加强,血管内皮(endothelium)损伤加重;同时,斑块内包含了大量脂质和血细胞。当斑块收到较强流体剪切力的作用或血管收缩痉挛时,脆弱的被膜破裂,使得斑块内容物冲刷进入血管,形成血栓,是导致突发心脑血管事件(如心肌梗塞和脑卒中等)的关键因素[4]。易损斑块具有特别的病理性结构,斑块的管腔面是薄纤维帽(thin fibrous cap),中间是由脂质组成的坏死核心区(necro-tic core),周边浸润了大量的以巨噬细胞(macro-phage)和T细胞为主的血细胞,伴随着逐渐增强的斑块炎症反应(plaque inflammation)、正性血管重构(positive vascularremodeling)、滋养血管新生(vasa-vasorum neovascularization)和斑块内出血(intra-plaque hemorrhage)[5]。
最近研究表明,新生血管是血脂沉积斑块局部的重要通道之一,生长入斑块内具有高通透性的新生血管为斑块中脂蛋白的主要来源,致使大的纤维帽覆盖下斑块中的脂质聚集仍在进行,斑块内新生血管管壁发育不完善,容易破碎,它的临床重要性在于与斑块内出血、斑块破裂和不稳定型心绞痛高度相关[6],在易损斑块滋养血管的新生方面,局部浸润的巨噬细胞扮演了重要的角色,一方面,巨噬细胞浸润和激活,另一方面,巨噬细胞释放炎症因子启动相关信号转导通路,促进血管内皮细胞增生[7]。
FIZZ1是2000年新发现的一个与炎症相关的缺氧诱导有丝分裂因子,是运用表达序列标记数据库扫描的方法发现的一种分泌型蛋白。目前发现,缺氧、高血糖和吸烟等能刺激巨噬细胞中RELMα/FIZZ1表达,而脂多糖能下调脂肪组织中RELMα/FIZZ1表达[8-9]。研究表明,RELMα/FIZZ1能刺激肺血管平滑肌细胞和内皮细胞增殖和迁移,明显促进肺组织血管新生。Sun等[10]在检测哮喘患者肺组织内的新生血管时发现,RELMα/FIZZ1在肺血管以及巨噬细胞内明显表达,其表达强度与血管新生面积明显正相关;RELMα/FIZZ1在培养的肺微血管内皮细胞以及鼠哮喘模型体内也有类似的发现[11]。
目前国内外关于RELMα/FIZZ1蛋白在呼吸系统疾病中的研究较多,主要集中在缺氧性肺血管重构、肺纤维化、过敏性肺病及肺发育和肺动脉高压等过程中的作用。而在心血管疾病方面仅为初步研究,RELMα/FIZZ1与动脉粥样硬化进展中血管新生、血管功能与斑块易损性关系的报道甚少。本课题组首先在动脉粥样硬化斑块内证实了RELMα/FIZZ1的表达[12],利用RELMα/FIZZ1 刺激大鼠主动脉内皮细胞后,发现处理组细胞的体外血管新生数目均明显高于正常对照组,且呈剂量依赖性,明确了RELMα/FIZZ1在动脉粥样硬化进程中血管生成开关基因的地位[12-13]。
本研究结果提示,过表达RELMα/FIZZ1可显著提高MAEC的增殖能力,管腔的形成数目显著增加;干扰RELMα/FIZZ1的表达抑制MAEC的活力和管腔的形成,通过调节斑块内RELMα/FIZZ1表达,影响动脉粥样硬化斑块内血管新生,进而影响动脉粥样硬化易损斑块的进展。过表达RELMα/FIZZ1显著增高MOVAS细胞的活力和细胞内Ca2+平均荧光强度增强,细胞内CaM和MLCK蛋白和mRNA表达显著升高;干扰RELMα/FIZZ1的表达显著抑制MOVAS细胞的活力,降低细胞内Ca2+平均荧光强度,抑制CaM和MLCK 的mRNA和蛋白表达。RELMα/FIZZ1刺激血管平滑肌细胞后,可引起细胞内钙离子浓度的升高,活化CaM,与钙离子结合后,可能会引起某些通路激活,进而对动脉粥样硬化易损斑块的稳定性产生影响。
综上所述RELMα/FIZZ1信号转导通路可影响动脉粥样硬化中管腔生成的动态平衡及管腔功能,从而影响斑块易损性,对临床动脉粥样硬化易损斑块防治机制的探索和寻找新的治疗靶点均具有十分重要的意义。
[参考文献]
[1] 李国华, 李佳旻. 易损血管的诊断进展[J]. 心血管病学进展, 2010, 31(5):664-666.
[2] Schäfers M, Schober O, Hermann S. Matrix-metalloproteinases as imaging targets for inflammatory activity in atherosclerotic plaques[J]. J Nucl Med, 2010, 51(5):663-666.
[3] Chen H, Jacobson BA, Mason L, et al. FIZZ1 potentiates the carbachol-induced tracheal smooth muscle contraction[J]. Eur Respir J, 2010, 36(5):1165-1173.
[4] Arbab-Zadeh A, Fuster V. The myth of the “vulnerable plaque”: transitioning from a focus on individual lesions to atherosclerotic disease burden for coronary artery disease risk assessment[J]. J Am Coll Cardiol, 2015, 65(8):846-855.
[5] Maurovich-Horvat P, Ferencik M, Voros S, et al. Comprehensive plaque assessment by coronary CT angiography[J]. Nat Rev Cardiol, 2014, 11(7):390-402.
[6] Guaricci AI, De Santis D, Carbone M, et al. Coronary atherosclerosis assessment by coronary CT angiography in asymptomatic diabetic population: a critical systematic review of the literature and future perspectives[J]. Biomed Res Int, 2018, 2018:8927281.
[7] Chistiakov DA, Orekhov AN, Bobryshev YV. Contribution of neovascularization and intraplaque haemorrhage to atherosclerotic plaque progression and instability[J]. Acta Phy-siol, 2015, 213(3):539-553.
[8] Routley CE, Ashcroft GS. Effect of estrogen and progesterone on macrophage activation during wound healing[J]. Wound Repair Regen, 2009, 17(1):42-50.
[9] Rajala MW, Lin Y, Ranalletta M, et al. Cell type-speci-fic expression and coregulation of murine resistin and resistin-like molecule-α in adipose tissue[J]. Mol Endocrinol, 2002, 16(8):1920-1930.
[10] Sun Y, Wang J, Li H, et al. Found in inflammatory zone 1 induces angiogenesis in murine models of asthma[J]. Lung, 2008, 186(6):375-380.
[11] Yamaji-Kegan K, Su Q, Angelini DJ, et al. Hypoxia-induced mitogenic factor has proangiogenic and proinflammatory effects in the lung via VEGF and VEGF receptor-2[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 291(6):L1159-L1168.
[12] 杨永曜, 张红明, 李晓燕, 等. RELMα/FIZZ1 信号通路对载脂蛋白 E 基因敲除小鼠动脉粥样硬化斑块内血管新生的影响[J]. 中国动脉硬化杂志, 2014, 22(9): 902-906.
[13] Li X, Yang Y, Fang J. FIZZ1 could enhance the angioge-nic ability of rat aortic endothelial cells[J]. Int J Clin Exp Pathol, 2013, 6(9):1847-1853.

