长链非编码RNA TUG1和UCA1在结肠癌组织中的表达及临床意义
姚凯,朱光辉,单远洲
(上海交通大学附属第六人民医院南院 普通外科,上海 201499)
结肠癌(colon cancer)是常见的消化道恶性肿瘤,其发病率和病死率居世界第3位,严重威胁着人类健康。结肠癌的致病机制尚不明确,目前认为主要是环境因素和遗传因素综合作用的结果。近来研究发现,长链非编码RNA(long noncoding RNA,lncRNA)在恶性肿瘤的发生、发展中起重要作用[1]。对与肿瘤相关lncRNA的研究不仅有利于深入探究肿瘤发病机制,且对于疾病的诊断、治疗和预后评估有积极临床意义。尿路上皮癌相关基因1(rothelial carcinoma associated 1,UCA1)和牛磺酸上调基因1(taurine upregulated gene 1,TUG1)是两种lncRNA。近来研究[2-3]发现,UCA1和TUG1在不同癌症类型中异常表达。这两种lncRNA的异常表达均与肿瘤细胞的异常增殖、转移有关,但两者在结肠癌临床研究中的研究较少。本研分析了结肠癌肿瘤组织中UCA1和TUG1的表达情况及其与临床病理特征的关系,并探讨两者与患者预后的关系,现将结果报告如下。
1 资料与方法
1.1 一般资料
收集本院2010年1月—2014年6月外科行结肠手术治疗的185例结肠癌患者肿瘤及对应癌旁非肿瘤组织的冻存标本,其中男79例,女106例;年龄27~88岁,平均(58.94±8.1)岁;术后经病理证实均为结肠癌;根据国际抗癌联盟(UICC)2010年关于恶性肿瘤TNM分期的规定,I期患者37例,II期患者39例,III期患者44例,Ⅳ期患者65例;根据病理类型,腺癌患者133例,黏液性腺癌患者39例,其他类型患者13例;根据术后病理结果,淋巴结转移患者78例,无淋巴结转移患者107例。所有患者术后每2个月随访1次,共随访36个月。纳入标准:⑴ 均经术后病理证实;⑵ 术中完整切除肿瘤,切缘无肿瘤细胞残余;⑶ 术前未经放疗、化疗或其它肿瘤相关治疗;⑷ 所有患者性别、年龄、肿瘤部位、肿瘤大小、淋巴结转移等临床资料均完整;⑸ 所有患者术后随访资料完整。排除标准:⑴ 患其它肿瘤或有肿瘤病史;⑵ 患代谢异常性疾病;⑶ 患急性心、脑血管疾病;⑷ 肺、肝、胆、肾等重要器官发生可见占位性病变。本研究经本院伦理委员会批准。所有患者均知情同意。
1.2 主要试剂及仪器
R N A提取试剂盒购自英国I n v i t r o g e n公司;Prime Script RT试剂盒购自日本TaKaRa公司;RealQ Plus 2×Master Mix Green购自丹麦Ampliqon公司;原位杂交检测试剂盒购自丹麦Exiqon公司;原位杂交封闭液与洗涤液购自美国Roche公司;引物购自上海生工生物工程有限公司;Nanodrop仪器购自德国NanolytiK公司;Applied Biosystems StepOnePlusTM仪器购自美国ABI公司。
1.3 原位杂交(ISH)分析
采用常规方法制备肿瘤组织芯片,将组织芯片脱蜡后,于37 ℃蛋白酶k消化后,漂洗脱水,55 ℃预杂交30 min后,将探针与杂交液以1:100稀释,于37 ℃杂交过夜。洗脱玻片,加入BSA封闭30 min后,加入二抗孵育1 h。洗涤后,加入DAB工作液避光孵育10 min,镜下观察显色情况。蒸馏水洗涤终止显色后,加入苏木素复染20 s返蓝。乙醇脱水后,二甲苯处理,中性树脂封片。
采用半定量计分法,以细胞染色强度和染色细胞染色所占百分比的乘积作为阳性程度判断方法。细胞染色强度评定:无着色0分,浅黄棕色1分,棕黄色2分,棕褐色3分;染色细胞所占比例评定:<5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;两者乘积作为结果判定:0~1分阴性,2~4分弱阳性,5~8分中度阳性,9~12分强阳性。
1.4 RNA提取、DNA酶I处理和cDNA合成
采用RNA提取试剂提取组织中总RNA。使用1%琼脂糖凝胶电泳评估RNA完整性,并采用Nanodrop仪器检测RNA浓度。使用DNA酶组进行DNA酶I处理以制备无DNA的RNA,使用Prime Script RT试剂盒合成cDNA。所有操作均严格按照试剂盒说明书进行。
1.5 qRT-PCR检测
采用q R T-P C R检测U C A 1和T U G 1的相对表达。以GUSB(β-葡糖醛酸酶)基因扩增引物作为内部对照。使用RealQ Plus 2×Master Mix Green(high Rox),在Applied Biosystems StepOnePlusTM仪器上进行PCR反应。PCR循环条件包括:9 5℃ 10 min预变性,95 ℃变性15 s,lncRNA UCA1和TUG1于61 ℃、GUSB基因于60 ℃退火,75 ℃延伸15 s,共40个循环。采用2-ΔΔCt法计算相对基因表达。
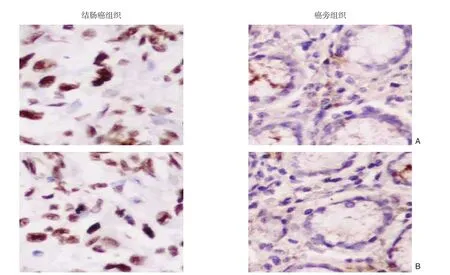
图1 免疫组化检测情况(×200) A:UCA1;B:TUG1Figure 1 Immunohistochemical staining (×200) A: UCA1; B: TUG1
1.6 统计学处理
使用Kolmogorov-Smirnov检验数据正态分布。计量资料采用平均值±标准差(±s)表示,两两比较行Student'st检验,多组比较行方差分析;使用Kaplan-Meier和Cox回归分析评估UCA1和TUG1与总体生存率之间的关系。所有数据均采用SPSS 20.0进行统计分析。P<0.05认为差异有统计学意义。
2 结 果
2.1 ISH分析UCA1和TUG1在结肠癌组织中的表达
UCA1和TUG1在肿瘤组织中的表达强度增高,胞核和胞浆中均有着色,呈褐色或棕黄色颗粒。UCA1和TUG1在结肠癌组织中的阳性表达率明显高于癌旁非肿瘤组织,差异均有统计学意义(均P<0.05)(图1)(表1)。
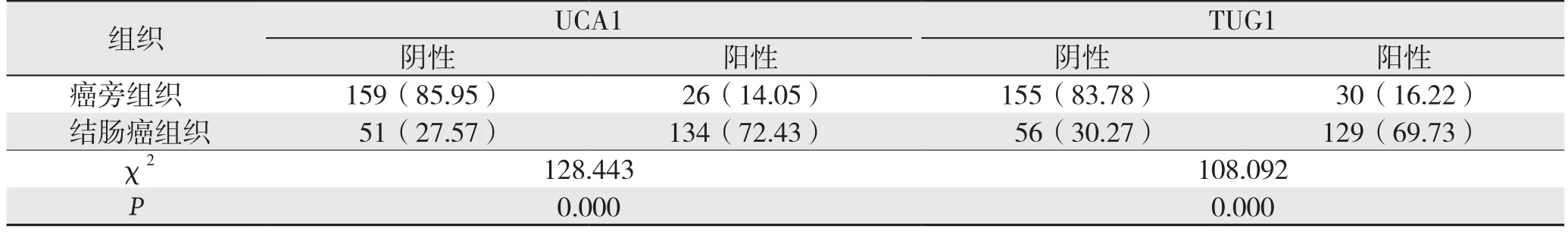
表1 UCA1和TUG1在结肠癌组织与癌旁组织中的阳性表达率比较[n=185,n(%)]Table 1 Comparison of the positive expression rates of UCA1 and TUG1 in colon cancer tissues and adjacent tissues [n=185, n (%)]
2.2 qRT-PCR分析lncRNA UCA1和TUG1在结肠癌组织中的表达
qRT-PCR测定UCA1和TUG1,熔解曲线与扩增曲线见图2。结果显示,肿瘤组织中UCA1和TUG1表达水平分别是非肿瘤组织中的2.58倍和2.34倍,均明显高于非肿瘤组织,差异均有统计学意义(t=52.415,P=0.000;t=40.502,P=0.000)。根据UCA1和TUG1表达水平的中位数对UCA1和TUG1表达进行分组,则UCA1高表达组114例,UCA1低表达组71例,高表达率61.62%(114/185);TUG1高表达组107例,TUG1低表达组78例,高表达率57.84%(107/185)。
图2 qRT-PCR检测的熔解曲线和扩增曲线 A:UCA1;B:TUG1Figure 2 Melting curves and amplif i cation curves of qRT-PCR A: UCA1; B:TUG1
2.3 UCA1和TUG1高表达与结肠癌临床病理参数的关系
UCA1和TUG1表达情况与结肠癌患者性别、年龄、病理类型无关(均P>0.05);UCA1和TUG1表达情况与肿瘤大小、淋巴结转移、分化程度、TNM分期等临床特征均有关(均P<0.05)(表2)。
2.4 UCA1表达水平与结肠癌患者预后的关系
185例结肠癌患者随访36个月,中位生存时间33.76个月,共死亡患者37例,术后总体生存率为80.0%。Kaplan-Meier生存分析显示,UCA1高表达组中死亡29例,总体生存率74.56%(HR=32.816,95%CI=31.759~33.908);UCA1低表达组中死亡8例,总体生存率88.73%(HR=35.235,95%CI=34.678~35.800),两组比较差异有统计学意义(χ2=5.419,P=0.019)。TUG1高表达组死亡27例,总体生存率74.77%(HR=32.803,95%CI=31.726~33.917);TUG1低表达组死亡10例,总体生存率87.18%(HR=35.188,95%CI=34.654~35.730),差异有统计学意义(χ2=4.345,P=0.037)(图3)。
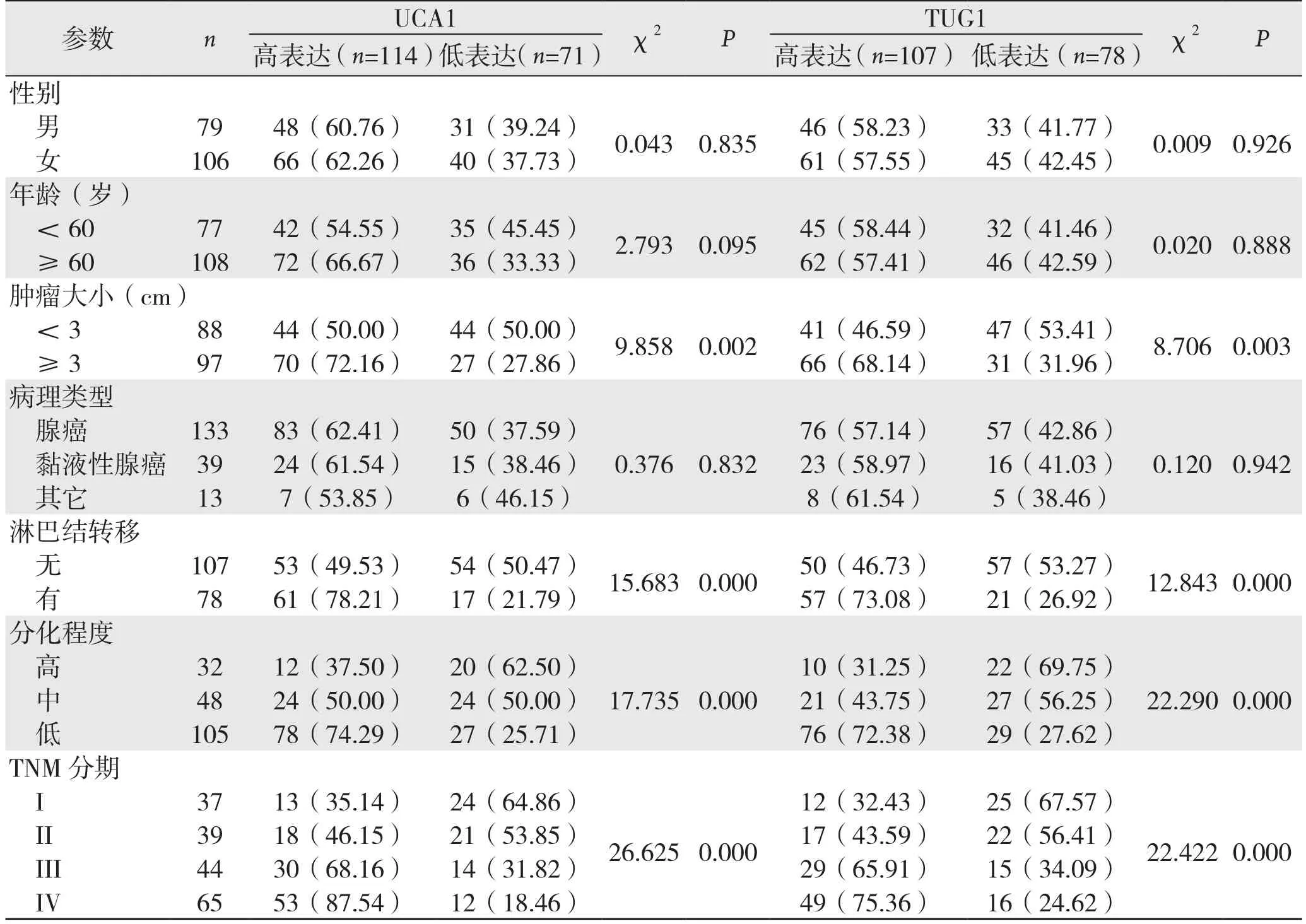
表2 UCA1和TUG1表达与结肠癌临床病理参数的关系[n(%)]Table 2 Relations of UCA1 and TUG1 expressions with the clinicopathologic factors of colon cancer [n (%)]
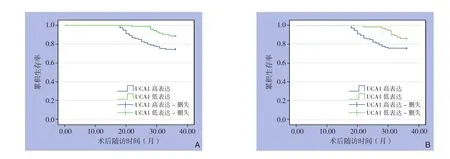
图3 患者生存曲线 A:不同UCA1表达状态;B:不同TUG1表达状态Figure 3 Survival curves of the patients A: Different UCA1 expressions; B: Different TUG1 expressions
2.5 影响结肠癌患者预后的单因素和多因素Cox回归分析
采用Cox比例风险回归模型进行结肠癌患者预后的单因素和多因素生存分析。单因素分析结果显示,肿瘤大小、淋巴结转移、分化程度、TNM分期、UCA1表达和TUG1表达均是影响结肠癌患者术后复发的影响因素(均P<0.05)。对单因素分析有统计学意义的因素纳入多因素分析,结果显示,淋巴结转移、UCA1表达和TUG1表达是结肠癌患者预后的独立危险因素(均P<0.05)(表3)。
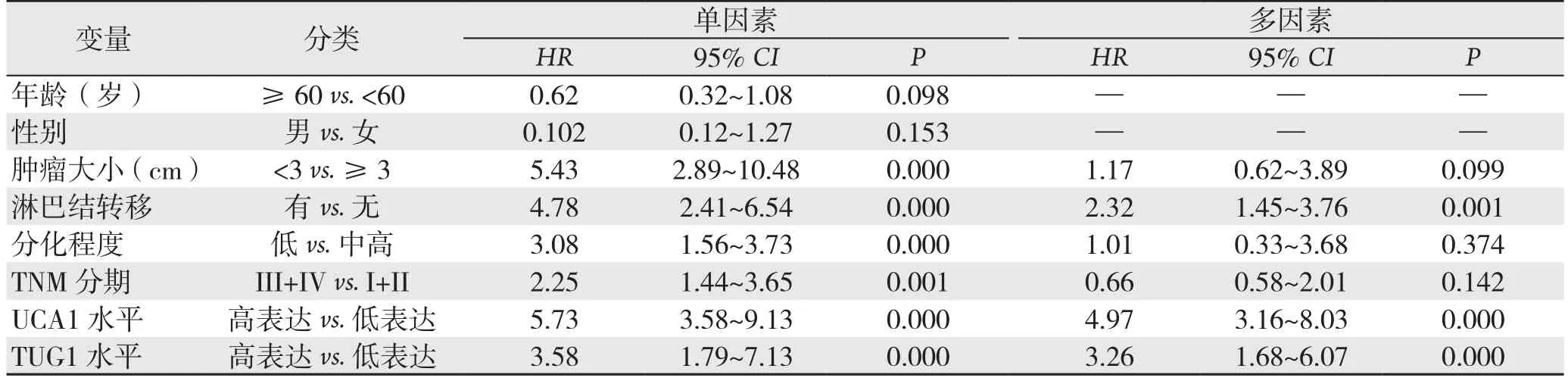
表3 影响结肠癌患者预后的单因素和多因素Cox分析Table 3 Univariate and multivariate Cox analysis for inf l uential factors for prognosis of colon cancer patients
3 讨 论
近来研究[4]发现,lncRNA作为调控者发挥基因调控、表观遗传调控、转录、mRNA剪接和翻译等多种生物学功能,尤其是在恶性肿瘤的发生、发展中起重要作用。
UCA1是一种lncRNA,定位于染色体19q13.1上,在胚胎、胎儿膀胱等组织中高表达。在膀胱癌、非小细胞肺癌、食管鳞状细胞癌、卵巢癌、肝细胞癌等多种恶性癌症中均观察到UCA1表达的上调[5]。胶质瘤组织和细胞系中报道了UCA1表达的上调促进肿瘤细胞增殖,从而参与癌症的发生进展[6]。TUG1是另一种lncRNA,位于人染色体22q12.2上,在人类各组织细胞中广泛表达。研究[7]发现,TUG1在膀胱尿路上皮癌中过表达,并促进细胞增殖、抑制细胞凋亡。与此一致,TUG1在食管鳞状细胞癌中表现出类似的高表达和促肿瘤效应,且TUG1高表达促进肿瘤细胞迁移[8]。然而,在其他类型的癌症,如非小细胞肺癌中观察到TUG1表达下调,且其表达水平的增加能够抑制细胞增殖并诱导细胞凋亡[9]。提示,TUG1表达具有癌症类型特异性。钱海等[10]发现,TUG1在肠癌细胞系中过表达,且能够促进肠癌细胞的增殖和侵袭能力。本研究发现,UCA1和TUG1在结肠癌组织中的表达水平显著增加,与过往研究一致[11-12]。提示UCA1和TUG1在结肠癌中均发挥促肿瘤效应,其表达的上调可能在结肠癌的发生、发展过程中起重要作用。
本研究进一步分析lncRNA UCA1、TUG1与结肠癌患者临床病理特征的关系发现,UCA1和TUG1与肿瘤大小有关,提示UCA1、TUG1表达的上调可能促进肿瘤细胞增殖、抑制细胞凋亡,从而参与肿瘤生长;UCA1、TUG1表达与淋巴结转移有关,提示UCA1和TUG1表达的上调可能促进肿瘤细胞迁移、侵袭,引起肿瘤转移。另外,UCA1和TUG1表达与肿瘤分化程度、TNM分期均有关,提示UCA1和TUG1表达的上调可能与疾病的恶性进展有关。尽管UCA1和TUG1在结肠癌发生发展中的作用尚不明确,但有研究[13]报道,UCA1能够加速细胞周期进程,促进细胞增殖,并抑制结直肠癌细胞凋亡。UCA1上调导致细胞周期蛋白D1过表达,从而促进细胞周期进程[14]。研究显示,UCA1通过与异质核核糖核蛋白I相互作用来影响p27并抑制p27蛋白表达,从而增加乳腺癌细胞增殖,促进肿瘤生长[15]。近来研究[16]发现,UCA1通过促进肿瘤转移中最重要的早期步骤——上皮间质转化(EMT)过程,促进胃癌肿瘤细胞的迁移和侵袭。据报道[17],UCA1通过激活PI3K/AKT途径中的AKT激酶,使CREB(cAMP应答元件结合蛋白)转录因子活化,从而参与癌症的发生、进展过程。另外,Yunbo等[18]发现,TUG1过表达能够激活PI3K-AKT途径或AKT途径,从而促进肿瘤细胞增殖、生长、迁移和血管生成。Hongwei等[19]发现,TUG1通过调控miR-145/ZEB1信号通路,从而促进肿瘤细胞增殖、迁移和侵袭。这些研究提示,UCA1和TUG1能通过多种调控途径参与肿瘤细胞增殖、迁移、侵袭和凋亡调控,与发生、进展及转移过程密切相关,它们在结肠癌中的致癌功能提示其可能作为癌症治疗的有效治疗靶点。然而,UCA1和TUG1在结肠癌发生进展过程中的具体机制还有待深入探究。
肿瘤的复发和转移,是结肠癌患者术后预后不良的主要原因,约40%~50%的结肠癌患者由于术后复发或转移而死亡[20-24]。因此,探寻疾病相关预后评价指标及新的治疗靶点,对改善结肠癌的临床治疗效果,提高患者生存率具有十分积极的意义。本研究采用Kaplan-Meier分析评估UCA1和TUG1对结肠癌患者预后的影响发现,UCA1和TUG1高表达患者总体生存率明显低于低表达患者。进一步进行Cox比例风险回归模型分析发现,UCA1和TUG1高表达与结肠癌患者预后有关,是影响结肠癌患者预后的独立危险因素。提示,肿瘤来源的UCA1和TUG1可以作为结肠癌患者预后的生物标记和潜在治疗靶标。
然而,本研究尚存在许多不足。首先,本研究所纳入样本量较少,且以临床病理和随访资料均完整者作为研究对象,导致患者3年病死率与流行病学大数据存在一定偏差。其次,本研究仅以已知的两个在肿瘤组织中差异性表达的典型UCA1和TUG1作为变量,分析与结肠癌预后的关系。在后续研究中,还需扩大样本量,并补充更多相关lncRNA,以明确lncRNA与结肠癌发生风险及死亡风险中的关系。
综上所述,UCA1和TUG1在结肠癌肿瘤组织中表达上调,与肿瘤大小、浸润深度、分化程度和TNM分期有关,UCA1和TUG1是影响结肠癌患者预后的独立危险因素。因此,探究lncRNA在结肠癌的发生进展中的作用,对开发新型靶向治疗方式及预后监管具有重要临床意义。
[1]孙伟. 长链非编码RNA与泌尿系统恶性肿瘤研究进展[J]. 国际泌尿系统杂志, 2013, 33(4):507–511. doi:10.3760/cma.j.issn.1673–4416.2013.04.026.Sun W. Research progress of long noncoding RNAs in malignant tumors of the urinary system[J]. International Journal of Urology and Nephrology, 2013, 33(4):507–511. doi:10.3760/cma.j.issn.1673–4416.2013.04.026.
[2]李志强, 邹瑞, 欧阳可雄, 等. 牛磺酸上调基因1在舌鳞状细胞癌中的作用研究[J]. 口腔疾病防治, 2016, 24(9):511–514.doi:10.12016/j.issn.2096–1456.2016.09.003.Li ZQ, Zou R, Ouyang KX, et al. Study on the role of long noncoding RNA TUG1 in tongue squamous cell carcinoma[J].Journal of Dental Prevention & Treatment, 2016, 24(9):511–514.doi:10.12016/j.issn.2096–1456.2016.09.003.
[3]熊乐, 卢婍, 刘安文. 长链非编码RNA TUG1在恶性肿瘤中的研究进展[J].临床与实验病理学杂志,2017,33(4):425–428.DOI:10.13315/j.cnki.cjcep.2017.04.016.Xiong L, Lu Q, Liu AW. Research progress of long noncoding RNA in malignant tumors[J]. Chinese Journal of Clinical and Experimental Pathology, 2017, 33(4):425–428.
[4]胡亮, 侯敢, 黄迪南. 长链非编码RNA与表观遗传调控[J]. 基因组学与应用生物学, 2016, 35(12):3319–3324.Hu L, Hou G, Huang DN. Long Non-coding RNAs and Epigenetic Regulation[J]. Genomics and Applied Biology, 2016, 35(12):3319–3324.
[5]Tao K, Yang J, Hu Y, et al. Clinical significance of urothelial carcinoma associated 1 in colon cancer[J]. Int J Clin Exp Med,2015, 8(11):21854–21860.
[6]He Z, Wang Y, Huang G, et al. The lncRNA UCA1 interacts with miR-182 to modulate glioma proliferation and migration by targeting iASPP[J]. Arch Biochem Biophys, 2017, 623/624:1–8.doi: 10.1016/j.abb.2017.01.013.
[7]Han Y, Liu Y, Gui Y, et al. Long intergenic non-coding RNA TUG1 is overexpressed in urothelial carcinoma of the bladder[J]. J Surg Oncol, 2013, 107(5):555–559. doi: 10.1002/jso.23264.
[8]Xu Y, Wang J, Qiu M, et al. Upregulation of the long noncoding RNA TUG1 promotes proliferation and migration of esophageal squamous cell carcinoma[J]. Tumour Biol, 2015, 36(3):1643–1651.doi: 10.1007/s13277–014–2763–6.
[9]Zhang EB, Yin DD, Sun M, et al. P53-regulated long non-coding RNA TUG1 affects cell proliferation in human non-small cell lung cancer, partly through epigenetically regulating HOXB7 expression[J]. Cell Death Dis, 2014, 5:e1243. doi: 10.1038/cddis.2014.201.
[10]钱海, 谢平, 谈振华, 等. 小干扰RNA下调长链非编码RNA TUG1表达对肠癌细胞LoVo增殖、迁移能力的影响[J]. 中华实验外科杂志, 2017, 34(5):889. doi:10.3760/cma.j.issn.1001–9030.2017.05.055.Qian H, Xie P, Tan ZH, et al. Down regulation TUG1 in LoVo colorectal cancer cells and its affection on cell proliferation and migration[J]. Chinese Journal of Experimental Surgery, 2017,34(5):889. doi:10.3760/cma.j.issn.1001–9030.2017.05.055.
[11]宋凤玲. LncRNA UCA1对细胞自噬和结肠癌细胞增殖凋亡的影响[D]. 武汉:华中农业大学, 2017:1–64.Song FL. The effect of LncRNA UCA1 on cell autophagy and colon cancer cell proliferation apoptosis[D]. Wuhan: Huazhong Agricultural University, 2017:1–64.
[12]宋智海. 长链非编码RNA TUG1、GAS5在结直肠癌组织中表达差异的研究[D]. 石家庄: 河北医科大学, 2013:1–39.Song ZH. The expression and signif i cance of IncRNA TUG1 and GAS5 in human colorectal cancer[D]. Shijiazhuang: Hebei Medical University, 2013:1–39.
[13]Han Y, Yang YN, Yuan HH, et al. UCA1, a long non-coding RNA up-regulated in colorectal cancer influences cell proliferation,apoptosis and cell cycle distribution[J]. Pathology, 2014, 46(5):396–401. doi: 10.1097/PAT.0000000000000125.
[14]Wang ZQ, Cai Q, Hu L, et al. Long noncoding RNA UCA1 induced by SP1 promotes cell proliferation via recruiting EZH2 and activating AKT pathway in gastric cancer[J]. Cell Death Dis, 2017,8(6):e2839. doi: 10.1038/cddis.2017.143.
[15]Huang J, Zhou N, Watabe K, et al. Long non-coding RNA UCA1 promotes breast tumor growth by suppression of p27 (Kip1)[J]. Cell Death Dis, 2014, 5:e1008. doi: 10.1038/cddis.2013.541.
[16]Zuo ZK, Gong Y, Chen XH, et al. TGFβ1-Induced LncRNA UCA1 Upregulation Promotes Gastric Cancer Invasion and Migration[J].DNA Cell Biol, 2017, 36(2):159–167. doi: 10.1089/dna.2016.3553.
[17]Yang C, Li X, Wang Y, et al. Long non-coding RNA UCA1 regulated cell cycle distribution via CREB through PI3-K dependent pathway in bladder carcinoma cells[J]. Gene, 2012, 496(1):8–16.doi: 10.1016/j.gene.2012.01.012.
[18]Yunbo F, Xiaopo L, Xiaoli L, et al. LncRNA TUG1 is upregulated and promotes cell proliferation in osteosarcoma[J]. Open Med(Wars), 2016, 11(1):163–167. doi: 10.1515/med-2016–0031.
[19]Lei H, Gao Y, Xu X. LncRNA TUG1 inf l uences papillary thyroid cancer cell proliferation, migration and EMT formation through targeting miR-145 [J]. Acta Biochim Biophys Sin (Shanghai), 2017,49(7):588–597. doi: 10.1093/abbs/gmx047.
[20]刘建军, 魏寿江. 结肠癌术后肿瘤复发转移的影响因素及远期预后观察[J]. 中国现代普通外科进展, 2017, 20(1):69–70.doi:10.3969/j.issn.1009–9905.2017.01.023.Liu JJ, Wei SJ. Influential factors for postoperative recurrence and metastasis of colon cancer and observation of longterm outcomes[J]. Chinese Journal of Current Advances in General Surgery, 2017, 20(1):69–70. doi:10.3969/j.issn.1009–9905.2017.01.023.
[21]秦颖, 张海涛, 文剑锋, 等. 进展期结肠癌根治术后复发转移的危险因素探讨[J]. 中国普通外科杂志, 2017, 26(10):1352–1355.doi:10.3978/j.issn.1005–6947.2017.10.021.Qin Y, Zhang HT, Wen JF, et al. Discussion of risk factors for recurrence and metastasis after radical resection of advanced colon cancer[J]. Chinese Journal of General Surgery, 2017, 26(10):1352–1355. doi:10.3978/j.issn.1005–6947.2017.10.021.
[22]吴坤远, 黄祖东, 刘美芳. II、III期结肠癌根治术后肿瘤复发转移情况及其危险因素[J]. 国际老年医学杂志, 2017, 38(1):25–27.doi:10.3969/j.issn.1674–7593.2017.01.008.Wu KY, Huang ZD, Liu MF. The Risk Factors of Tumor Metastasis and Recurrence in Stage II or III Colon Cancer after Radical Operation[J]. International Journal of Geriatrics, 2017, 38(1):25–27.doi:10.3969/j.issn.1674–7593.2017.01.008.
[23]单思洋, 王建伟. 结直肠癌肝转移术后的早期复发[J]. 临床普外科电子杂志, 2017, 5(2):43–46.Shan SY, Wang JW. Early postoperative recurrence of colorectal cancer with liver metastases[J]. Journal of General Surgery for Clinicians: Electronic Version, 2017, 5(2):43–46.
[24]沈乃营, 张天政, 刘昌, 等. 腹腔镜结肠癌根治术对早期结肠癌术后近期复发的影响[J]. 中国现代普通外科进展, 2017, 20(6):435–439. doi:10.3969/j.issn.1009–9905.2017.06.004.Shen NY, Zhang TZ, Liu C, et al. Effect of short-term recurrence of early stage colon cancer by laparoscopic colon cancer radical[J].Chinese Journal of Current Advances in General Surgery, 2017,20(6):435–439. doi:10.3969/j.issn.1009–9905.2017.06.004.

