胃镜活检病理为高级别上皮内瘤变的外科精准治疗
苏昭然 ,王贤,束宽山 ,郑明,方志恒 ,邢益祥,王贵和
(安徽省铜陵市人民医院 1. 胃肠外科 2. 内镜中心 3. 病理科,安徽 铜陵 244000)
胃高级别上皮内瘤变(h i g h g r a d e intraepithelial neoplasia,HGIN)是指胃黏膜上皮组织结构和细胞学异常扩展至胃黏膜上皮层的上半部乃至全层[1]。2002年WHO维也纳共识对胃HGIN定义做出修订,将原位癌和部分病理诊断浸润情况不明的情况也归入其中[2]。鉴于近年来我国消化内镜、病理诊断整体水平的提升,胃镜病变活检诊断HGIN的病例呈逐年大幅上升趋势。然而诸多临床研究已证实,胃镜活检病理的HGIN诊断往往不能准确的反应病变的整体病理情况[3-5],因此该类患者的治疗决策往往极为棘手。本文就笔者团队近年对于该类患者的临床治疗体会和研究结果报告如下。
1 资料与方法
1.1 临床资料
回顾性分析2014年1月—2017年9月铜陵市人民医院胃肠外科收治胃内病变首次胃镜活检病理为HGIN患者共70例。本组患者均接受根治性手术和/或内镜下治疗后取得完整病变的组织学病理。患者一般情况详见表1。
1.2 术前检查
术前常规进行血常规、血生化、凝血功能、肿瘤标志物等血液学检查以及心电图和全胸片检查并进行营养状态评估。内镜及影像学检查:所有患者入院后常规进行胃镜及超声胃镜检查,评估病灶的大小,大体分型,测量病灶口侧缘距离齿状线的距离,并采用超声内镜技术(EUS)评估病灶的浸润深度。病灶大体分型采用日本内窥镜学会规定的早期胃癌大体分型方案。患者饮水1 000 mL后行胃增强CT检查,了解病灶是否存在浆膜侵犯,是否存在远处转移,胃周及腹主动脉旁是否存在肿大淋巴结。EUS及CT显示淋巴结最长径>0.8 cm视为淋巴结肿大。

表1 70例胃镜活检诊断HGIN患者的一般资料Table 1 General data of the 70 patients diagnosed as HGIN by endoscopic biopsy
1.3 外科手术治疗
本组患者手术治疗由一组外科治疗手术医师完成,标准术式根据病灶口侧缘至齿状线的距离选择传统开腹/腹腔镜辅助根治性近/远端胃或全胃切除除联合D2淋巴结清扫术(图1),D2淋巴结清顺序及扫范围定义参照参考文献6。标准的消化道重建方法为:远端胃切除后采用BI或cut/uncut Roux-en-Y吻合;全胃切除后行Roux-en-Y吻合。

图1 腹腔镜辅助胃癌根治术D2淋巴结清扫Figure 1 Laparoscopic assisted radical gastrectomy with D2 lymph node dissection
1.4 内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)
单人操作电子胃镜至病变部位。采用APC氩离子凝固器于病灶边缘0.5 cm外进行电凝标记1圈,确定切除区域。使用亚甲蓝染色溶液于病灶边缘标记点外侧进行多点黏膜下注射,抬举病灶,沿标记点外用钩形刀切开病变周围胃黏膜组织。采用针刀或IT刀于病灶下方沿黏膜下层与肌层之间的疏松组织间隙进行剥离。采用喷射凝固或者钛夹关闭方式进行创面止血(图2)。
1.5 术中及术后病理
术中及术后病理常规同一组病理医师完成。ESD病理标本固定4周后进行术中冷冻检查,评估病变类型、平面/深面切缘以及浸润深度。术后病理常规包括HE染色剂免疫组化等,进一步明确病变类型,并评估神经、脉管有无侵犯。
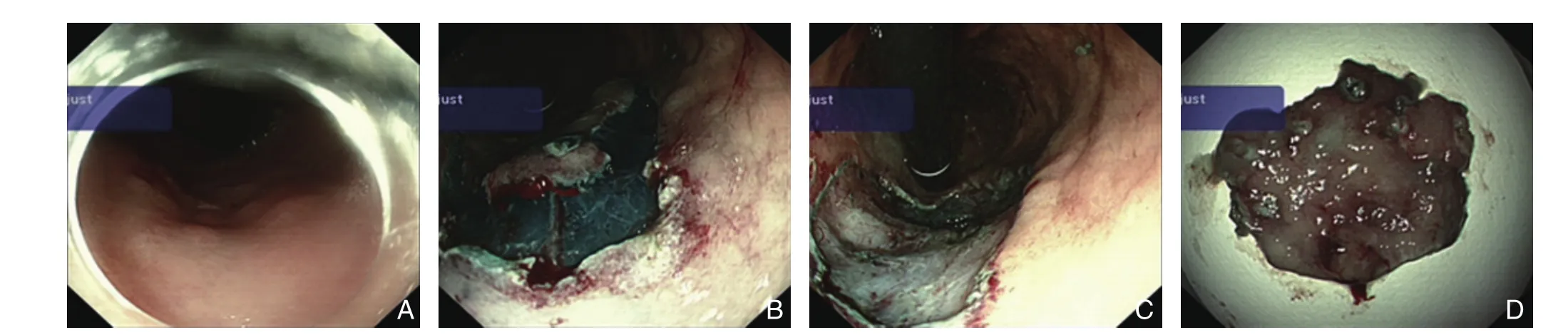
图2 ESD剥离胃黏膜病变送快速冷冻病理检查Figure 2 ESD of gastric mucosal lesions for rapid frozen pathological examination
1.6 统计学处理
采用SPSS 19.0统计软件进行统计学分析,连续变量计量资料结果采用均数±标准差(±s)表示,采用t检验比较组间差异,分类变量的组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 临床治疗及短期预后
本组22例患者接受了开腹/腹腔镜根治性远端胃切除术,39例患者接受了开腹/腹腔镜根治性全胃切除术,1例根治性近端胃切除术,7例患者接受治愈性ESD治疗,1例患者接受ESD术中冷冻病理为腺癌且不符合治愈性标准术中中转腹腔镜下根治性全胃切除术。本组患者术后均恢复良好康复出院,术后中位住院时间11 d。患者术后均无术后出血、吻合口瘘、腹腔内感染、肠梗阻等严重并发症的发生。
2.2 术后病理结果
本组所有患者均通过手术治疗及内镜治疗获得了完整病灶的病理诊断,7例患者术后病理维持HGIN的诊断,3例为低级别上皮内瘤变(low grade intraepithelial neoplasia,LGIN)及黏膜慢性炎,1例术后病理诊断为弥漫性大B细胞淋巴瘤,其余59例术后病理均诊断为腺癌,其中高/中分化37例,低/未分化22例。其中早期胃癌(pT1)27例,进展期胃癌32例。59例术后病理诊断胃癌患者中2例接受了ESD根治性治疗,其余患者接受直接手术治疗或ESD中转手术治疗。接受手术治疗的胃癌患者中有15例存在淋巴结转移。
2.3 病变整体与胃镜活检病理差异危险因素分析
根据ESD或手术切除后病理是否高于胃镜活检病理将患者分为两组,其中未过低诊断组(术后病理维持HGIN、LGIN以及黏膜慢性炎)10例,过低诊断组(术后病理诊断腺癌及淋巴瘤)60例,采用单因素分析方法研究活检与完整病理存在差异的临床特征,结果发现年龄、EUS评估黏膜下层侵犯可疑、胃周淋巴结肿大的比率在两组间存在统计学差异(均P<0.05)(表2)。

表2 胃镜活检与术后病理差异因素的单变量分析Table 2 Univariate analysis of factors for difference between endoscopic biopsy and postoperative pathological examination
2.4 活检HGIN的决策树
近年来随着腹腔镜腔镜及内镜治疗技术水平的进步,在近年来笔者团队制定了基于内镜下诊断、影像学评估和CEA血清水平等临床特征的决策树(表3),以用于胃内病变活检病理诊断为高瘤变患者的治疗方案制定,本研究的后期病例的治疗方式决策均遵循该决策树。

表3 胃内病变活检病理诊断为HGIN患者的治疗决策树 注:1)腹部双期增强CT及EUS检查见胃周淋巴结最长径>0.8 cm;2)对于病变高度疑似浸润、合并深大溃疡以及黏膜下注射隆起困难的病变,ESD术中不必过度追求完整切除,可作为病变大块活检技术以提供明确病理诊断;3)病灶≤2 cm的分化型黏膜内癌,不合并溃疡,切缘净,无脉管侵犯;4)术中快速病理仍然诊断HGIN但切缘不净时可以继续扩大ESD切缘直至切缘干净Table 3 Decision tree for treatment of HGIN diagnosed by endoscopic biopsy Note: 1) Abdominal dual-phase contrast-enhanced CT and EUS showing the longest diameter of the perigastric lymph node >0.8 cm; 2) For lesions highly suspicious for invasion and with deep ulcers or no swelling after submucosal injection, excessive pursuit for complete resection is not recommended, and en bloc biopsy can be performed for def i nite diagnosis; 3) Intramucosal carcinoma less than 2 cm, with clear surgical margins and on complicated ulcer and no vascular invasion; 4) For lesions still diagnosed as HGIN by intraoperative fast pathological examination, with unclear surgical margin, extended ESD scope can be made until achievement of the clear surgical margins
3 讨 论
目前慢性胃炎→萎缩性胃炎→肠上皮化生→HGIN→胃癌这一疾病发生发展模式已被广泛认可。胃黏膜上皮异型增生与胃癌的发病具有密切相关性,是公认的重要癌前期病变[7-9]。相关研究[10-12]发现HGIN患者若不予以临床干预,35%~78%的患者将进展为胃癌。因此2002年WTO的维也纳共识中明确提出对于这类患者必须予以包括手术切除或内镜切除在内的外科干预治疗[2]。
胃镜活检病理检查是目前诊断胃黏膜病变的最主要手段。而近年来国内外大量的临床回顾[13-14]发现胃镜活检病理结果往往并不能准确的反应胃黏膜病变的整体病理。国外众多研究[15-17]发现16%~90%胃镜活检病理诊断HGIN的胃黏膜病变其实发展至到胃癌的程度。在本研究中,56例患者的只有12%的患者术后病理维持HGIN的诊断,其余患者术后病理均有差异,其中23例患者已发展至进展期胃癌、11例患者甚至合并有淋巴结转移。其原因主要是由于中国目前对于胃癌的诊断基本均遵循欧美国家的标准,即镜下必须观察到浸润现象(细胞异性增生突破固有膜)时才能做出癌的诊断。这就导致一旦活检组织较浅,未取到合适的黏膜肌层,或黏膜肌层已被完全破坏无法明确辨识,胃癌患者的活检病理镜下不能发现明确的浸润现象时,而只能做出HGIN的诊断。
由于胃镜活检病理和病变整体病理较高的差异率,使得这类患者的临床治疗决策极为棘手:临床治疗不足时,可能导致胃癌患者不能得到根治性治疗,而治疗过度时可能造成HGIN患者不必要的器官损失。笔者团队基于近年来胃癌腹腔镜手术技术、内镜治疗技术的进展和HGIN患者诊疗经验的积累制定了一个该类患者治疗决策树,以避免以上情况的发生。基于目前腹腔镜下远端胃切除较小的手术创伤,良好的近期预后和远期生活质量[18-22],笔者认为病变位于胃的中下部预计远端胃切除即可以保证切缘,且合并EUS怀疑黏膜下层浸润、胃周淋巴结肿大或病变合并溃疡等差异高危临床特征的患者,可直接行腹腔镜下远端胃切除,即使术后病理仍然维持HGIN的诊断,仍然可以接受,并同时避免病理差异高危患者ESD治疗后再次追加手术的治疗经济花费,减少患者痛苦。在本研究中,虽然单因素分析未发现术前血清CEA水平在两组患者间存在统计学差异,但考虑该指标对于胃癌诊断敏感性已被众多学者[23-25]所公认,因此在笔者研究单位中目前亦被作为胃镜病理诊断HGIN患者直接行远端胃切除的重要决策指标。
由于近端胃、全胃切除术后患者常合并营养不良、贫血、反流性食管炎等诸多影响患者生存质量的远期并发症,笔者认为对于HGIN的患者实施该类手术应视为过度治疗。因此本决策树中对于病变位于胃体上部、贲门的患者,无论患者存在整体病理存在差异的高危临床特征,均不应贸然实施手术。近年来随着内镜治疗技术的进展,ESD成为该类患者较好的临床治疗方法[15]。对于HGIN和部分早期胃癌患者,ESD不仅可以明确病理诊断亦可作为根治性治疗手段[26]。而对于不符合内镜治愈标准的胃癌患者,ESD提供的深达肌层的大块活检组织亦可以帮助明确病理诊断,为后续的手术治疗提供依据。其对于有经验的治疗团队,手术治疗的追加可以在ESD术中冷冻结果后同期进行。
本研究首次对胃镜病理活检诊断为HGIN患者的治疗决策进行了初步探索,但亦存纳入样本量较少的问题,其研究结果可为大样本量多中心的深入研究提供帮助。
[1]高泽立, 张成, 盛飞英, 等. 胃黏膜肠上皮化生、胃上皮内瘤变与胃癌的组织发生[J]. 世界华人消化杂志, 2011, 19(19):1981–1984.Gao ZL, Zhang C, Sheng FY, et al. Intestinal metaplasia,intraepithelial neoplasia and gastric carcinogenesis[J]. World Chinese Journal of Digestology, 2011, 19(19):1981–1984.
[2]Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited[J]. Gut, 2002, 51(1):130–131.
[3]孙学工, 束宽山, 苏昭然. 胃镜活检高级别上皮内瘤变19例临床分析[J]. 安徽医药, 2014, 18(8):1515–1516. doi:10.3969/j.issn.1009–6469.2014.08.037.Sun XG, Shu KS, Su ZR. Gastroscope biopsy high-grade intraepithelial neoplasia:A clinical analysis of 19 cases[J]. Anhui Medical and Pharmaceutical Journal, 2014, 18(8):1515–1516.doi:10.3969/j.issn.1009–6469.2014.08.037.
[4]Kim CG. Tissue acquisition in gastric epithelial tumor prior to endoscopic resection[J]. Clin Endosc, 2013, 46(5):436–440. doi:10.5946/ce.2013.46.5.436.
[5]Lim H, Jung HY, Park YS, et al. Discrepancy between endoscopic forceps biopsy and endoscopic resection in gastric epithelial neoplasia[J]. Surg Endosc, 2014, 28(4):1256–1262. doi: 10.1007/s00464–013–3316–6.
[6]Wang C, Wang G, Su Z, et al. Laparoscopy-Assisted D2 Radical Gastrectomy for Advanced Gastric Cancer[J].Hepatogastroenterology, 2015, 62(139):758–761.
[7]李庆芝, 庄天彦. 窄带成像技术对胃黏膜高级别上皮内瘤变患者临床疗效的影响[J]. 中国内镜杂志, 2017, 23(3):74–78.doi:10.3969/j.issn.1007–1989.2017.03.014.Li QZ, Zhuang TY. Effect of narrow band imaging on the clinical efficacy of high grade gastric mucosal epithelial neoplasia[J].China Journal of Endoscopy, 2017, 23(3):74–78. doi:10.3969/j.issn.1007–1989.2017.03.014.
[8]潘静琳, 刘凤斌. 转化医学背景下慢性萎缩性胃炎的中药复方药效物质基础研究现状与思路[J]. 现代中医临床, 2017,24(6):23–26. doi:10.3969/j.issn.2095–6606.2017.06.006.Pan JL, Liu FB. Research status and strategy of the pharmacodynamics basis of Chinese herbal compound for chronic atrophic gastritis under background of translational medicine[J]. Journal of Beijing University of Traditional Chinese Medicine: Clinical Medicine, 2017, 24(6):23–26. doi:10.3969/j.issn.2095–6606.2017.06.006.
[9]夏靖媛, 纪小龙. 胃超高分化腺癌与胃黏膜高级别上皮内瘤变的鉴别诊断(附三例报告)[J]. 临床误诊误治, 2017, 30(3):12–14.doi:10.3969/j.issn.1002–3429.2017.03.005.Xia JY, Ji XL. Differential diagnosis between welldifferentiated adenocarcinoma and high-grade intraepithelial neoplasia of the stomach (a report of 3 cases)[J]. Clinical Misdiagnosis & Mistherapy, 2017, 30(3):12–14. doi:10.3969/j.issn.1002–3429.2017.03.005.
[10]Yamada H, Ikegami M, Shimoda T, et al. Long-term followup study of gastric adenoma/dysplasia[J]. Endoscopy, 2004,36(6):390–396.
[11]Park SY, Jeon SW, Jung MK, et al. Long-term follow-up study of gastric intraepithelial neoplasias: progression from low-grade dysplasia to invasive carcinoma[J]. Eur J Gastroenterol Hepatol, 2008, 20(10):966–970. doi: 10.1097/MEG.0b013e3283013d58.
[12]Rugge M, Cassaro M, Di Mario F, et al. The long term outcome of gastric non-invasive neoplasia[J]. Gut, 2003, 52(8):1111–1116.
[13]吴爱荣, 范月娟, 王超, 等. 胃黏膜高级别上皮内瘤变内镜下形态与术后病理结果的比较研究[J]. 中国内镜杂志, 2015,21(12):1320–1323.Wu AR, Fan YJ, Wang C, et al. Endoscopic morphological features and surgical pathological results analysis of gastric mucosa high grade intraepithelial neoplasia[J]. China Journal of Endoscopy, 2015, 21(12):1320–1323.
[14]汤胜君, 曹彬, 张元瑞, 等. 胃黏膜活检诊断高级别上皮内瘤变与胃镜下形态特征及术后病理的对比分析[J]. 现代消化及介入诊疗, 2015, 20(1):9–11. doi:10.3969/j.issn.1672– 2159.2015.01.003.Tang SJ, Cao B, Zhang YR, et al. Comparative analysis of gastroscopic morphological characteristics and postoperative pathology among biospy-diagnosed high-grade intraepithelial neoplasia[J]. Modern Digestion & Intervention, 2015, 20(1):9–11.doi:10.3969/j.issn.1672–2159.2015.01.003.
[15]Kato M, Nishida T, Tsutsui S, et al. Endoscopic submucosal dissection as a treatment for gastric noninvasive neoplasia: a multicenter study by Osaka University ESD Study Group[J]. J Gastroenterol, 2011, 46(3):325–331. doi: 10.1007/s00535–010–0350–1.
[16]Jung MK, Jeon SW, Park SY, et al. Endoscopic characteristics of gastric adenomas suggesting carcinomatous transformation[J].Surg Endosc, 2008, 22(12):2705–2711. doi: 10.1007/s00464–008–9875–2.
[17]Yoon WJ, Lee DH, Jung YJ, et al. Histologic characteristics of gastric polyps in Korea: emphasis on discrepancy between endoscopic forceps biopsy and endoscopic mucosal resection specimen[J].World J Gastroenterol, 2006, 12(25):4029–4032.
[18]李栋, 周旭坤, 李平, 等. 应用腹腔镜辅助D2根治术治疗远端进展期胃癌的临床观察[J]. 中国普通外科杂志, 2012,21(10):1303–1305.Li D, Zhou XK, Li P, et al. Laparoscopic assisted D2 radical operation in the treatment of distal gastric cancer[J]. Chinese Journal of General Surgery, 2012, 21(10):1303–1305.
[19]计小刚, 冯永江. 腹腔镜D2根治术与传统开腹术治疗胃癌的近期及远期临床疗效比较[J]. 中国普通外科杂志, 2014,23(4):547–550. doi:10.7659/j.issn.1005–6947.2014.04.032.Ji XG, Feng YJ. Laparoscopic D2 radical resection versus traditional open operation for treatment of gastric cancer:comparative analysis of short- and long-term therapeutic effects[J]. Chinese Journal of General Surgery, 2014, 23(4):547–550. doi:10.7659/j.issn.1005–6947.2014.04.032.
[20]尹作文, 喻军, 王永, 等. 腹腔镜辅助下胃癌D2根治术对患者血清炎症因子的影响[J]. 中国普通外科杂志, 2014, 23(3):383–385.doi:10.7659/j.issn.1005–6947.2014.03.025.Yin ZW, Yu J, Wang Y, et al. The effect of laparoscopy assisted D2 radical surgery on serum inflammatory factors[J]. Chinese Journal of General Surgery, 2014, 23(3):383–385. doi:10.7659/j.issn.1005–6947.2014.03.025.
[21]高金辉, 李建国, 蔡铭智, 等. 开腹及腹腔镜辅助根治性远端胃切除的对比研究[J]. 中国微创外科杂志, 2014, 14(8):695–697.doi:10.3969/j.issn.1009–6604.2014.08.007.Gao JH, Li JG, Cai MZ, et al. Comparative Study of Laparotomy and Laparoscopic-assisted Radical Distal Gastrectomy[J]. Chinese Journal of Minimally Invasive Surgery, 2014, 14(8):695–697.doi:10.3969/j.issn.1009–6604.2014.08.007.
[22]丁杰, 廖国庆, 晏仲舒, 等. 腹腔镜与开腹D2远端胃切除术治疗胃癌的Meta分析[J]. 中国普通外科杂志, 2013, 22(4):401–408.doi:10.7659/j.issn.1005–6947.2013.04.004.Ding J, Liao GQ, Yan ZS, et al. Laparoscopy-assisted versus open distal gastrectomy with D2 lymphadenectomy for gastric cancer:a Meta-analysis[J]. Chinese Journal of General Surgery, 2013,22(4):401–408. doi:10.7659/j.issn.1005–6947.2013.04.004.
[23]曾跃红, 王新华, 谭亮南. 血清SA、CEA、急性时相蛋白联合检测对结、直肠癌及胃癌的诊断价值[J]. 中国普通外科杂志,1997, 6(6):50–52.Zeng YH, Wang XH, Tan LN. Value of combined detection of serum SA,CEA and acute phase protein in diagnosis of colorectal cancer and gastric cancer[J]. Chinese Journal of General Surgery, 1997, 6(6):50–52.
[24]李迎今, 苏军燕, 徐长妍. 血清CEA、PGR、G-17检测在胃癌诊断中的价值分析[J]. 中国实验诊断学, 2017, 21(9):1498–1501.doi:10.3969/j.issn.1007–4287.2017.09.004.Li YJ, Su JY, Xu CY. Analysis on the value of serum CEA, PGR and G-17 in the diagnosis of gastric cancer[J]. Chinese Journal of Laboratory Diagnosis, 2017, 21(9):1498–1501. doi:10.3969/j.issn.1007–4287.2017.09.004.
[25]谭海燕, 马书进. 胃癌患者术前血清肿瘤标志物监测[J]. 中华实验外科杂志, 2017, 34(10):1766–1767. doi:10.3760/cma.j.issn.1001–9030.2017.10.045.Tan HY, Ma SJ. Preoperative monitoring of tumor biomarkers in gastric cancer patients[J]. Chinese Journal of Experimental Surgery, 2017, 34(10):1766–1767. doi:10.3760/cma.j.issn.1001–9030.2017.10.045.
[26]鲁文君, 姜雷, 甘亮亮, 等. 内镜下黏膜切除术与内镜黏膜下剥离术对早期胃癌疗效的Meta分析[J]. 中国普通外科杂志, 2014,23(9):1232–1240. doi:10.7659/j.issn.1005–6947.2014.09.014.Lu WJ, Jiang L, Gan LL, et al. Endoscopic submucosal dissection versus endoscopic mucosal resection for early gastric cancer:a Meta-analysis[J]. Chinese Journal of General Surgery, 2014,23(9):1232–1240. doi:10.7659/j.issn.1005–6947.2014.09.014.

