离子液体-分散液-液微萃取-高效液相色谱测定葡萄汁中赭曲霉毒素A
潘姝历, 苏 敏, 郭 婷, 张宇昊, 马 良
(西南大学食品科学学院,重庆 400715)
赭曲霉毒素A(Ochratoxin A,OTA)是一种常见霉菌毒素,属2B类致癌物[1],它具有肾脏和肝脏毒性、基因毒性、致畸性、免疫毒性和胚胎毒性[2 - 4],其毒性仅次于黄曲霉毒素B1(AFB1)。OTA可以广泛污染农产品和食品,尤其是霉变的谷物、咖啡、豆类以及葡萄制品,是食品安全领域危害最大的污染物之一[5]。目前,常采用联合免疫技术[6 - 9]与高效液相色谱(HPLC)等方法[10 - 13]进行OTA的检测,但这类方法虽然灵敏度高、重复性好,但成本较高、耗时较长且抗体不易保存,需要较大的样品量。
离子液体(Ionic Liquid,IL)是一类新型室温熔融盐,因其“低毒性”而得到广泛的应用[14]。分散液-液微萃取(Dispersive Liquid-liquid Microextraction,DLLME)是基于分析物在小体积萃取剂与样品溶液间分配平衡过程,构建离子液体-分散剂-水三元乳浊体系,通过增大离子液体与分析物的接触面积,以获得较高的富集倍数,可提高检测灵敏度[15 - 16],还可以避免使用传统DLLME中常用的高毒性萃取剂氯仿。鉴于IL-DLLME操作简单、检测速度快、成本低、富集效果好,同时可替代传统的高毒氯化物,近几年在农兽药检测以及金属离子的检测中应用广泛[17 - 21]。目前,IL-DLLME在真菌毒素方面的研究较少,主要集中在谷物、饲料的检测[22 - 24],而针对OTA的检测,主要围绕酒类样品[25 - 26]。
本研究以高OTA污染风险的葡萄汁为研究对象,构建离子液体-分散系-水三元体系,提高OTA提取效率和富集倍数,克服真菌毒素在极性溶液为主的检测体系中其荧光猝灭导致灵敏度降低的问题,提高检测灵敏度。同时,结合HPLC法建立葡萄汁中OTA的快速检测方法,高灵敏度检测农产品及食品中真菌毒素。
1 实验部分
1.1 仪器及试剂
LC-20A高效液相色谱仪(日本,岛津公司),配有荧光检测器;5810台式高速离心机(德国,Eppendorf公司);QL-901涡旋震荡器(海门市其林贝尔仪器制造有限公司)。
OTA标准品(>99%,新加坡PriboLab公司);1-丁基-3-甲基咪唑六氟磷酸盐([C4MIM][PF6])(>98%)、1-甲基-3-辛基咪唑六氟磷酸盐([C8MIM][PF6])(>98%)、1-己基-3-甲基咪唑六氟磷酸盐([C6MIM][PF6])(≥98%)(上海安谱科学仪器有限公司)。甲醇、乙腈、冰乙酸、丙酮、无水乙醇均为色谱纯(天津四友有限公司)。
浓缩葡萄汁购于当地超市。
1.2 实验方法
1.2.1样品处理准确移取5.00 mL样品,加冰乙酸调节pH至3.5,然后快速注入100 μL萃取剂 [C8MIM][PF6]与0.8 mL分散剂(丙酮)的混合溶液,涡旋震荡3 min后,4 000 r/min 离心5 min,准确移取40 μL离心管底部的离子液体到进样瓶的内插管中,用等体积的甲醇稀释,待测。
1.2.2色谱分离条件色谱柱:ZORBAX EXTEND C18柱(150×4.6 mm,5.0 μm;美国安捷伦有限公司);流动相:乙腈-2%乙酸水溶液(50∶50,V/V);流速:1.0 mL/min;柱温:35 ℃;进样量:20 μL;激发波长:333 nm,发射波长:460 nm。
2 结果与讨论
2.1 葡萄汁前处理条件优化
2.1.1萃取剂及用量选择研究了3种离子液体[C4MIM][PF6]、[C6MIM][PF6]和[C8MIM][PF6]对OTA的萃取效果。结果发现[C4MIM][PF6]由于溶解度问题而无法在离心管底部形成沉淀,不适合作为本研究的萃取剂。[C6MIM][PF6]与[C8MIM][PF6]作为萃取剂时,OTA的萃取回收率较高,均大于75%,但[C6MIM][PF6]为萃取剂时色谱分离效率较好,色谱峰形比[C8MIM][PF6]尖锐,半峰宽较窄,且[C6MIM][PF6]粘度相对较小有助于分离,故选用[C6MIM][PF6]为萃取剂。不同体积的[C6MIM][PF6]对OTA回收率影响的结果如图1所示,随着萃取剂用量的增大,OTA的回收率显著增大,100 μL时萃取回收率达到最高,为103.33%。因此,萃取剂用量选取100 μL。
2.1.2分散剂及用量选择实验比较了甲醇、乙醇、乙腈、丙酮4种有机溶剂对OTA的萃取效果。结果显示:乙腈、乙醇、丙酮萃取回收率均超过70%,且以丙酮为分散剂时萃取回收率最高,为84.76%,所以选择丙酮作为本实验的分散剂。在0.5~0.9 mL体积范围比较了不同体积丙酮对OTA萃取回收率的影响。当丙酮量为0.7、0.8 mL时OTA萃取回收率均高于90%,故选择分散剂体积为0.7 mL。
2.1.3pH值的影响实验研究了pH=2.5~4.5时OTA的萃取回收率,结果如图2所示。pH为2.5时萃取效率较低,分析原因为低pH条件下萃取剂受到盐溶效应影响,难以形成乳浊体系,导致最终萃取剂的体积减少,萃取回收率降低。而当pH高于pKa值时,一部分OTA易以离子状态存在,导致萃取回收率降低。因此本研究采用冰乙酸调节pH至3.5。

图1 萃取剂用量对OTA回收率影响(cOTA=3 μg/kg)Fig.1 Effect of extraction dosage on recoveries of OTA(spiked at 3 μg/kg)
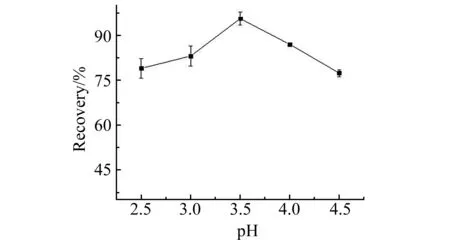
图2 溶液pH对OTA回收率的影响(cOTA=3 μg/kg)Fig.2 Effect of pH on recoveries of OTA(spiked at 3 μg/kg)
2.1.4离子强度的影响实验通过添加不同含量的NaCl来改变水相的离子强度,结果显示,随着NaCl浓度增加,萃取回收率呈现先增加后降低的趋势,在NaCl浓度为50 g/L时萃取回收率达到最高,当NaCl浓度超过50 g/L时萃取回收率降低。分析原因可能是因为样品溶液浓度过大,降低了目标物在IL中的溶解度,导致萃取回收率降低,因此本实验选择NaCl浓度为50 g/L。
2.1.5涡旋时间的影响实验考察了不同涡旋时间对萃取回收率的影响。实验结果显示,当涡旋时间为1 min时,萃取时间较短,萃取不完全,萃取回收率较低。而涡旋时间增加到3 min后,可获得较高的萃取回收率。当涡旋时间过长,7 min时萃取回收率有所下降,分析原因可能是有一部分萃取剂附着在了离心管壁。因此,涡旋时间确定为3 min。
2.2 方法学研究与评价
准确移取适量2.5 mg/L的OTA标准溶液,用流动相稀释成质量浓度为0.10、0.25、1.00、2.50、5.00、7.00、10.00、15.00、20.00 μg/L的标准系列溶液,在优化条件下测定,以质量浓度(X,μg/L)为横坐标,测得的峰面积为纵坐标(Y),绘制标准曲线。结果表明:OTA在0.02~20.00 μg/kg范围内的标准曲线方程为:Y=9344.3X-607.98,R2=0.9995,线性关系良好。检出限(S/N=3)为0.05 μg/kg,定量限(S/N=10)为0.17 μg/kg。
对不含目标物的空白浓缩葡萄汁进行0.5、1.0、2.0 μk/kg3个水平的加标回收实验。结果显示,OTA的平均加标回收率范围为83.88%~105.32%,富集倍数为8.92~9.95,相对标准偏差为4.17%~7.83%,表明该方法具有良好的准确性和重复性,可用于葡萄汁中OTA的检测。
2.3 实际样品测定
在各大型超市随机抽取3种不同品牌的葡萄汁样品,采用本方法进行提取,HPLC-FLD分析。检测结果如图3所示,葡萄汁中OTA含量均未超过欧盟最大限量标准10 μg/kg。浓缩葡萄汁A、B中的OTA含量分别为0.03±0.01 μk/kg(n=5)、0.22±0.01 μk/kg(n=5)。

图3 葡萄汁样品经IL-DLLME处理后的色谱图Fig.3 Chromatograms of grape juice samples analysed using IL-DLLME with HPLC-FLDa is sample spiked at 2 μg/kg of OTA;b is concentrated grape juice B;c is concentrated grape juice A;d is grape juice.
3 结论
本研究采用离子液体[C6MIM][PF6]代替氯仿作为萃取剂,涡旋辅助萃取,结合高效液相色谱-荧光检测法,建立了葡萄汁中OTA的实验室快速检测方法。该方法通过构建离子液体-分散剂-水的三元乳浊体系,提高了OTA的检测灵敏度,实际样品检测结果均未超过欧盟最大限量标准10 μg/kg。该方法经济环保、快捷高效,避免了有机溶剂的大量使用,且能满足复杂基质如果汁中OTA的检测要求。
参考文献:
[1] WHO.IARC Monographs on the Evaluation of Carcinogenic Risks to Humans.Lyon:IARC Press,1993:489.
[2] Sorrenti V,Giacomo C D,Acquaviva R,et al.Toxins,2013,5(10):1742.
[3] Giromini C,Rebucci R,Fusi E,et al.Cell Biology and Toxicology,2016,32(3):249.
[4] Schwerdt G,Holzinger H,Königs M,et al.Food & Chemical Toxicology,2009,47(1):209.
[5] YANG J L.Investigation and Risk Assessment of Ochratoxin A in Main Foods in China.Xianyang:Northwest A & F University(杨家玲.我国主要食品中赭曲霉毒素A调查与风险评估.咸阳:西北农林科技大学),2008.
[6] LS/T 6114-2015.Inspection of Grain and Oils-Detection of Ochratoxin A in Grain-Rapid Quantitative Method of Colloidal Gold Technique(粮油检测 粮食中赭曲霉毒素A测定 胶体金快速定量法).
[7] ZHOU Y F,XIONG S C,JIANG H,et al.Chinese Journal of Analytical Chemistry(周耀锋,熊斯诚,江湖,等.分析化学),2015,43(12):1837.
[8] Vidal J C,Bertolín J R,Ezquerra A,et al.Analytical Methods,2017,9(24):3602.
[9] XIONG S,ZHOU Y,HUANG X,et al.Analytica Chimica Acta,2017,972:94.
[10] SHI N,HOU C Y,LU Y,et al.Food Science(史娜,侯彩云,路勇,等.食品科学),2014,35(16):190.
[11] GB/T 30957-2014.Detection of Ochratoxin A in Feeds-High Performance Liquid Chromatography with Immunoaffinity Column Clean-up(饲料中赭曲霉毒素A的测定 免疫亲和柱净化-高效液相色谱法).
[13] CHEN X Z,LI Z,HUANG F Z,et al.Journal of Analytical Science(陈祥准,李舟,黄芙珍,等.分析科学学报),2017,33(2):267.
[14] Poole C F,Lenca N.Trends in Analytical Chemistry,2015,71:144.
[15] DU P,HU W,LI S Q,et al.Journal of Analytical Science(杜平,胡维,李胜清,等.分析科学学报),2009,25(5):598.
[16] Rezaee M,Assadi Y,Milani Hosseini M R,et al.Journal of Chromatography A,2006,1116(1-2):1.
[17] ZHOU H Y,CHEN J,WANG J J,et al.Journal of Analytical Science(周惠燕,陈珏,王嘉俊,等.分析科学学报),2016,32(1):137.
[18] Sereshti H,Eskandarpour N,Samadi S,et al.International Journal of Environmental Research,2014,8(4):1075.
[19] FENG G,LIU L,JIN H M,et al.Journal of Analytical Science(冯刚,刘力,金慧敏,等.分析科学学报),2014,30(3):385.
[20] YANG M,WU X,JIA Y,et al.Analytica Chimica Acta,2016,906:118.
[21] WANG X,WU L,CAO J,et al.Food Additives & Contaminants:Part A,2016,33(7):1190.
[22] ZHAO J,ZHU Y,JIAO Y,et al.Journal of Separation Science,2016,39(19):3789.
[23] Bozkurt S,ISIK G.Journal of Liquid Chromatography & Related Technologies,2015,38(17):1601.
[24] WANG L,LUAN C,CHEN F,et al.Journal of Separation Science,2015,38(12):2126.
[25] Arroyo-Manzanares N,García-Campaa A M,Gmiz-Gracia L.Analytical & Bioanalytical Chemistry,2011,401(9):2987.
[26] LAI X,RUAN C,LIU R,et al.Food Chemistry,2014,161:317.

