锂电池研究中的循环伏安实验测量和分析方法
聂凯会,耿 振,王其钰,岳金明,禹习谦,李 泓
锂电池研究中的循环伏安实验测量和分析方法
聂凯会,耿 振,王其钰,岳金明,禹习谦,李 泓
(中国科学院物理研究所,北京 100190)
循环伏安作为一种重要的电化学测试方法,在电化学领域尤其是锂电池的研究中有着广泛的应用,常用于电极反应可逆性、电极反应机理及电极反应动力学参数的研究。本文介绍了循环伏安的基本原理、测试方法以及常用仪器,并结合实际案例,具体分析了循环伏安在锂电池电极材料反应机理、电极过程动力学以及电解液电化学稳定性方面的应用研究。
循环伏安法;测试方法;电化学;锂电池
1 循环伏安法概述
循环伏安(cyclic voltammetry,CV)是常见的电化学研究方法之一。该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛应用。CV曲线能够直观地用于分析所测量电化学体系中电化学反应的平衡电位、可逆程度、极化程度、动力学参数等众多信息,对于分析未知或已知体系的电化学反应机理和性能评价十分有效。
锂电池体系中的电极反应过程是一个复杂过程,一般包括多步电化学反应并伴随化学反应。电极反应过程中,离子传输、电荷转移、界面反应和电解液稳定性等方面都会对锂电池性能产生很大影响,CV测试和分析可以得到相关电极反应过程中的重要参数,因此CV作为重要的电化学分析方法在锂电池研究中起着非常重要的作用。CV测量需要按照一定的规范进行操作,有利于得到准确、可靠的信息,因此CV实验测量以及分析方法的标准化十分必要。
本文针对CV实验测量和分析方法,介绍了CV实验原理和实验测试方法(包括电极体系的选择、电化学工作站的选用、操作测试过程和注意事项等),并结合锂电池研究中的具体案例介绍了CV数据分析方法。
2 实验原理
2.1 线性扫描伏安法
以一定速率(v/s)在给定的电压范围内对电池的电压进行单程线性扫描,测试结果以电流-电压(-)曲线的形式表示,这种方法叫做线性扫描伏安法(linear sweep voltammetry,LSV)。当电池在测试电压范围内发生氧化或者还原反应时可以观察到电流的显著变化,若无氧化或者还原反应发生只能观测到较小的非法拉第电流。图1(a)展示了典型的LSV曲线[1]。如图所示,当电极电势达到反应值时,电极表面发生电荷转移,电流开始随电势的变化(增高或降低)而升高,由于电势连续变化,电极反应没有恢复平衡的时间,电极活性物质不断消耗引发电极表面浓度梯度和扩散层厚度的增大,当电流到达某一值(峰值电流p)时,尽管电势继续增大,但参与电极反应的活性物质量开始减少,电流强度也随之减小。基于以上特征,LSV被广泛用于电解液的电化学稳定性以及对集流体、电池壳体的腐蚀性研究等方面。
2.2 循环伏安法
与LSV的实验原理相同,循环伏安法在单程线性扫描的基础上增加了逆向扫描。典型的CV过程为:电势向阴极方向扫描时,电极活性物质被还原,产生还原峰;向阳极扫描时,还原产物重新在电极上氧化,产生氧化峰。因此,一次CV扫描,完成一个氧化和还原过程的循环。对于可逆体系,典型的CV曲线如图1(b)所示[1]。不同可逆程度的体系会有不同的特征曲线。通过CV曲线中氧化峰和还原峰的数量、电位、峰强以及峰位间距等参数,可分析活性物质在电极表面反应的反应机理、可逆程度、极化程度并获得电极反应动力学参数[2]。
2.2.1 可逆体系(能斯特体系)
可逆反应,即电荷转移速率远快于物质传输速率的反应,因为扩散过程是反应的控速环节,阳极发生氧化反应,根据Fick第二定律可以表示为[3]
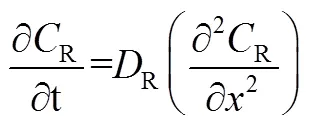
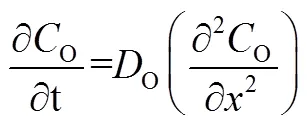
式中,O与R分别为氧化物与还原物在电极附近的浓度,O与R分别为氧化物与还原物的扩散系数。在阳极发生氧化反应时,还原物R被氧化生成O,带入起始条件与边界条件,对于可逆反应,电极表面氧化物、还原物的浓度与电极电势满足能斯特方程。得到峰值电流的变化符合Randle-Sevick方程[3],如式(3)所示
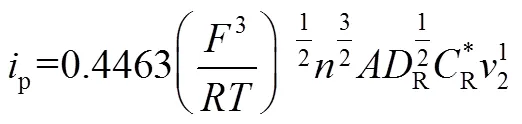
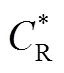
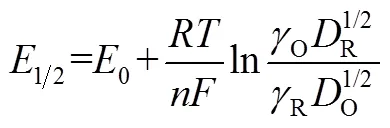
则有峰值电位与半波电位具有以下关系
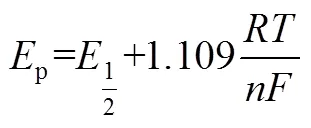
假定p的半值p/2对应的电位为p/2,那么峰电位p和p/2的差具有如下关系(25 ℃):
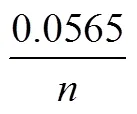
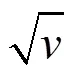
根据可逆反应的这些特征可用于判断电极反应可逆性以及计算可逆反应过程的各项参数。
2.2.2 非可逆体系
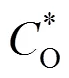
2.2.3 准可逆体系
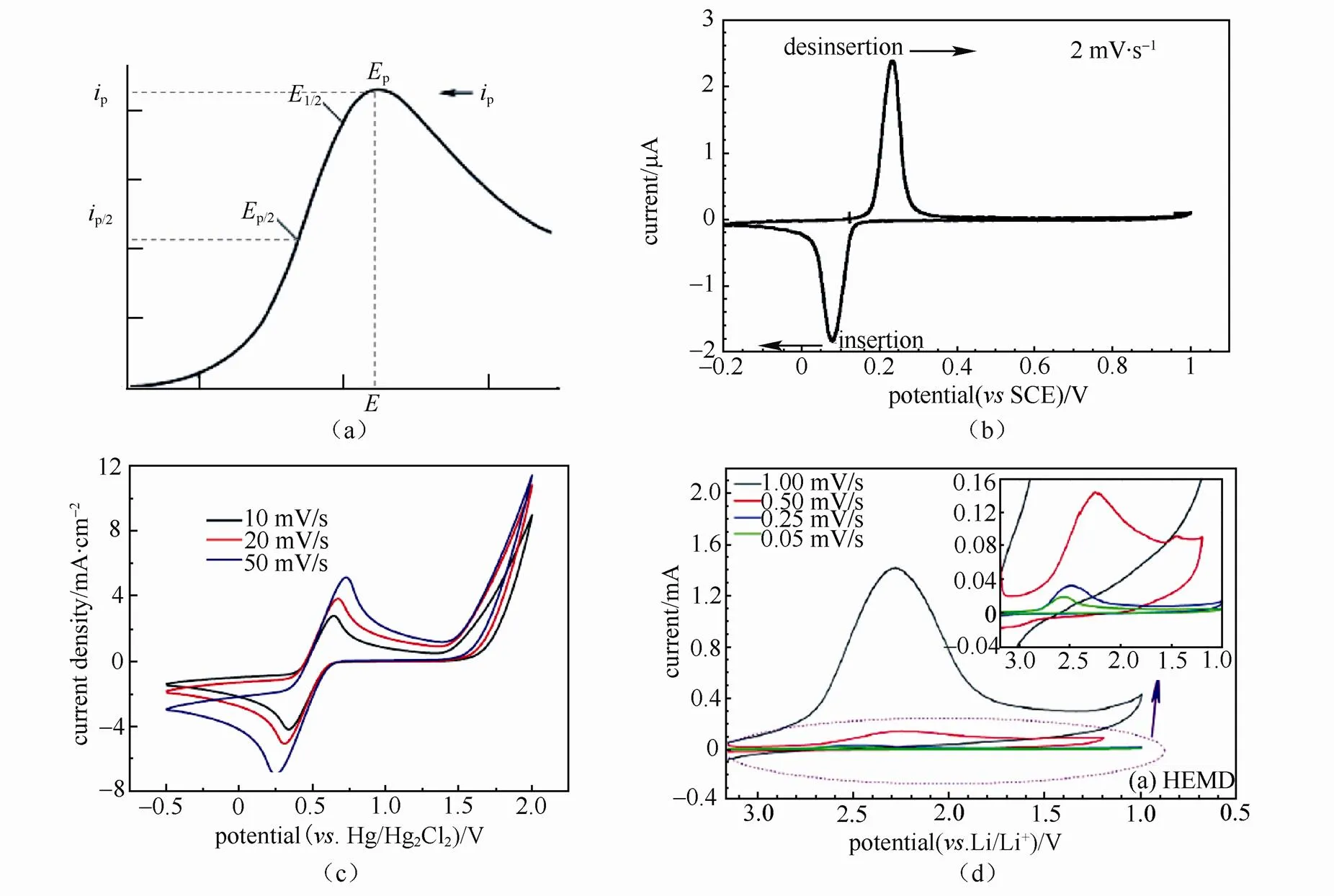
图1 (a)典型Nernst反应的LSV曲线[1];(b)典型Nernst反应的CV曲线:LiFePO4薄膜电极作为工作电极,Pt惰性电极作为辅助电极,饱和甘汞电极作为参比电极,1 mol/L LiNO3电解液体系测得的CV曲线[5];(c)准可逆电化学反应的CV曲线示例:玻璃碳电极作为工作电极,Pt作为辅助电极,饱和甘汞电极作为参比电极,测得的1.0 mol/L FeCl3低共熔溶剂溶液中Fe(II)/Fe(III)氧化还原电对的CV曲线[6];(d)典型的不可逆体系:MnO2电极材料作为工作电极,辅助电极与参比电极均采用金属锂,测得的1mol/L LiClO4溶液体系中Li/MnO2一次电池的CV曲线[7]
3 实验测试方法
3.1 电极体系选择
3.1.1 两电极体系
两电极CV可以用于测试电池正负极整体的电化学反应行为。扣式电池、软包电池以及硬壳电池均可直接进行CV测量。实验室可直接组装扣式电池或者软包电池进行CV测试。扣式电池组装中极片的制备、集流体的选择、极片涂覆制备工艺、 极片干燥辊压处理以及扣式电池的组装方法可参 见《锂离子扣式电池的组装,充放电测量和数据分 析》[8]。
在电池进行周期性充放电的过程中,周期性变化的电压施加在正负极之间,随着电压变化,根据阴极电流峰与阳极电流峰之间差值以及两个峰的形状可大致判断电池内部氧化还原反应的可逆程度。但是由于大多数实际电池内部锂离子扩散以及电化学反应的迟缓性导致电池内部不可避免地存在浓差极化与电化学极化,使电极电势偏离平衡电极电势。所以,无法获得任何单一电极的实际电位,进而无法获得单一电极的真实电化学行为。其次,两电极CV曲线反映的是两个电极叠加的响应行为,无法单一研究某一特定电极的性质。而三电极CV通过引入参比电极,可基本解决以上由于极化所带来的问题。
在锂电池体系中,如果扫速较慢,金属锂较厚,金属锂在该电解质体系中基本稳定,金属锂自身的电位基本不发生变化,则扫描过程中极化引起的过电位基本可以忽略,电解质和电池的条件一致,此时利用两电极定性或半定量研究工作电极(对电极)上的氧化还原反应或者对比研究两种材料的动力学行为,也具有一定的参考价值。
3.1.2 三电极体系
三电极体系由工作电极、辅助电极(对电极)以及参比电极构成。其中,在工作电极与参比电极之间施加周期性变化电压,形成测量回路,同时测量工作电极与辅助电极之间的电流形成极化回路。根据所实现的不同功能,3种电极应具备不同的性质。①对于工作电极,在进行电解液分析时,工作电极应不与电解液发生化学反应;有较大的电化学窗口;表面均匀、平滑、易净化;面积不宜过大。作为被研究的电极,可以没有这些要求。②对于辅助电极,用于通过电流以实现工作电极极化,为了减少电流密度分布的不均匀性,辅助电极尽可能选择较大的面积,较小的电阻。③对于参比电极,用于标定工作电极的电势,所以电极反应需可逆,满足能斯特方程;稳定、重现性好;受温度影响小;不溶于电解液且便于使用、易维护。一般参比电极尽可能不影响工作电极上的反应,参比电极和工作电极之间的电流远小于对电极和工作电极之间的电流。电化学研究中,常用的参比电极有标准氢电极、饱和甘汞电极,但是以上参比电极只适用于水系电池研究。对于锂电池有机电解液体系的研究,金属锂通常作为参比电极使用,有时也可以使用电位稳定的Li4Ti5O12电极[9-10]。此外,二茂铁也可以添加到电解液里,利用其稳定的氧化还原电位,作为内参比电极。此时,电池可以是两电极体系。
选择好所需的电极后,实验室可进行扣式、玻璃瓶以及软包三电极电池的组装,如图2所示。这3种三电极体系电池组装简单,便于测量,是实验室常用的测试装置。扣式三电极电池具有体积小、可置于手套箱内操作、全不锈钢结构、厚度可调、容易拆卸等特点,可根据极片尺寸定做不同尺寸的电池壳,便于实验室操作。玻璃瓶三电极电池对于电极大小、形状、位置没有严格的要求,可根据所研究材料的特点自行设计、组装电极,便于组装以及测量,对于电池内部发生的现象,如电解液颜色变化、气体溢出等现象,便于观察。但是该装置需要的电解液用量较多,此外对装置密闭性要求极高,一旦有空气进入,会对电池体系的性能测量造成很大的影响。所以对于有机电解液体系,在电池封装完成后,需在接口位置涂覆真空硅脂或者凡士林,以避免电池内外气体交换。软包三电极电池可在实验室自行设计、组装,根据极片、形状、组态自行选择不同大小的铝塑膜,组装完成后在手套箱进行密闭封装。这3种电池中,玻璃瓶三电极中的电解液远远过量,其次是扣式电池,再其次是软包电芯。因此,测量到的直接涉及电解液的一些行为可能会出现差异。

图2 实验室常用各种三电极电池示意图(a)扣式三电极电池(沈阳科晶自动化设备有限公司3ESTC15扣式电池三电极测试装置);(b)玻璃三电极电解池;(c)自制软包三电极电池内部组成示意图及电池图片
3.2 三电极电池的组装
3.2.1 扣式三电极电池的组装
如图3(a)所示,一套完整的三电极扣式电池包括以下组件:装置下体、装置中体、塑料导套、弹簧、金属压盘、正极极片、隔膜、参比电极、负极极片、装置上体、六角螺丝以及密封螺帽。组装过程中,首先将装置中体放在装置下体上,用六角螺丝固定,随后放入两块塑料导套,再依次将弹簧与金属压盘放入塑料导套内部中心位置,在金属压盘的中心位置依次放入正极极片与隔膜,为防止短路,隔膜的尺寸应稍大于正极极片。随后放入参比电极的圆环,参比电极要可与中体接触,外圈的尺寸要略大于隔膜,内圈的直径要大于等于极片的直径,随后在中心位置放入隔膜以及负极片,盖好金属压盘以及装置上体,使用六角螺丝固定,将电极压紧。使用移液器缓慢滴加电解液,随后拧紧密封螺帽,电池组装完成。组装完成后的电池需轻拿轻放以避免发生短路。
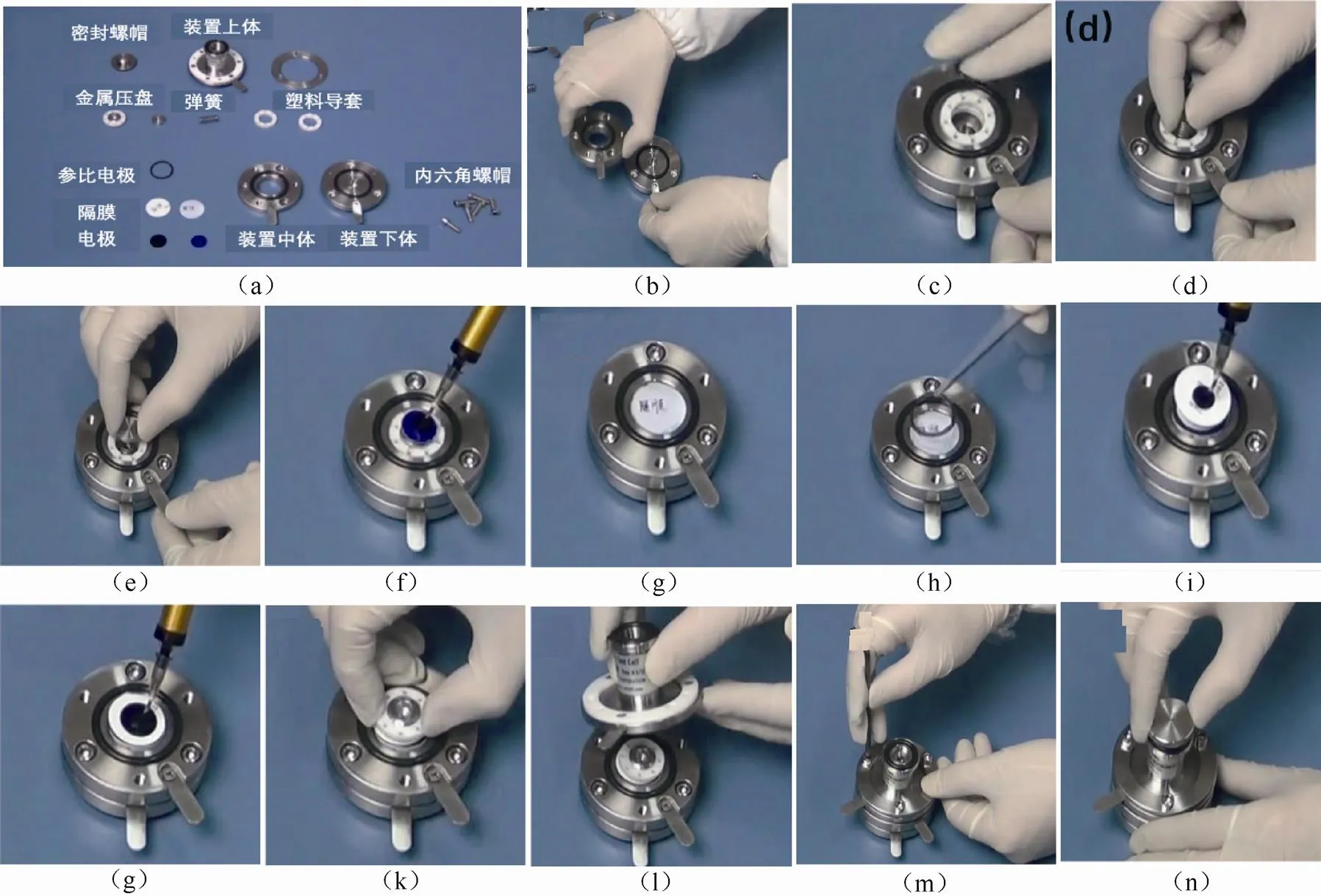
图3 科晶3ESTC15扣式三电极电池组装过程(以上图片来源于沈阳科晶自动化设备有限公司)
3.2.2 玻璃三电极电池的组装
图4为玻璃三电极电池组装流程示意图,一套完整的简易玻璃三电极电池包含图4(a)中所示的组件:玻璃瓶、聚四氟乙烯盖子、密封胶塞、参比电极、工作电极、辅助电极、固定螺丝以及电解液。组装过程中,首先将密封胶塞固定于聚四氟乙烯盖子上,以保证电池内部处于密封状态。安装工作电极与辅助电极,使用固定的螺丝将工作电极与参比电极固定于两个电极的金属棒上面。图中使用LiMn2O4作为工作电极,活性炭作为辅助电极,氯化银作为参比电极,集流体均使用不锈钢网。将两个电极固定好后,插入参比电极,适当调整三个电极的位置,确保不会发生短路后,使用移液器添加适量的电解液于玻璃瓶内,电解液添加量需保证液面刚好没过所有电极的活性物质,将固定在聚四氟乙烯盖子上的3个电极插进玻璃瓶内并拧紧,如果有必要,需在接口位置涂覆真空硅脂或凡士林以达到更好的密封效果,最终完成电池组装。在这里,参比电极可以采用覆锂的钨丝、不锈钢网、镍网等。
3.2.3 软包三电极电池的组装
软包三电极电池组装前需制备好3个电极,保留较长的极耳或者导电引线,便于封装后测试。需在手套箱组装,隔膜面积需稍大于电极面积,组装完成后用铝塑膜封装。
电池组装完成后,如果直接用于CV测试,需先在室温下静置8~12 h,以保证电解液充分浸润电池内部各个组分。如果是循环后的电池,需静置约2~4 h,以确保电池回到稳态,多次测量电池的开路电压不再发生变化后,进行CV测试。

图4 玻璃三电极电池组装过程流程图
3.3 CV测试电化学工作站的选择
多种电化学工作站均具备CV测试功能,常见的有英国Solartron 1260/1287,德国Zahner,法国Biologic VMP3以及上海辰华CHI600E系列电化学工作站。除了CV测试,这些电化学工作站还具备其它的电化学测量的功能,表1列举了这些工作站所具有的特点以及常用的功能。除了以下列举的电化学工作站之外,还有Metrohm Multi Autolab PGSTAT302N,PGZ301 Volta,AMEL, model 2053,EG&G M173等电化学工作站也可用于CV测试,此处不再详细介绍。
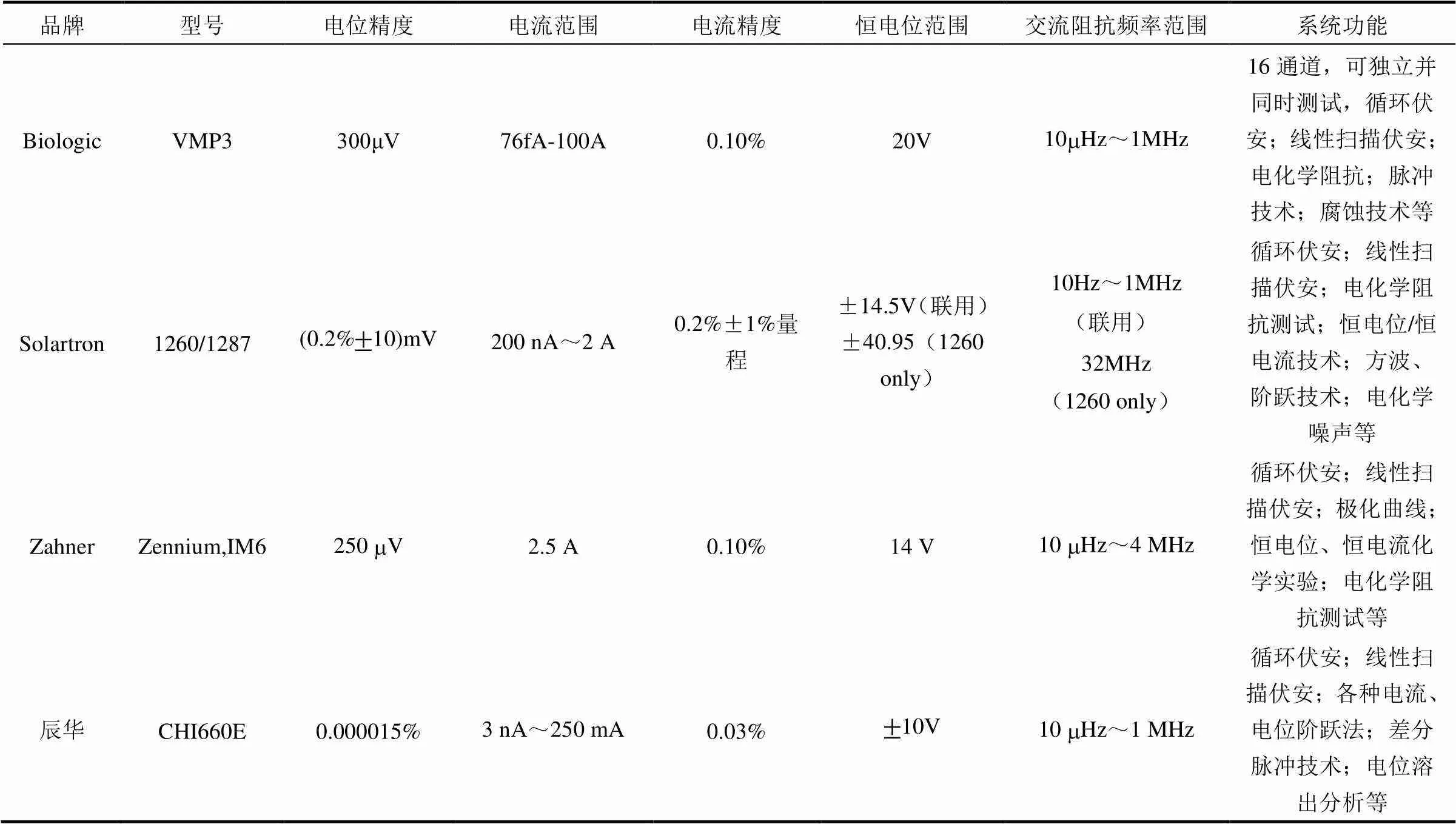
表1 常见的用于CV测试的电化学工作站的特点及功能
3.3 CV测试流程
下文以CHI600E为例介绍CV测试的流程。仪器连接方式如图5(a)所示,仪器中,绿色、黑色、白色以及红色电极夹分别表示工作电极、感受电极(sensor)、参比电极以及辅助电极。感受电极用于四电极体系,用时与工作电极夹在一起。感受电极对于大电流(>100mA)或低阻抗电解池(<1Ω)十分重要,可消除由于电缆或者接触电阻引起的测量误差。对于三电极体系,感受电极应荡空不用或与工作电极短接。对于两电极电池,需将工作电极与感受电极短接,辅助电极与参比电极短接,然后分别连接工作电极与辅助电极。
完成接线后,在电脑上打开与CHI电化学工作站连用的软件CP210X,在Setup菜单中,在仪器所具备的一系列功能中选择CV-cyclic voltammetry[图5(b)],然后设置CV的各个参数,从上到下依次为初始电位、上限电位、下限电位、终止电位、初始扫描方向、扫描速度、扫描段数(2段为1圈)、采样间隔、静置时间、灵敏度[图5(c)]。灵敏度数值设置和测试电流同一数量级或大一级,需要尽量小。参数设置完成后开始测量,测量完成后将数据导出进行分析。参数范围的选择需要具体问题具体分析,其它电化学仪器的参数设定也大同小异。研究时特别需要注意测量的量程选择,以便获得最高的精度,同时不损伤仪器。
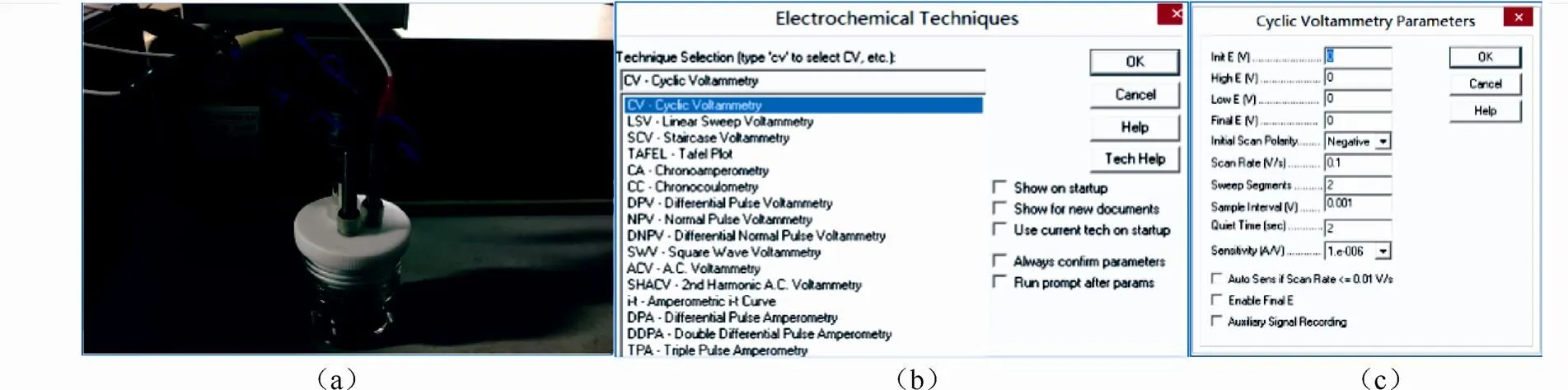
图5 上海辰华CHI660E的CV操作流程(a)仪器连接方式;(b)仪器功能的选择;(c)循环伏安实验参数的设定
4 数据及案例分析
4.1 循环伏安得到的重要参数
CV测试得到的数据可直接通过Origin等专业软件进行作图分析。对CV曲线进行分析可至少得到关于锂电池体系的以下重要信息:① 电化学反应机理及可逆性;②电化学反应中氧化还原电位及平衡电位;③极化分析;④表观扩散系数;⑤参与电化学反应的电子数;⑥电解液电化学稳定性。
4.2 循环伏安在锂电池研究中的应用
4.2.1 反应机理及可逆性研究
(1)锂离子电池负极材料
CV分析中,可根据氧化峰以及还原峰的数目以及电位,初步判断电极反应的机理。如在研究In2O3、Sb2O3、SnO等金属氧化物作为锂离子电池负极材料的反应机理时,采用金属氧化物负极材料作为工作电极,对电极以及参比电极均使用金属锂电极,使用1 mol/L LiPF6in EC-DEC(1∶1,体积比)电解液,装配玻璃三电极电池测量CV[11]。如图6所示,3种金属氧化物的首周CV曲线中均出现了不可逆的还原峰,这主要归因于首周不可逆的容量以及SEI的形成。随后几周的CV曲线中,In2O3、Sb2O3、SnO分别出现4对、2对、6对氧化还原峰,每一个峰都与氧化或还原过程中的一个相变反应对应,类似于充放电曲线中的电压平台。研究发现,氧化还原峰的对数对应于In、Sb、Sn金属与金属锂发生合金化反应相变的过程,说明这些金属氧化物负极储锂机制为合金化反应。通过HRTEM观测到了大量无序分散的纳米合金颗粒,证明了储锂机理[图6(g)],如下:首先,金属锂与金属氧化物反应生成氧化锂与金属In、Sb、Sn,该过程为不可逆反应;随后,发生多个相转变合金化反应,可能的相转变过程如下所示[11]。
Li++ In → Li0.86In → Li1.74In → Li2.08In →Li2.67In
2Li++ Sb → Li2Sb → Li3Sb
Li +Sn → Li2Sn5→ LiSn → Li7Sn3→ Li5Sn2→ Li13Sn5→ Li7Sn2→ Li22Sn5
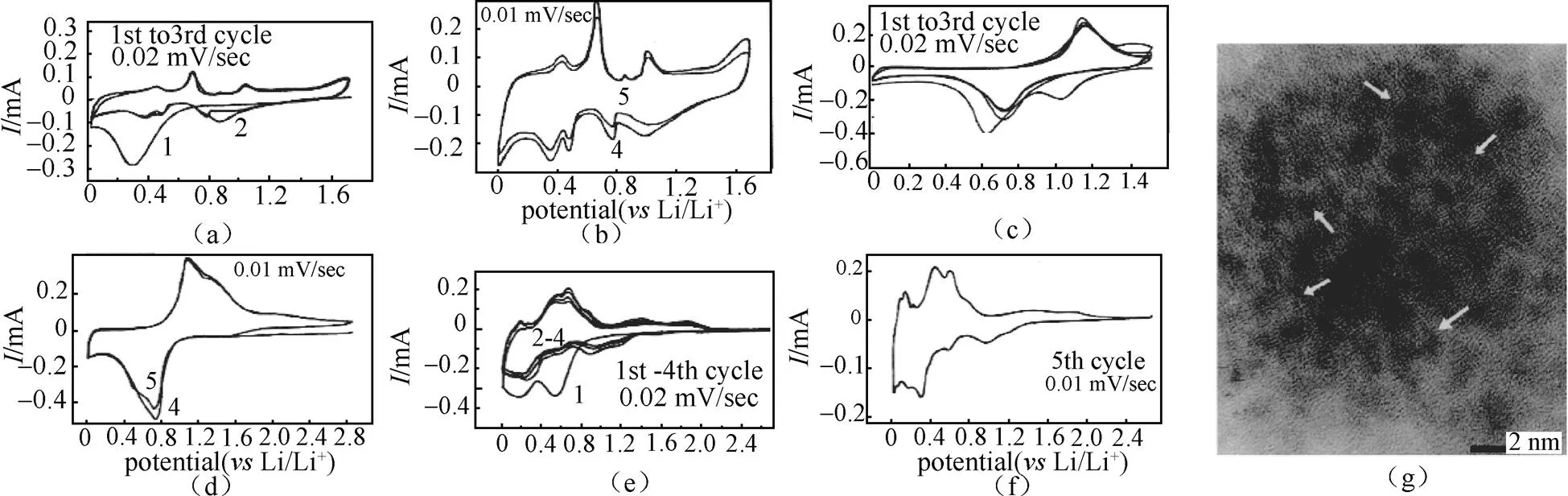
图6 锂离子二次电池中氧化物负极在不同扫速以及不同周次下典型的CV曲线;(a, b)In2O3;(c, d)Sb2O3;(e, f)SnO;(g)SnO负极放电至0 V后中心区域的HRTEM图像,其中白色箭头附近的区域为弥散的纳米Li-Sn颗粒[11]
类似,CV也可用于研究β-SnSb合金负极材料的储锂机制[12],纳米硅负极储锂与材料晶粒尺寸的关系[13]以及其它锂离子电池负极材料如Li4Ti5O12的储锂机制[14]。根据CV的氧化还原峰的数量和位置,利用已有的知识,可以大致判断反应机理,反应可逆性,不再赘述。
(2)锂硫电池正极材料
硫正极在充放电过程中发生S8单质与Li2S的互相转换,这种转变不是一步完成的,而是包含多步中间反应,利用CV测试很好地分析该多步反应的机理。图7(a)和7(b)分别为典型的锂-硫电池CV曲线与充放电曲线,两个CV氧化/还原电流峰正好对应于充放电曲线中两个平台。如图所示,放电过程中,2.4 V左右较小的的还原电流峰[图7(a)]对应于同电压范围的较短的放电平台[图7(b)],这代表了S8单质被还原成长链多硫化物(Li2S,4 << 8)的反应;2.0 V左右较大的还原电流峰[图7(a)]对应于同电压范围内的较长的放电平台[图7(b)],这代表了长链多硫化物(Li2S,4 << 8)被还原成短链多硫化物(Li2S,<4)以及Li2S的反应。同样,在充电过程中2.3 V与2.4 V左右的两个氧化电流峰分别对应于两个逆反应过程[15-16]。其中,S8单质与长链多硫化物之间转变反应的氧化峰与还原峰的峰位差值很小,说明该步反应可逆性高,这主要是因为多硫化物易溶于电解液,并且反应迅速,反应过程中的极化很小。然而,长链多硫化物与Li2S之间的转变反应,由于Li2S极难溶于电解液,涉及固液两相反应,所以反应速度较慢,极化较大,导致该反应对应的氧化峰与还原峰之间的峰位间距较大。综上,通过CV测试,可以很好地分析硫正极电化学反应中两对氧化还原反应的电位、可逆程度以及极化程度。
此外,CV也可用于研究表面形成包覆层后电极材料动力学性能的变化。在硫正极表面原位聚合包覆一层导电聚合物聚噻吩后,使用1mol/L LiTFSI in DOL/DME(1∶1,体积比)电解液,使用两电极扣式电池体系进行CV测试,如图7(c)所示。结果显示,包覆后,电池的CV曲线发生了较大变化,其中S-PTh B包覆量适中的材料氧化峰位与还原峰位之间的差值最小,意味着包覆量适中的材料极化最小[17]。此外,该样品CV曲线峰值电流变化与扫速的增加成线性关系,说明改材料倍率性能较好可用于大电流工作。如图7(d)所示,随着扫速的变化,还原峰面积的变化基本等于氧化峰面积的变化,说明该材料在不同倍率下工作时反应可逆性较好,仅存在较低的不可逆容量。此外,与首周CV相比,循环80周后材料的CV曲线无明显差异,说明包覆后的材料具有较好的循环稳定性。以上CV分析说明通过适量聚噻吩包覆可有效抑制锂-硫电池中多硫化物的溶出,提高电池的循环稳定性和库仑效率。
(3)锂离子电池正极材料
通过Mn/Ti掺杂可以有效提高NCA(LiNi0.85Co0.10Al0.05-MO2,M=Mn或Ti,<0.01)正极材料的电化学性能,这主要是因为,Mn4+/Ti4+掺杂进入NCA八面体晶格位,导致晶格体积膨胀,锂离子层间距增大,提高了锂离子扩散动力学性能。在该研究中,通过CV测试很好地分析了NCA正极材料的脱/嵌锂机理以及掺杂后材料电化学性能改善的原因。该研究采用两电极体系扣式电池进行CV测试。如图8(a)所示,未掺杂的NCA分别在3.84 V、4.02 V以及4.20 V展现了3个氧化峰,这分别对应了3个相转变反应(I,六方-单斜相转变反应;II,单斜-六方相转变反应;III,六方-六方相转变反应)。相对应的3个还原峰(I,,II,,III,)分别位于3.66 V、3.93 V、4.12 V。如图8(b)~8(d)所示,Mn、Ti掺杂后分别在3.94 V、3.79 V展现了较宽的氧化峰,这主要归因于掺杂后锂离子层间距增大,因此提高了锂离子扩散动力学性能,改善了材料的电化学性能[19]。
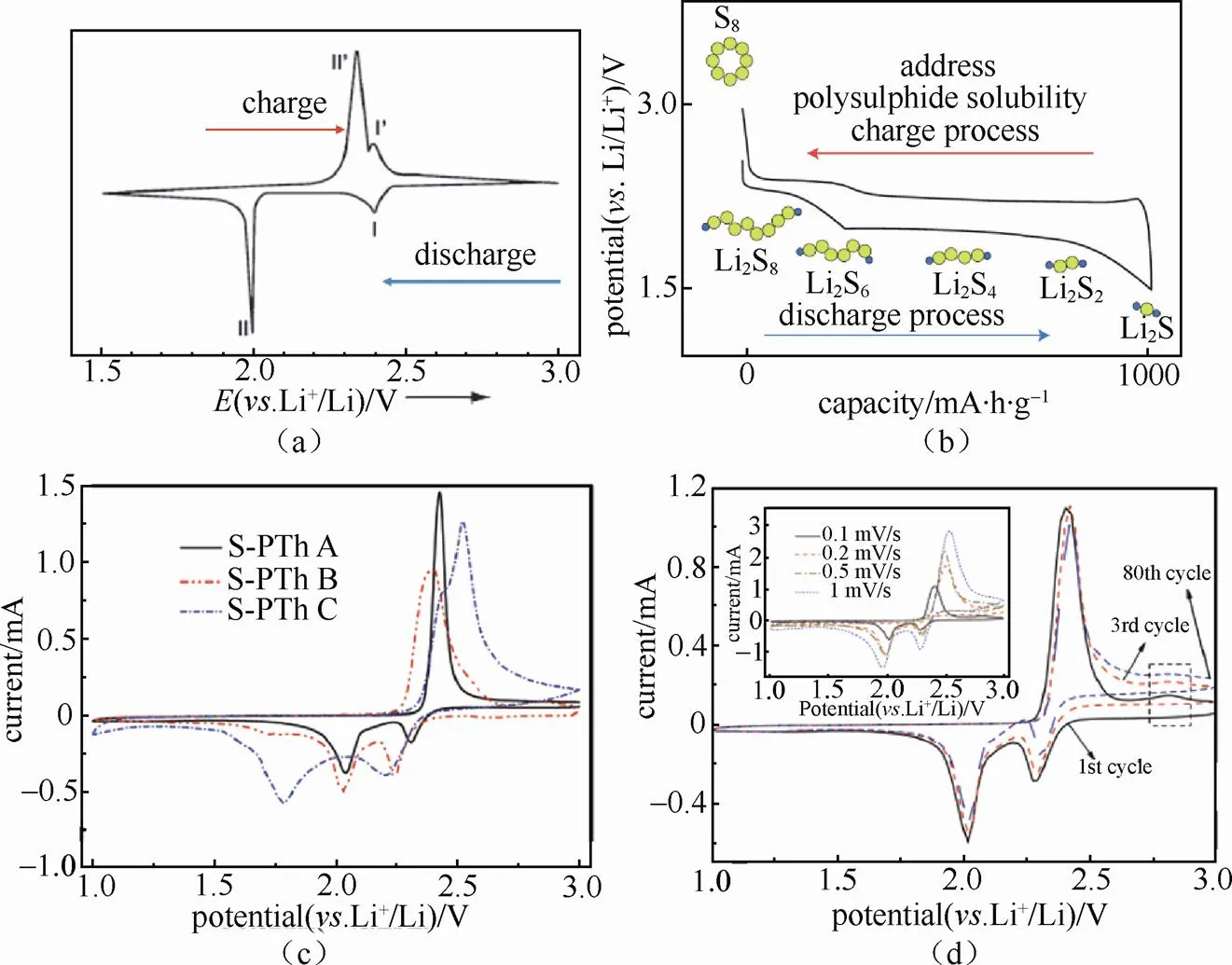
图7 典型的锂-硫电池的(a)CV曲线和(b)充放电曲线[18];(c)包覆不同含量聚噻吩后的锂-硫电池CV曲线,包覆量S-PTh A < S-PTh B < S-PTh C;(d)不同扫速以及不同周次下放入S-PTh B硫正极的CV曲线[17]
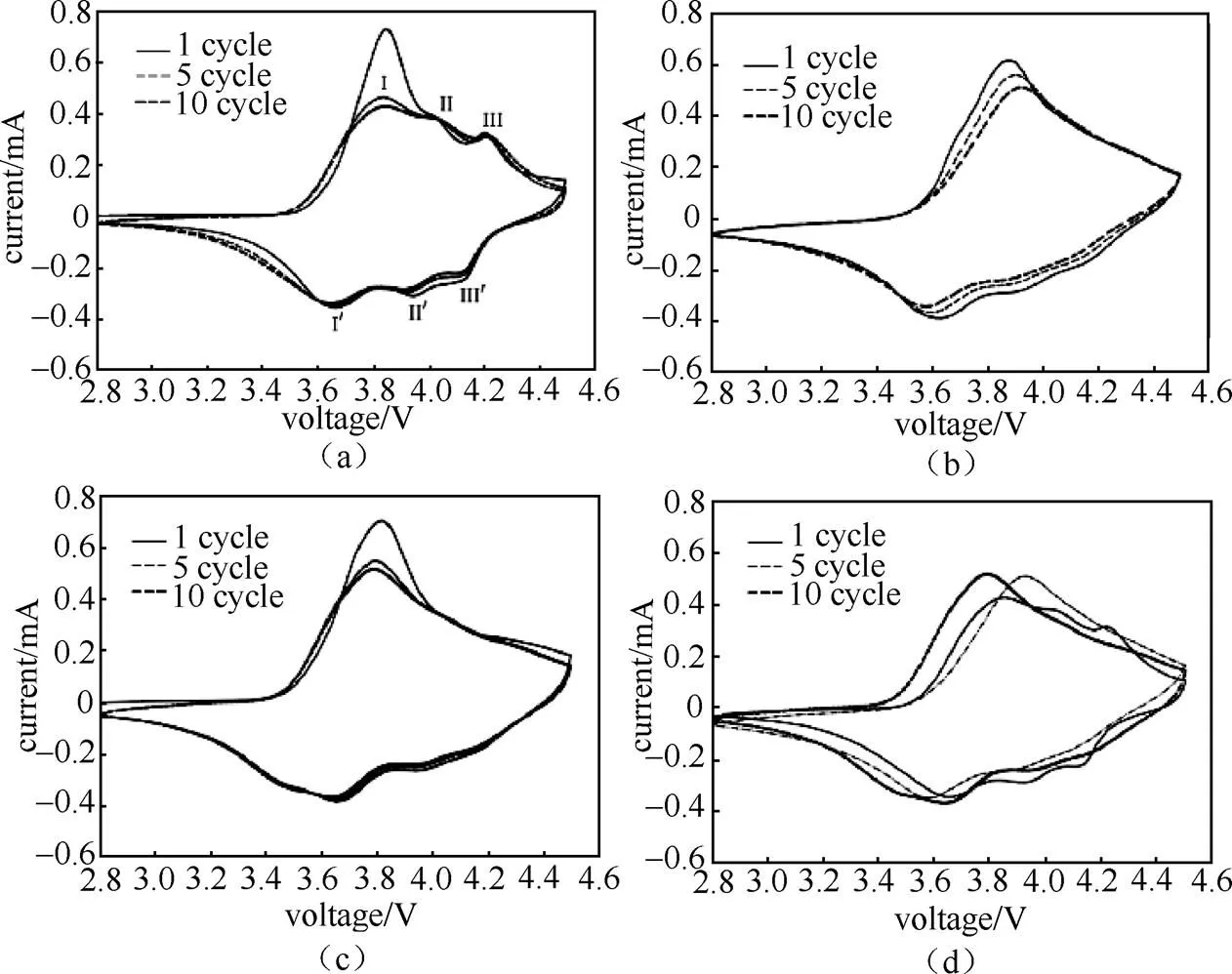
图8 不同元素掺杂的NCA材料与原始NCA材料的CV曲线对比(a)NCA;(b)Mn掺杂NCA;(c)Ti掺杂NCA;(d)不同NCA材料第10周的CV曲线[19]
类似于采用CV研究硫正极和NCA正极,CV也可用于其它正极材料如LiCoO2、LiMn2O4、LiNiVO4、LiFe0.5Mn0.5PO4等材料的脱/嵌锂机理以及反应可逆性研究[20-23]。
4.2.2 电极过程动力学研究
电极过程是包括多个步骤的复杂过程。由2.2节可知,当扩散过程为控制步骤且电极为可逆体系时,采用CV测量化学扩散系数满足Randle-Sevick方程。基本测量过程如下:①测量电极材料在不同扫速下的CV曲线;②将不同扫速下的CV峰值电流对扫描速率的平方根作图;③对峰值电流进行积分,测量样品中锂离子的浓度变化;④将相关参数带入Randle-Sevick方程,即可求得化学扩散系数。
这里需要特别注意:由于多孔粉末电极(单晶和外延薄膜电极除外)的真实电化学反应面积难以测量,且固体中参与离子输运的浓度也基本无法获得(显然不完全对应于化学计量比和锂的表观物质的量浓度),因此这里测得的化学扩散系数是表观化学扩散系数,不是材料的本征化学扩散系数。由于扩散系数是通过峰电流与扫速作图,而不是任一电位下的电流作图,公式(3)计算获得的主要是锂离子含量在对应峰位附近的电极所处状态下的表观化学扩散系数。这和GITT、EIS、PITT等方法能够测定在不同含锂量下材料的表观化学扩散系数不同,也不是材料嵌脱锂的平均表观化学扩散系数。因此,对于同一种电极材料及测量的电池,循环伏安获得的表观化学扩散系数和EIS、GITT、PITT获得的不同锂浓度的表观化学扩散系数不能对应比较,应该尽可能在锂含量接近的组成附近测量的数值进行对比。此外,由于CV方法不需要求得¶/¶,相对于EIS、GITT、PITT,减少了一个重要的误差来源,数据的一致性相对较好。对于不同的电极材料及不同设计的测量电池获得数据相互比较,由于真实表面积及浓度估算带来的误差和偏差,比较的结果的可信度也不高,除非严格控制,使得测量条件尽可能一致。
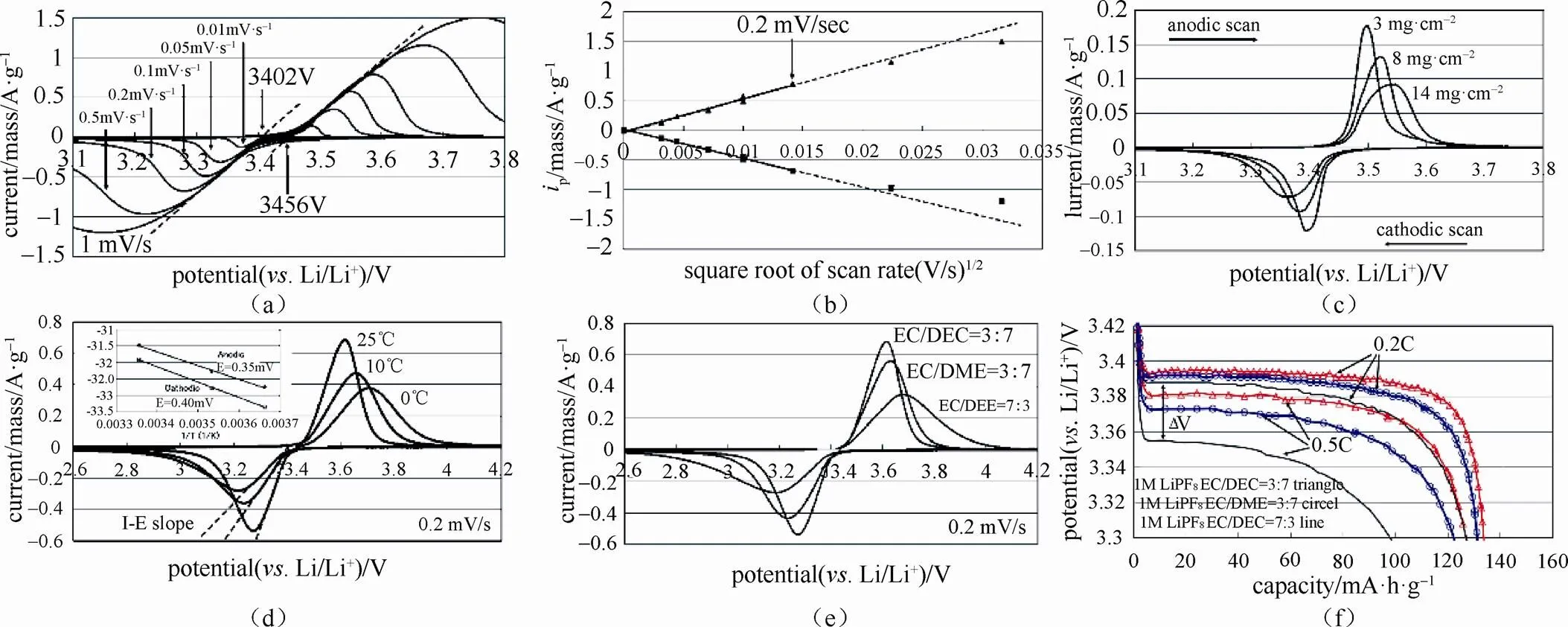
图9 (a)LiFePO4材料在不同扫速下的CV曲线;(b)峰值电流Ip随扫速平方根的关系;(c~e)CV曲线随极片负载量、温度、电解液组成的变化;(f)不同电解液组成体系的容量-电压曲线[24]

表2 利用CV测得的锂离子电池电极材料中锂离子扩散 系数[25]
此外,计算化学扩散系数,需要知道电极面积。一般对于多孔粉末电极,其真实面积远大于电极几何面积,因此难以精确测量(可以利用EIS的双电层电容来估算电化学真实反应面积),这给通过CV方法测量化学扩散系数带来了很大难度,也带来了很多不确定性因素,导致不同团队测量的数据可比性差。因此,对于通过CV方法测得的化学扩散系数绝对值的比较,只有在实验条件完全一致的条件才较为可靠。
4.2.3 电解液电化学稳定性的研究
(1)电解液电化学窗口的研究
LSV被广泛用于研究不同电解液体系稳定性的电化学窗口。如图10(a)~10(h)所示,扫描开始时,体系中没有氧化还原反应产生,随着电位增长,仅有少量的非法拉第电流,一旦体系内开始发生氧化反应,电流急剧增加,这表明电解液开始分解,此时的电位即为电解液电化学窗口的上限。PNNL的ZHANG等[31]研究了含1.0 mol/L LiPF6锂盐不同溶剂电解液,在使用不同工作电极时的电化学稳定性。他们对比了PC、EC、DMC、EMC溶剂单独使用以及混合使用时(3种常见体系:EC-DMC、EC-EMC、EC-DEC)的氧化电势。研究发现,在Pt电极体系下,氧化电位DMC(5.0 V)> EC(4.8 V)> PC(4.8 V)> EMC(4.6 V)[图10(a)],然而采用不同工作电极时4种溶剂的氧化电位以及相对大小都会发生很大的变化[图10(a)、10(c)、10(e)、10(g)]。这表明,实际电池体系中,电池材料的种类对电解液的稳定性存在较大影响。此外,研究发现,两种溶剂混合后会产生协同效应,混合溶剂的耐氧化电位可能高于两者单独使用时的氧化电位,如Pt电极体系,EC-DMC、EC-EMC与EC-DEC体系的氧化电位分别为5.1V、4.9V、5.0V[图10(b)]。与单溶剂体系类似,混合溶剂的氧化电位同样受工作电极种类的影响较大[图10(b)、10(d)、10(f)、10(h)][31]。
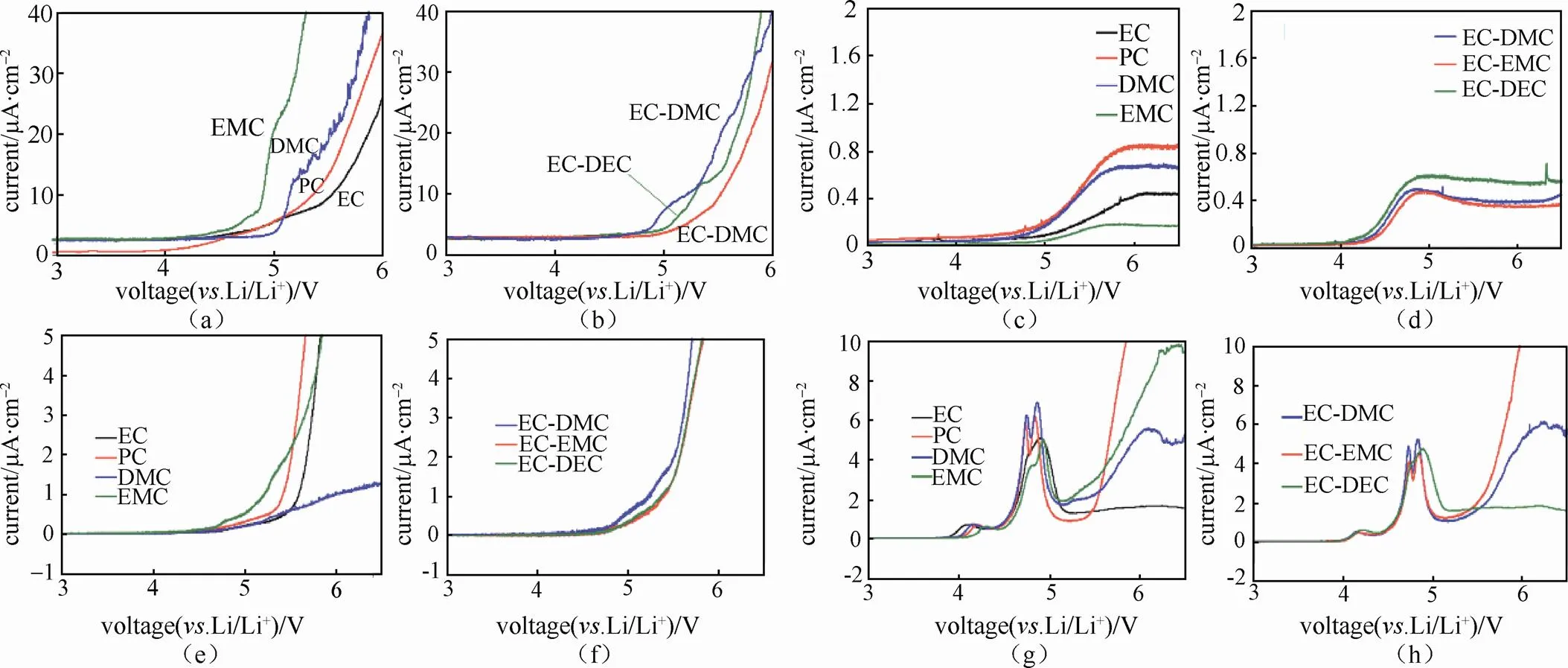
图10 1.0 mol/L LiPF6不同溶剂组成的电解液在0.1 mV/s扫速下的半电池LSV曲线,半电池的工作电极分别采用(a, b)Pt;(c, d)Al;(e, f) Super P-PVDF;(g, h)LiCr0.05Ni0.45Mn1.5O4-Super P-PVDF [31]
选择一定的锂电池体系,改变电解液的组成,测量CV曲线可以对比分析不同组成的电解液的电化学稳定性以及各成分比例对电解液电化学稳定性的影响。此外,通过不同周次的CV扫描,可以分析电解液在电池循环过程中的稳定性变化。REDDY等[32]采用CV使用惰性Pt电极以及PC: DMC(1∶1,体积比)电解液体系,比较了不同锂盐在0~5 V (. Li+/Li)电位区间内的电化学稳定性。如图11所示,不同电解液在0~5 V. Li+/Li范围内的电化学稳定性相差很大,其中,LiGasOTfd4、 LiBF4以及LiN(SO2CF2CF3)2锂盐电解液稳定性较好。

图11 PC: DMC(1∶1体积比)电解液体系中,添加不同锂盐后1.0~5.0 V电压范围内的CV曲线[32]
(2)电解液腐蚀集流体的研究
含LiPF6锂盐的电解液是目前商用锂离子电池最常用的电解液。但是LiPF6锂盐对水分敏感且热稳定性差,因此限制了电解液在一些应用领域的发展。双三氟甲烷磺酰亚胺锂(LiTFSI)和双氟黄酰亚胺锂(LiFSI)是具有良好稳定性锂盐,被认为有望替代LiPF6。但是LiTFSI和LiFSI腐蚀铝集流体,因而限制了其实际应用。针对LiTFSI/LiFSI基电解液对铝集流体腐蚀特性已有很多研究,CV是一种有效且常用的研究该反应过程和反应机制的手段。
图12展示了经过不同处理的LiFSI电解液的CV曲线。在该实验中,使用1 mol/L LiFSI EC∶DMC∶EMC(5∶2∶3,体积比)电解液体系,以金属锂片作为对电极和参比电极,直接固定在钨丝电极上,采用铝箔作为工作电极,装配三电极电池,使用辰华CHI660进行CV测量[33]。研究发现,电解液中氯离子(Cl-)的存在会加速电解液对铝箔的腐蚀,表现为Cl-含量高的电解液样品的CV曲线中氧化电流比Cl-浓度控制在1ppm(1ppm=10-6)以下的电解液高出一个数量级[图12(a)和12(b)]。研究发现,不同水含量也会影响电解液对铝箔的腐蚀,实验环境为潮湿空气,三电极难免受到水分的侵蚀,氧化电流随着测试的进行逐渐增大。相反,若电解液保持其水分含量不变,氧化电流逐渐减小,说明形成了一层钝化膜[图12(c)和12(d)]。如图12(e)所示,在电解液中Cl-含量低于1ppm 时,当电解液中水分含量较高时,CV中氧化电流仍然很大,说明水分也是影响铝箔腐蚀的关键因素。此外,研究发现,加入10%(体积分数)的BS添加剂后,CV中氧化电流明显降低,说明BS的加入可有效缓解LiFSI对铝箔的腐蚀[图12(f)][33]。
为了抑制LiTFSI电解液体系对铝集流体的腐蚀,XU等[34]研究了LiTFSI-LiBOB双盐体系电解液对铝集流体的腐蚀性行为。在该实验中,使用EC∶EMC(4∶6 质量分数)溶剂体系,铝箔作为工作电极,金属锂作为参比电极与辅助电极,使用CHI660C电化学工作站进行CV测试。如图13所示,在LiTFSI电解液的基础上,添加少量LiBOB的样品的CV曲线中氧化电流显著下降,这表明LiBOB的添加有效抑制了LiTFSI对铝集流体的腐蚀。其中,添加4%(质量分数)LiBOB的电解液,CV曲线中氧化电流峰会下降到与LiPF6电解液体系一样的水平,这表明LiTFSI对铝集流体的腐蚀被完全抑制。类似地,LI等[35]利用LSV研究了LiTFSI电解液腐蚀铝箔的行为,研究发现,加入纳米二氧化硅颗粒可以有效地减缓LiTFSI电解液对铝箔的腐蚀,并提出了可能的作用机制。
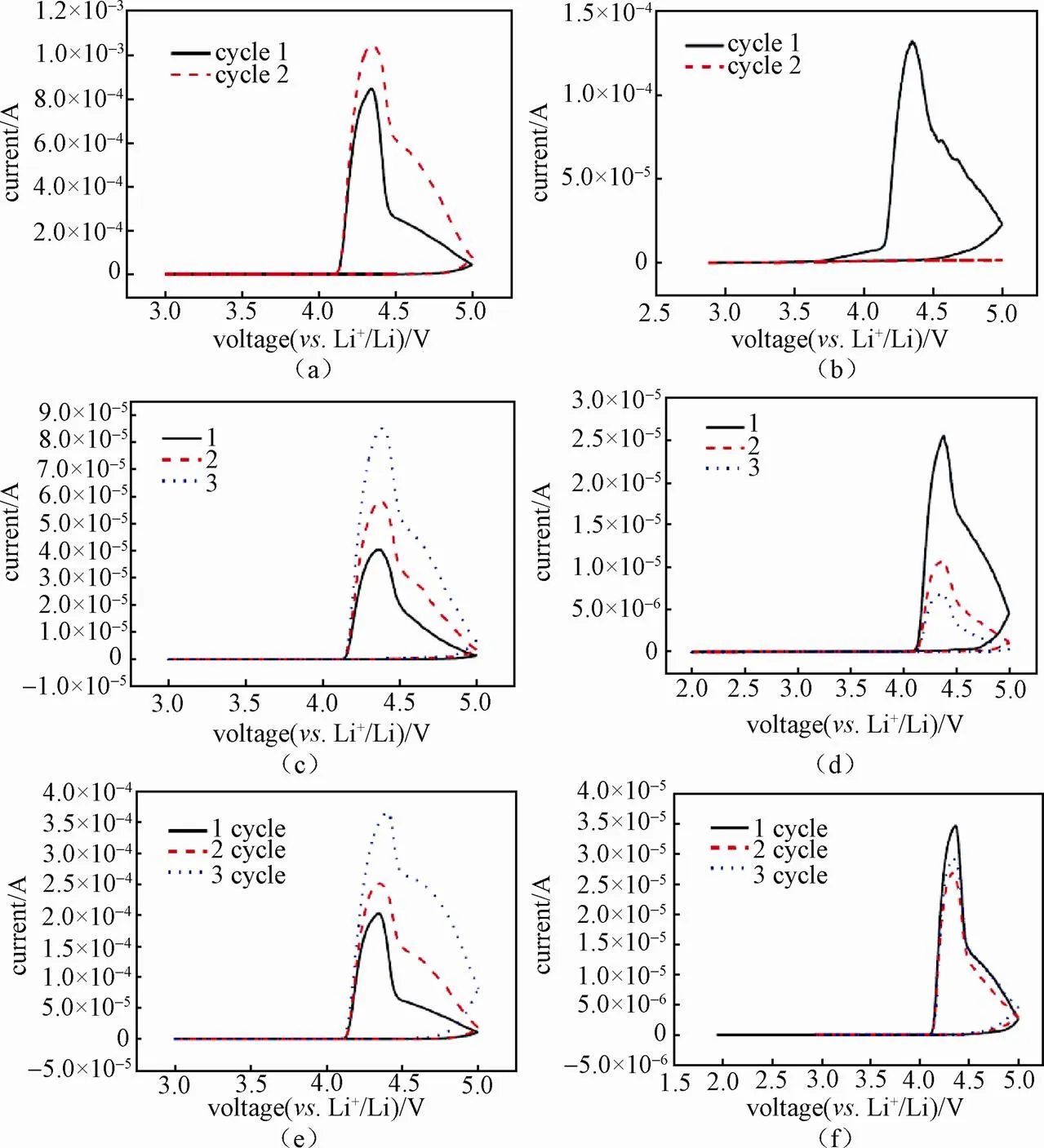
图12 CV曲线,使用1mol/L LiFSI in EC:DMC:EMC(5:2:3)电解液,铝箔作为工作电极,金属锂作为参比电极和对电极:(a)含有Cl-的电解液;(b)Cl-含量低于1 ppm的电解液;(c)潮湿空气环境中和(d)手套箱惰性气氛中测得的结果;(e)Cl-含量低于1 ppm,水分含量为37.7 ppm的电解液;(f)加入10% BS的电解液[33]
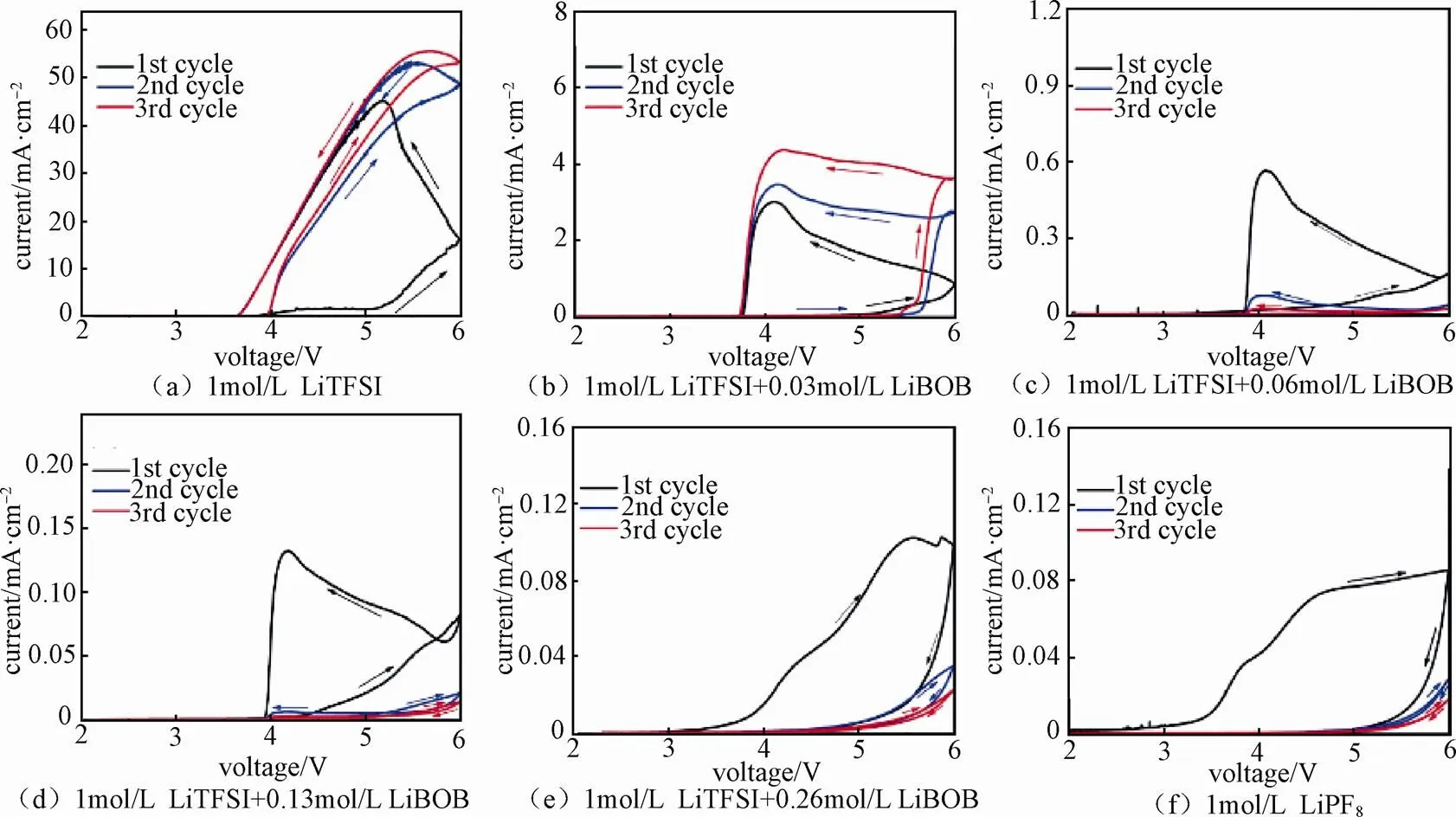
图13 添加不同含量LiBOB的1 mol/L LiTFSI in EC-EMC(4∶6质量分数)电解液以及1 mol/L LiPF6电解液体系在 2~6V(vs. Li+/Li)电位范围内的CV测试结果[34]
5 总 结
在锂离子电池的研发过程中,需要通过多种不同的表征测试方法来获取大量的有效信息,以帮助我们更好地了解新材料和新电池体系各方面的性能。循环伏安作为一种重要便捷的电化学表征方法,可以用来研究锂电池体系中的电极过程动力学以及电解液的电化学稳定性,得到以下重要信息:电极材料电化学反应机理及可逆性、电化学反应中氧化还原电位及平衡电位、极化情况、表观扩散系数、参与电化学反应的电子数、电解液的电化学窗口以及腐蚀性等。以上信息的获得对于理解锂电池体系中的电化学反应机理、设计新材料以及新电池体系具有指导性作用。这就需要对循环伏安进行标准规范地实验测试和数据分析,以获得客观真实的实验数据和有价值的分析结果。本文提出的一些具体的测试和数据分析建议是基于文献报道和实际工作获得的经验,未经过广泛的讨论和全面的论证。在此总结的目的,是希望并欢迎行业内专家批评指正,以共同提高我国锂电池循环伏安方法的实验测量和数据分析的可靠性,提高新材料和新电池体系研发的效率,共同推进我国锂电池及其他新型电池产业的发展。
[1] BARD A J, FAULKNER L R. Electrochemical methods: Fundamentals and applications[M]. New York: Wiley, 1980.
[2] PARk J K. Principles and applications of lithium secondary batteries[M]. New York: John Wiley & Sons, 2012.
[3] FUJISHIMA A. Electrochemical method: Various chemical sensors[J]. Bulletin of the Society of Sea Water Science Japan, 1989, 43: 200-207.
[4] 蒲国刚,袁倬斌,吴守国. 电分析化学[M]. 合肥: 中国科学技术大学出版社, 1993.
PU G G, YUAN Z B, WU S G. Electrochemical analysis[M]. Hefei: Science and Technology of China Press, 1993.
[5] SAUVAGE F, BAUDRIN E, MORCRETTE M, et al. Pulsed laser deposition and electrochemical properties of LiFePO4thin films[J]. Electrochemical and Solid State Letters, 2004, 7(1): A15-A18.
[6] XU Q, ZHAO T S, WEI L, et al. Electrochemical characteristics and transport properties of Fe(II)/Fe(III) redox couple in a non-aqueous reline deep eutectic solvent[J]. Electrochimica Acta, 2015, 154: 462-467.
[7] WANG S P, LIU Q L, YU J X, et al. Anisotropic expansion and high rate discharge performance of V-doped MnO2for Li/MnO2primary battery[J]. International Journal of Electrochemical Science, 2012, 7(2): 1242-1250.
[8] 王其钰, 褚赓, 张杰男, 等. 锂离子扣式电池的组装, 充放电测试和数据分析[J]. 储能科学与技术, 2018, 7(2): 327-344.
WANG Q Y, CHU G, ZHANG J N, et al. The assembly, charge-discharge performance measurement and data analysis of lithium-ion button cell[J].Energy Storage Science and Technology, 2018, 7(2): 327-344.
[9] VASSILIEV S Y, LEVIN E E, NIKITINA V A. Kinetic analysis of lithium intercalating systems: Cyclic voltammetry[J]. Electrochimica Acta, 2016, 190: 1087-1099.
[10] DOLLÉ M l, ORSINI F o, GOZDZ A S, et al. Development of reliable three-electrode impedance measurements in plastic Li-ion batteries[J]. Journal of The Electrochemical Society, 2001, 148(8): A851.
[11] LI H, HUANG X J, CHEN L Q, Anodes based on oxide materials for lithium rechargeable batteries[J]. Solid State Ionics, 1999, 123(1-4): 189-197.
[12] LI H, ZHU G Y, HUANG X J, et al. Synthesis and electrochemical performance of dendrite-like nanosized Sn Sb alloy prepared by co-precipitation in alcohol solution at low temperature[J]. Journal of Materials Chemistry, 2000, 10(3): 693-696.
[13] HANSEN S, QUIROGA-GONZALEZ E, CARSTENSEN J, et al. Size-dependent cyclic voltammetry study of silicon microwire anodes for lithium ion batteries[J]. Electrochimica Acta, 2016, 217: 283-291.
[14] OPITZ M, YUE J P, WALLAUER J, et al. Mechanisms of charge storage in nanoparticulate TiO2and Li4Ti5O12anodes: New insights from scan rate-dependent cyclic voltammetry[J]. Electrochimica Acta, 2015, 168: 125-132.
[15] PELED E, GORENSHTEIN A, SEGAL M, et al. Rechargeable lithium sulfur battery[J]. Journal of Power Sources, 1989, 26(3/4): 269-271.
[16] JEON B H, YEON J H, KIM K M, et al. Preparation and electrochemical properties of lithium-sulfur polymer batteries[J]. Journal of Power Sources, 2002, 109(1): 89-97.
[17] WU F, CHEN J Z, CHEN R J, et al. Sulfur/polythiophene with a core/shell structure: Synthesis and electrochemical properties of the cathode for rechargeable lithium batteries[J]. Journal of Physical Chemistry C, 2011, 115(13): 6057-6063.
[18] YIN Y X, XIN S, GUO Y G, et al. Lithium-sulfur batteries: Electrochemistry, materials, and prospects[J]. Angewandte Chemie-International Edition, 2013, 52(50): 13186-13200.
[19] WAN D Y, FAN Z Y, DONG Y X, et al. Effect of metal (Mn, Ti) doping on NCA cathode materials for lithium ion batteries[J]. Journal of Nanomaterials, 2018.
[20] ROUGIER A, STRIEBEL K A, WEN S J, et al. Cyclic voltammetry of pulsed laser deposited LiMn2O4thin films[J]. Journal of the Electrochemical Society, 1998, 145(9): 2975-2980.
[21] REDDY M V, PECQUENARD B, VINATIER P, et al. Cyclic voltammetry and galvanostatic cycling characteristics of LiNiVO4thin films during lithium insertion and re/de-insertion[J]. Electrochemistry Communications, 2007, 9(3): 409-415.
[22] HASHAMBHOY A M, WHITACRE J F. Li Diffusivity and phase change in LiFe0.5Mn0.5PO4: A comparative study using galvanostatic intermittent titration and cyclic voltammetry[J]. Journal of the Electrochemical Society, 2011, 158(4): A390-A395.
[23] XIE J, IMANISHI N, HIRANO A, et al. Kinetics investigation of a preferential (104) plane oriented LiCoO2thin film prepared by RF magnetron sputtering[J]. Solid State Ionics, 2007, 178(19/20): 1218-1224.
[24] YU D Y W, FIETZEK C, WEYDANZ W, et al. Study of LiFePO4by cyclic voltammetry[J]. Journal of the Electrochemical Society, 2007, 154(4): A253-A257.
[25] 凌世刚, 吴娇杨, 张舒, 等. 锂离子电池基础科学问题(Ⅷ)—电化学测量方法[J]. 储能科学与技术, 2015, 4 (1): 83-103
LING S G, WU J Y, ZHANG S, et al. Fundamental scientific aspects of lithium ion batteries(Ⅷ)—Electrochemical measurements[J]. Energy Storage Science and Technology, 2015, 4 (1): 83-103
[26] TANG S B, LAI M O, LU L. Li-ion diffusion in highly (003) oriented LiCoO2thin film cathode prepared by pulsed laser deposition[J]. Journal of Alloys and Compounds, 2008, 449(1/2): 300-303.
[27] Tang K, Yu X Q, Sun J P, et al. Kinetic analysis on LiFePO4thin films by CV, GITT, and EIS[J]. Electrochimica Acta, 2011, 56: 4869-4875.
[28] RUI X H, DING N, LIU J, et al. Analysis of the chemical diffusion coefficient of lithium ions in Li3V2(PO4)3cathode material[J]. Electrochimica Acta, 2010, 55(7): 2384-2390.
[29] DING N, XU J, YAO Y X, et al. Determination of the diffusion coefficient of lithium ions in nano-Si[J]. Solid State Ionics, 2009, 180(2/3): 222-225.
[30] RHO Y H, KANAMURA K. Li+ion diffusion in Li4Ti5O12thin film electrode prepared by PVP sol-gel method[J]. Journal of Solid State Chemistry, 2004, 177(6): 2094-2100.
[31] XU W, CHEN X L, DING F, et al. Reinvestigation on the state-of-the-art nonaqueous carbonate electrolytes for 5 V Li-ion battery applications[J]. Journal of Power Sources, 2012, 213: 304-316.
[32] REDDY V P, SMART M C, CHIN K B, et al. [sup 13]C NMR spectroscopic, CV, and conductivity studies of propylene carbonate-based electrolytes containing various lithium salts[J]. Electrochemical and Solid-State Letters, 2005. 8(6): A294.
[33] 周思思. 关于锂盐LiFSI与LiFNFSI的电解液研究[D]. 北京: 中国科学院大学, 2012.
[34] CHEN X L, XU W, ENGELHARD M H, et al. Mixed salts of LiTFSI and LiBOB for stable LiFePO4-based batteries at elevated temperatures[J]. Journal of Materials Chemistry A, 2014, 2(7): 2346-2352.
[35] LI Y X, ZHANG X W, KHAN S A, et al. Attenuation of aluminum current collector corrosion in LiTFSI electrolytes using fumed silica nanoparticles[J]. Electrochemical and Solid State Letters, 2004, 7(8): A228-A230.
Experimental measurement and analysis methods of cyclic voltammetry for lithium batteries
NIE Kaihui,GENG Zhen, WANG Qiyu,YUE Jinming,YU Xiqian,LI Hong
(Institute of Physics, Chinese Academy of Sciences, Beijing 100190, China)
Cyclic voltammetry (CV) is a very important electrochemical measurement method, which has been widely used in electrochemistry research especially for the study of lithium batteries. CV is commonly used to study the reversibility, mechanism and kinetic properties of electrode reactions in lithium batteries. Here, we overviewed the fundamental principles, experimental methods and the commonly used equipments for the CV measurement. Besides, its applications on the study of lithium batteries were introduced in detail, combing with practical experimental cases.
cyclic voltammetry; measurement method; electrochemistry; lithium batteries
10.12028/j.issn.2095-4239.2018.0067
TM 911
A
2095-4239(2018)03-0539-16
2018-04-02;
2018-04-14。
国家重点研发计划(2016YFB0100300,2016YFB0100100)以及中国科学院战略性先导科技专项(XDA09010000)。
聂凯会(1994—),女,硕士研究生,研究方向为锂离子电池层状正极材料的高电压行为与优化,以及锂电池失效分析,E-mail:niekaihui12138@163.com;
李泓,研究员,研究方向为高能量密度锂离子电池,固态电池及失效分析,E-mail:hli@iphy.ac.cn。

