PEO/LITFSI固态电解质的离子传输与压力构效关系
陈兵兵,赵井文,马 君,崔光磊
PEO/LITFSI固态电解质的离子传输与压力构效关系
陈兵兵,赵井文,马 君,崔光磊
(中国科学院青岛生物能源与过程研究所,山东 青岛 266101)
采用聚氧化乙烯/双三氟甲烷磺酰亚胺锂(PEO/LITFSI)固态电解质为研究对象,首次通过分子动力学方法模拟了压力对固态电解质模型构象和扩散系数的影响,揭示了外界压力与PEO/LITFSI中离子传输的构效关系。PEO聚合物链迴转半径和径向分布函数的模拟结果表明,压力升高将会导致PEO聚合物链呈现折叠现象,并且锂离子与TFSI-之间的相互作用变强,从而阻碍了锂离子在固态电解质中的传输。锂离子总均方位移的模拟结果进一步阐明了外界压力对锂离子扩散系数的影响:随着压力升高,离子扩散系数逐渐降低,离子的传输能力下降,但压力影响幅度小于锂盐浓度的影响。本工作将为固态电解质在高压力环境下的应用提供理论基础和指导。
PEO/LITFSI;压力;扩散;分子模拟
众所周知,高能量密度的深海动力电池是水下装备的关键部件之一,其性能将直接影响水下装备的技术水平和可靠性等。但是,目前国内使用的银锌电池能量密度较低,难以突破深海动力电池长续航的瓶颈。相比之下,锂离子电池(LIBs)具有高能量密度、长循环寿命等特点,且被广泛应用于便携式电子产品、电动汽车等商业化设备[1-3],优势明显。2004年日本研发了用于Shinkai6500深潜器的大容量充油压力补偿式LIBs[4],并顺利完成海试。然而,传统LIBs往往采用易燃烧,易挥发的有机电解液[5-6],存在严重的安全隐患,制约了其进一步的广泛应用[7]。更重要的是,在深海或其它高压环境下,含有机液体的LIBs无法承受外界压力,容易发生结构坍塌和电解液泄漏,进而造成电池失效,甚至爆炸[8],严重限制了其在特种储能系统中的应用。最新的研究进展表明,以固态电解质取代传统液体有机电解质[9-14],可有效解决传统LIBs的安全隐患,并有望使LIBs承受较大的深海压力。因此,全固态锂电池是长续航、高安全深海装备的理想的动力能源。近年来,研究人员高度关注高能量密度全固态锂电池在深海潜水器等领域的应用。例如,中国科学院青岛生物能源与过程研究所崔光磊等[15]研发的固态聚合物锂电池已经顺利完成万米海深的示范,极大推进了全固态锂电池在特殊环境下的应用。
全固态锂电池的核心部件是固态电解质。当固态电解质的室温离子电导率达到10-3S/cm时,即可达到现有的LIBs液态电解质水平[16-17]。1979年,WRIGHT等[18]首次将聚氧化乙烯(PEO)与锂盐的配合物用作LIBs固态电解质,并发现其具有离子导电性。ARMAND等[19]报道了PEO/碱金属盐在40~60 ℃时离子电导率达10-5S/cm,进而引起研究者的广泛兴趣。PEO聚合物电解质具有宽电化学窗口、高离子迁移数等优点,使其成为研究最为广泛的聚合电解质[20-22]。据报道,与PEO络合的金属锂盐中的阴离子半价越大,其阴离子与锂离子(Li+)的距离越远,它们之间的键合作用越弱,则Li+解离度越高,从而导致它具有更高的电导率和离子迁移数[23-24]。由于双三氟甲烷磺酰亚胺锂(LITFSI)中TFSI-半径较大,所以它的离子电导率较高。更重要的是,LITFSI具有很好的热稳定性。因此,对PEO与锂盐LITFSI配合作用时Li+迁移规律和电导率的研究较为广泛[25-26]。例如,BORODIN等[27]通过分子动力学研究了Li+在PEO中的迁移机制和运动规律。虽然科学界对PEO/LITFSI电解质的机理研究较为充分,但对于在高压力环境下Li+的电导率及压力对其影响规律的研究鲜有报道。
本文将选择PEO/LITFSI聚合物固态电解质为计算模型,以分子动力学为主要研究手段,探究离子电导率与压力的构效关系,以期从新的角度深入理解PEO/LITFSI固态电解质中Li+的传输行为。通过对不同组分的PEO/LITFSI进行结构优化和理论分析,构建了PEO/LiTFSI模型体系。进而通过计算PEO/LiTFSI聚合物电解质中Li+的均方位移,揭示了压力对PEO/LiTFSI电解质的离子传输行为的影响,为固态锂电池在高压特殊环境的应用提供理论基础。
1 计算模型和方法
1.1 模型参数
考虑到Li+是沿着高分子链迁移,本文选择一个相对较长的PEO链作为结构模型,如图1(a)所示。其中每条PEO链包含54个重复基本单元。为选取合适PEO/LITFSI模型,我们选取了PEO与LITFSI数量比为7.5、10、29三种结构模型,即在PEO/LITFSI结构模型中,PEO聚合物链与LiTFSI的数量比分别为:9∶65、9∶48、9∶14,其结构优化后模型如图1所示。
1.2 计算模拟方法
采用上述模型结构参数构建PEO/LITFSI周期性结构模型,对其进行分子动力学模拟。本文主要用退火方法[28]来加速PEO/LITFSI的结构平衡。具体模拟方法为:在20 ns内进行10次升温和降温过程,进而获得能量较低的初始结构,然后在2 ns内进行动力学计算得到最终的PEO/LITFSI平衡结构。其中,退火过程采用NVT系综,动力学过程采用NPT系综。采用NVT系综时控压方式为Berendsen法,时间常数为0.5 ps;采用NPT系综时控温方式为V-rescale方法,时间常数为0.1 ps;静电相互作用采用Eward算法,其中力的相对误差为10-5。采用文献中力场[29],范德华力VDW中截断半径是1.8 nm,模拟步长为1 fs。其中,NPT系综下,本文采取温度为300 K、330 K、360 K、390 K,压力取值为 0 MPa、50 MPa、100 MPa、150 MPa。
1.3 扩散系数
扩散系数是用来描述粒子的扩散能力的重要参数。其中,扩散系数的大小主要取决于扩散物质和扩散介质的种类及其温度和压力。本文主要讨论Li+在固态电解质PEO/LITFSI的扩散能力。通过对粒子的总均方位移进行分析,可以有效地评估Li+的扩散系数,进而提供Li+在聚合物电解质PEO/LITFSI扩散能力的重要数据。离子的扩散系数D通过Einstein方程可以得到:
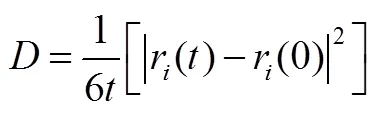
式中,r()表示原子在时刻的位置。
2 计算结果与讨论
2.1 PEO与络合的锂盐LiTFSI的构象及其随压力的变化规律
图2(a)~(b)为退火后2 ns动力学过程的能量和温度平衡模拟结果。在NPT系综下2 ns,压力为0,动力学平衡后,PEO/LITFSI体系的总能量和温度并未发生明显的波动,可以认为PEO/LITFSI结构模型体系在此退火模拟和动力学平衡条件下总能量和温度均达到收敛,满足分子动力学的计算要求。据文献报道,PEO/LITFSI中Li+电导率在模拟温度为393 K时与室温下实验值一致。因此,为阐述压力对PEO/LITFSI的模型构型影响,我们在NPT系综下对PEO/LITFSI体系分别施加0 MPa、50 MPa、100 MPa、150 MPa压力,温度为393 K下进行动力学模拟。图2(c)表示为不同压力下PEO聚合物链的构型的变化情况。随着压力的增加(0~150 MPa),PEO聚合物链的迴转半径逐渐减小。另外,从其微观构象显示,压力的增加导致了PEO链扭曲和折叠,这将不利于Li+的传输。图2(d)为0 Mpa压力下,锂盐浓度与PEO聚合物链迴转半径的变化关系。可以看出,随着锂盐LITFSI浓度的增加,PEO聚合物链的迴转半径也将逐渐减小。这一结果表明,LITFSI浓度的增加,使得其与PEO结合更加紧密,并且PEO聚合物链变得更加扭曲。因此,我们进一步对压力作用下锂盐LITFSI与PEO聚合物链之间的微观作用机制进行探讨。
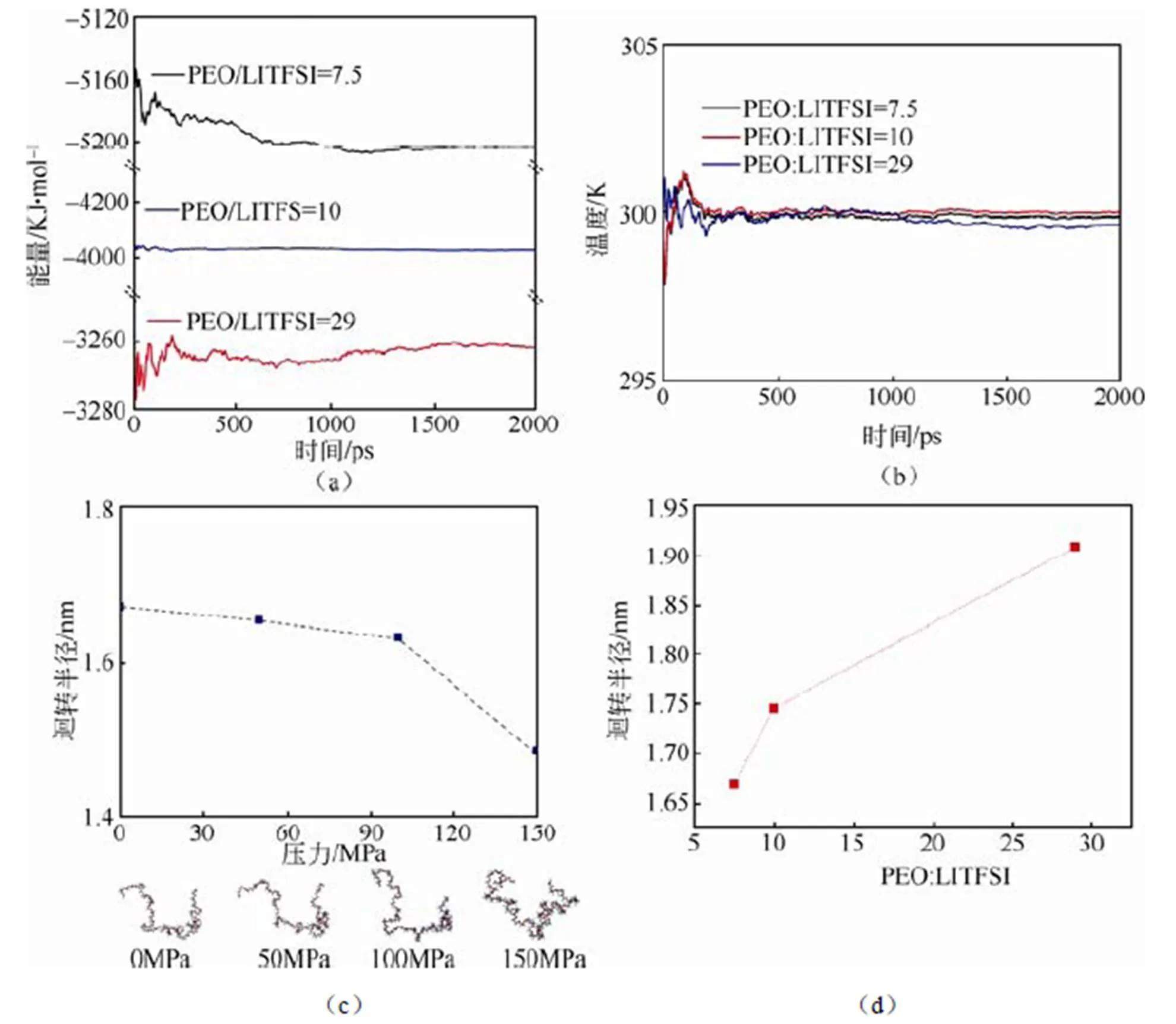
图2 (a)动力学平衡体系能量变化,(b)动力学平衡体系温度变化,(c)393 K时外界压力对PEO聚合物链迴转半径的关系,(d)锂盐LITFSI浓度对PEO聚合物链迴转半径的关系
2.2 不同压力下LITFSI在PEO聚合物周围的分布
采用径向分布函数()来描述锂盐LITFSI在聚合物PEO聚合物链周围的统计分布情况。()主要可以用来反映LITFSI中离子或者基团围绕PEO聚合物链中一个离子或者基团的分布情况。当径向分布函数中的值越低,函数()值越高,其LITFSI与PEO聚合物链结合越紧密。本文计算了不同压力和不同锂盐浓度下,LITFSI在PEO聚合物链表面的分布情况,如图3所示。图3(a)给出了LITFSI中的Li+在PEO周围的分布。从图中可看出,在0 MPa时Li原子与PEO中O原子第一个峰的距离为1.62 Å,其与BORODIN等[27]计算和实验所观察到的结果一致。此外,从图3(a)可以看出随着压力逐渐增加,Li+与PEO中O原子第一个峰位置的距离逐渐增大,表明Li+与PEO的键合作用逐渐减弱。然而,Li+与TFSI-阴离子之间结合随着压力的增加则变强[图3(b)]。上述结果表明,压力的增加将限制Li+在PEO中的传导。此外,随着锂盐浓度的增加,Li+与TFSI-之间的结合力更强,从而降低Li+的解离度,进一步阻碍Li+的传输[图3(c~d)]。因此,需要进一步讨论压力作用下Li+在PEO/LITFSI中扩散规律。
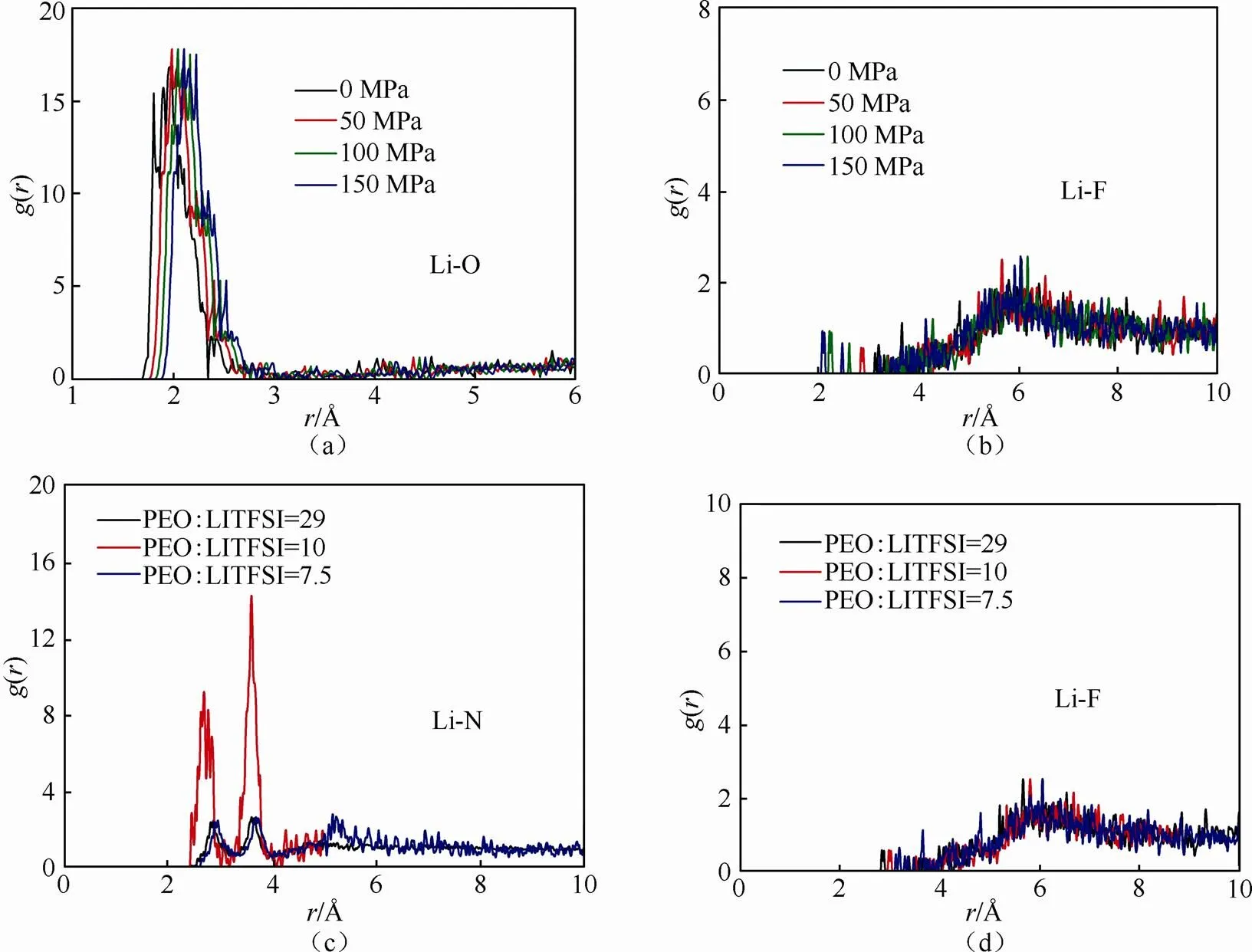
图3 PEO聚合物链与LITFSI中离子之间的径向分布函数的关系:(a)压力作用下Li-O之间的径向分布函数的关系,(b)压力作用下Li-F之间的径向分布函数的关系径向分布函数的关系,(c)锂盐LITFSI浓度与LITFSI中Li-N的径向分布函数的关系,(d)锂盐LITFSI浓度与LITFSI中Li-F离子的径向分布函数的关系
2.3 外界压力对PEO/LiTFSI中离子扩散的影响 规律
进一步分析了在上述PEO/LITFSI模型中,外界压力对Li+在PEO/LiTFSI中的扩散能力的影响,结果如图4~5所示。
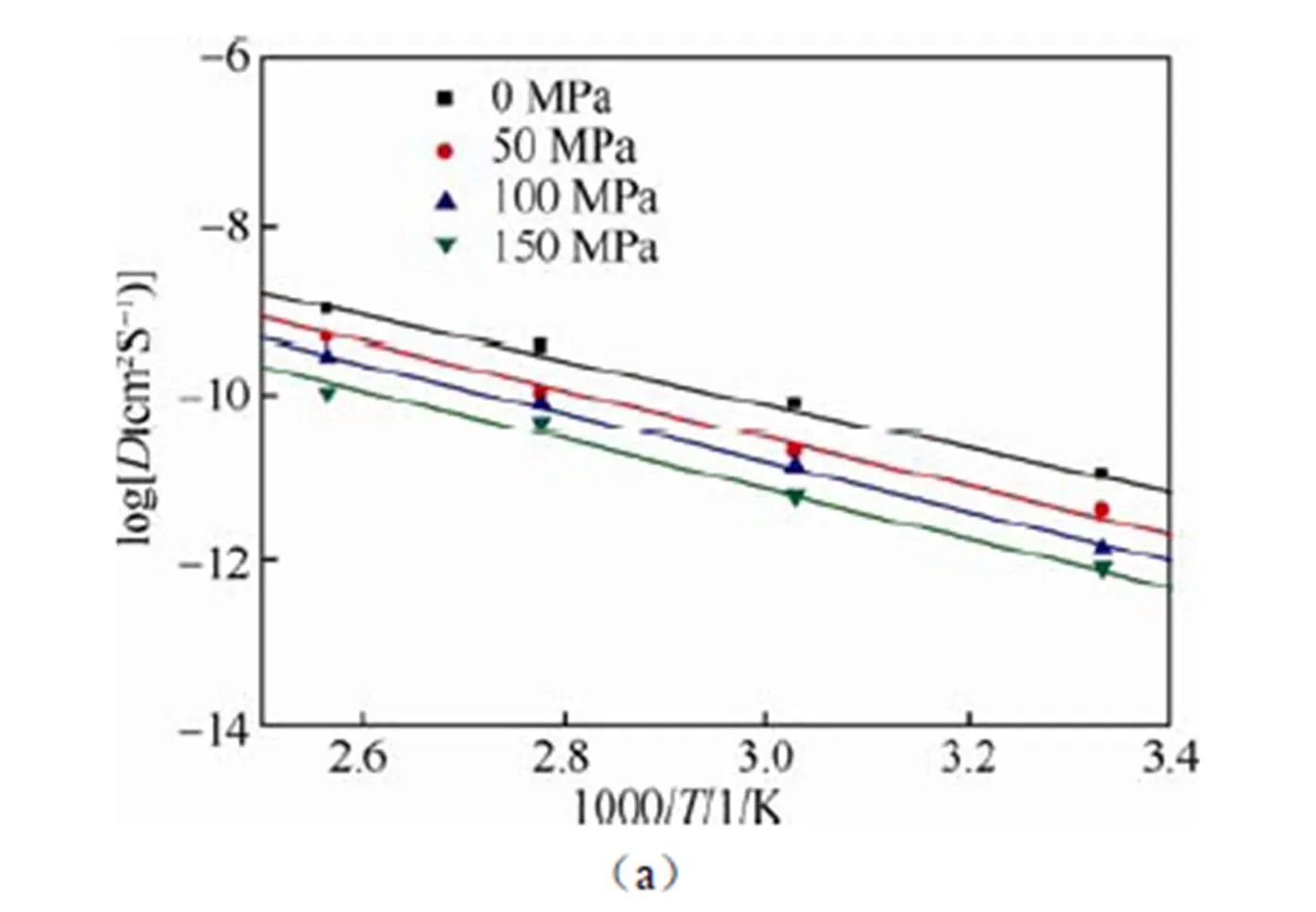
图4(a)给出了PEO/LITFSI中Li+总的均方位移与压力变化的关系。Li+在PEO/LITFSI中总的均方位移(MSD)随着压力的增加而逐渐减少,这将不利于Li+的传导。另外,图4(b)给出不同锂盐LITFSI浓度下,PEO/LITFSI中Li+总的均方位移。在一定范围内随着LITFSI的浓度增加,其总的MSD增加的趋势逐渐降低,表明在一定范围内PEO/LITFSI中Li+的扩散系数将随着锂盐LITFSI浓度的增加而逐渐减少。另外,压力的增加会降低Li+总均方位移的升高幅度,导致其Li+扩散速率降低,如图4(a)所示。我们发现无论LITFSI浓度是否增加,外界压力都会降低体系的离子电导率。根据式(1)以及Arrhenius方程,可以知道在PEO/LITFSI聚合物电解质中Li+电导率随着压力的增加而减少,进而拟合出不同压力及锂盐LiTFSI浓度下扩散系数D的变化规律,如图5所示。随着压力的增加,Li+的扩散系数逐渐减小,进而降低了离子的传输能力。同样,随着LITFSI浓度的增加,PEO/LITFSI中Li+的扩散系数也逐渐减少,表明一定范围内离子的传输能力随着LITFSI浓度的增加而降低[图5(b)]。这些结果与上述Li-PEO及Li-TFSI之间的相互作用较为吻合。更重要的是,我们发现在PEO/LITFSI固态电解质中压力对离子传输的影响幅度要低于锂盐浓度所带来的影响。
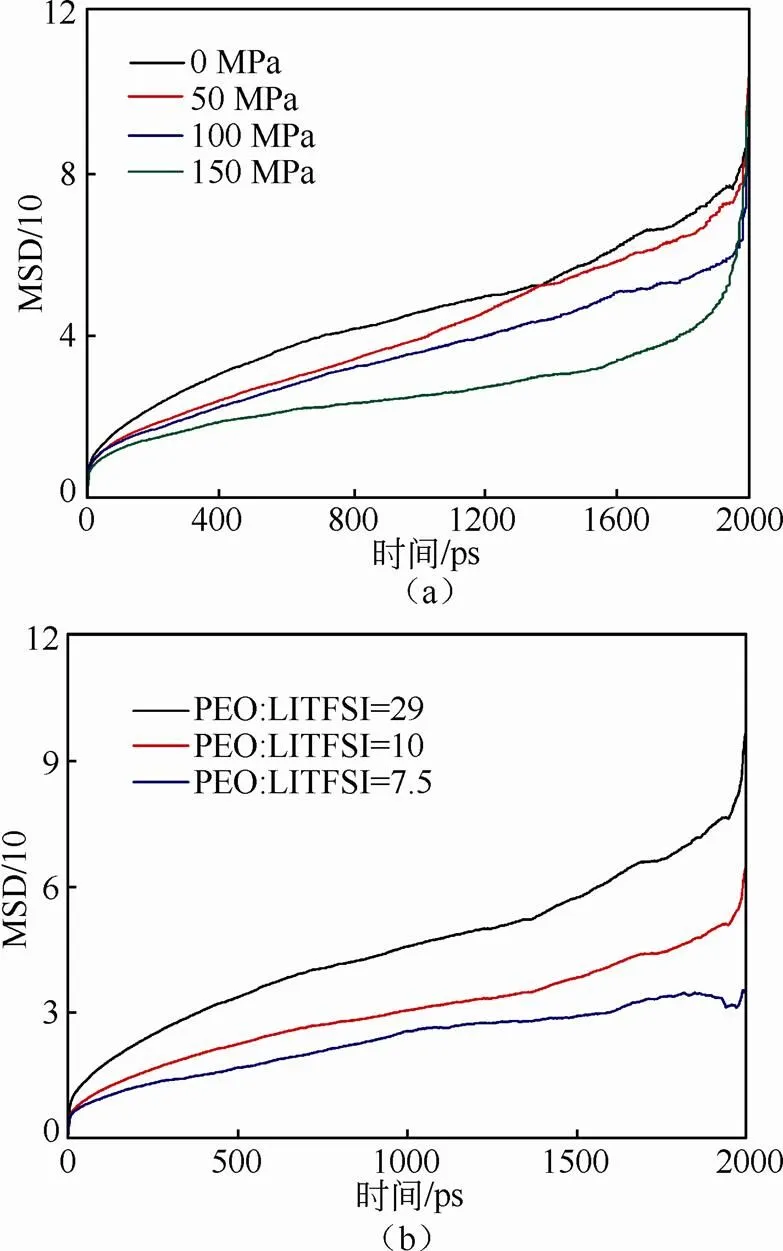
图4 (a)压力与体系中Li+总的均方位移的关系,(b)锂盐浓度与体系中Li+总的均方位移的关系
3 结 论
本文通过分子动力学方法模拟了外界压力作用下固态聚合物电解质PEO/LITFSI的电导率变化规律。通过对PEO聚合物链的迴转半径模拟结果进行分析,发现外界压力的增加会引起PEO/LITFSI模型中PEO聚合物链折叠,使PEO链扭曲,影响离子传输。另外,压力的升高导致PEO与LITFSI之间相互作用加强,阻碍Li+的传导。更重要的是,通过径向分布函数()分析可以发现,压力增加导致锂盐LITFSI中Li+与TFSI-具有更强的结合能,不利于Li+在PEO/LITFSI固态电解质中的传输。随着锂盐LITFSI浓度的增加,此现象更为明显。进一步通过Li+总的均方位移获得Li+在PEO/ LITFSI中的电导率。从总的均方位移可以看出,随着压力或锂盐浓度的增加,Li离子的电导率呈下降趋势,印证了计算模型构象及组分之间相互作用的结果。此外,我们发现锂盐LITFSI浓度对电导率的影响远高于外界压力的影响,并且压力在0~150 MPa内,扩散系数变化趋势较小,将会导致离子电导率下降相对比较平缓,对PEO/LITFSI聚合物电解质本身的影响较小。上述结果通过调控压力和锂盐浓度来获得其与固态电解质中离子电导率的构效关系,为固态电解质应用于高压力环境提供了理论依据和 参考。
[1] YUE L, MA J, ZHANG J, et al. All solid-state polymer electrolytes for high-performance lithium ion batteries[J]. Energy Storage Materials, 2016, 5(5): 139-164.
[2] ZHOU H. New energy storage devices for post lithium-ion batteries[J]. Energy & Environmental Science, 2013, 6(8): 2256- 2256.
[3] 李泓, 李晶泽, 师丽红, 等. 锂离子电池纳米材料研究[J]. 电化学, 2000, 6(2): 131-145.
LI Hong, LI Jingze, SHI Lihong, et al. The studies on nanosized materials for lithium ion batteries[J]. Electrochemistry, 2000, 6(2): 131-145.
[4] 韩棠. 深海6500载人潜水器[J]. 模型世界, 2012, 7: 54-55.
[5] LU L, HAN X, LI J, et al. A review on the key issues for lithium-ion battery management in electric vehicles[J]. Journal of Power Sources, 2013, 226(3): 272-288.
[6] PATEL M, BHATTACHARYYA A J. A crosslinked “polymer-gel” rechargeable lithium-ion battery electrolyte from free radical polymerization using nonionic plastic crystalline electrolyte medium[J]. Energy & Environmental Science, 2011, 4(2): 429-432.
[7] 陈立泉. 电动车锂离子电池的材料问题[J].中国工程科学, 2002, 4(11): 32-36.
CHEN Liquan. Lithium batteries for electric vehicles[J]. Engineering Science, 2002, 4(11): 32-36.
[8] ELLIOTT J A. High pressure materials as electrodes for lithium batteries: A computational and experimental approach[J]. Acta Crystallographica, 2006, 62(a1): 105.
[9] XIN S, YOU Y, WANG S, et al. Solid-state lithium metal batteries promoted by nanotechnology: Progress and prospects[J]. Acs Energy Letters, 2017, 2(6): 1385-1394.
[10] YANG J, MUHAMMAD S, JO M R, et al. In situ analyses for ion storage materials[J]. Chemical Society Reviews, 2016, 47(47): 5717-5770.
[11] LIU X, DING G, ZHOU X, et al. An interpenetrating network poly(diethylene glycol carbonate)-based polymer electrolyte for solid state lithium batteries[J]. Journal of Materials Chemistry A, 2017,
5(22): 11124-11130.
[12] HU P, CHAI J, DUAN Y, et al. Progress in nitrile-based polymer electrolytes for high performance lithium batteries[J]. Journal of Materials Chemistry A, 2016, 4(26): 10070-10083.
[13] INDA Y, KATOH T, BABA M. Development of all-solid lithium-ion battery using Li-ion conducting glass-ceramics[J]. Journal of Power Sources, 2007, 174(2): 741-744.
[14] ZHU Z, HONG M, GUO D, et al. All-solid-state lithium organic battery with composite polymer electrolyte and pillar[5]quinone cathode[J]. Journal of the American Chemical Society, 2014, 136(47): 16461-16464.
[15] 佚名. 我国全海深固态锂电池完成万米海试[J]. 新材料产业, 2017, 5: 83.
[16] CHENG X, ZHANG R, ZHAO C, et al. A review of solid electrolyte interphases on lithium metal anode[J]. Advanced Science, 2016, 3(3): 1500213-1500233.
[17] CHE H, CHEN S, XIE Y, et al. Electrolyte design strategies and research progress for room-temperature sodium-ion batteries[J]. Energy & Environmental Science, 2017, 10(5): 1075-1101.
[18] WRIGHT P V. Polymer electrolytes—The early days[J]. Electrochimica Acta, 1998, 43(10/11): 1137-1143.
[19] ARMAND M B, CHABAGNO J M, DUCLOT M, et al. Fast ion transport in solids[M]. New York: Elsevier, 1979: 131.
[20] WATANABE M, ENDO T, NISHIMOTO A, et al. High ionic conductivity and electrode interface properties of polymer electrolytes based on high molecular weight branched polyether[J]. Journal of Power Sources, 1999, 81(9): 786-789.
[21] JUNG S, KIM D W, SANG D L, et al. Fillers for solid-state polymer electrolytes: Highlight[J]. Bulletin- Korean Chemical Society, 2009, 30(10): 2355-2361.
[22] GORECKI W, JEANNIN M, BELORIZKY E, et al. Physical properties of solid polymer electrolyte PEO(LiTFSI) complexes[J]. Journal of Physics Condensed Matter, 1995, 7(34): 6823-6832.
[23] APPETECCHI G B, ZANE D, SCROSATI B. PEO-based electrolyte membranes based on LIBsC4O8salt[J]. Journal of the Electrochemical Society, 2004, 151(9): A1369-A1374.
[24] CROCE F, SETTIMI L, SCROSATI B, et al. Nanocomposite, PEO-LIBsOB polymer electrolytes for low temperature, lithium rechargeable batteries[J]. Journal of New Materials for Electrochemical Systems, 2006, 9(1): 3-9.
[25] REY I, LASSÈGUES J C, GRONDIN J, et al. Infrared and Raman study of the PEO-LiTFSI polymer electrolyte[J]. Electrochimica Acta, 1998, 43(10): 1505-1510.
[26] EDMAN L. Ion association and ion solvation effects at the crystalline-amorphous phase transition in PEO@LiTFSI[J]. Journal of Physical Chemistry B, 2000, 104(31): 7254-7258.
[27] OLEG BORODIN A, GRANT D S. Mechanism of ion transport in amorphous poly(ethyleneoxide)litfsi from molecular dynamics simulations[J]. Macromolecules, 2014, 39(4): 1620-1629.
[28] YANG C, LU D, LIU Z. How PEGylation enhances the stability and potency of insulin: A molecular dynamics simulation[J]. Biochemistry, 2011, 50(13): 2585-2593.
Relationship of ion transport and pressure in PEO /LITFSI solid electrolytes
CHEN Bingbing, ZHAO Jinwen, MA Jun, CUI Guanglei
(Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong, China)
The relationship of ion transport and pressure in poly(ethylene oxide)/lithium salts(PEO/LITFSI) solid polymer electrolyte with different lithium salts concentration is firstly simulated by molecular dynamics (MD) method. Our simulation results demonstrate that the PEO polymer chains fold with the increased pressure, which will increase the interaction between lithium ions and TFSI anions and thus hinders the lithium ions transport in PEO/LITFSI solid electrolyte. Moreover, the molecular simulation results show a reduced lithium-ion diffusion coefficient and decreased ion transport ability in PEO/LITFSI under increased pressure. The present study will offer a theoretical basis for the applications of these solid electrolytes in high pressure environment.
PEO/LITFSI; pressure; diffusion; molecular dynamics
10.12028/j.issn.2095-4239.2018.0004
TM 911
A
2095-4239(2018)03-0431-06
2018-01-15;
2018-03-22。
国家自然科学基金项目(51502319)。
陈兵兵(1990—),男,博士研究生,主要从事固态电解质理论计算,E-mail:chenbb@qibebt.ac.cn;
崔光磊,研究员,主要从事低成本高效能源储存与转换器件的研究,E-mail:cuigl@qibebt.ac.cn。

