秋水仙素诱导百合多倍体及流式细胞仪倍性鉴定研究
陈敏敏,周 音,孙亿敬,李 心,张建军*
(1上海市农业科学院林木果树研究所,上海 201403;2台州学院生命科学学院,台州 318000)
百合(Lilium spp.)为百合科百合属多年生球根植物,原产中国,主要分布于亚洲东部、欧洲、北美洲等北半球温带地区,全球已发现120个种以上,其中55种原产于中国。提高百合的观赏性是目前种质资源创新的重要目标,多倍体育种技术能显著增加花朵大小,增加叶片厚度,加深花瓣颜色,延长开花时间,从而提高花卉的观赏性和商品价值[1]。目前,百合离体诱变育种的研究多集中在直接对实生苗进行化学试剂处理或对种子、未成熟胚[2]、鳞片、叶片采用秋水仙素处理,诱导再生小鳞茎或丛生苗[3-4]等方面,且再生途径多为器官发生途径,其不定芽再生率低,通过这一途径获得的百合诱变植株数量较少。相比之下,体细胞胚胎发生体系具有明显优势,可在短时间内获得大量的再生植株,提高选择基数,是离体化学诱变的优良再生体系。
流式细胞技术(Flow cytometer,FCM)是20世纪80年代兴起的新技术,通过流式细胞分析仪对大量的处于分裂间期的细胞DNA含量进行检测,然后经计算机自动统计分析,最后绘制出DNA含量(倍性)的分布曲线图[5]。该方法不受植物体取材部位和细胞所处时期限制,可以是叶片、茎、根、花、果皮、种子等,也可以选取离体培养过程中的小植株或愈伤组织,组培苗叶片仅用1 cm2的样品就可确定其倍性,且准确率高[6]。本研究以高效稳定的百合根体细胞胚胎发生体系为基础,以秋水仙素为加倍剂,在已建立百合体细胞胚胎发生体系的基础上创制观赏百合新种质,并利用流式细胞技术鉴定百合倍性,在优化细胞裂解液、滤膜目数、离心次数、材料来源的基础上,结合形态学、解剖学等常规方法,对经秋水仙素诱导处理的观赏百合再生植株进行倍性鉴定,为百合科植物多倍体诱导及鉴定提供参考,同时为百合新品种选育提供基础。
1 材料与方法
1.1 试验材料
供试材料为东方百合品种 ‘索邦’(Sorbonne)(2n=2x=24)和‘康卡多’(Concad’Or)(3n=3x=36)[7]。
1.2 试验方法
1.2.1 百合多倍体诱导处理
以本实验室前期获得的百合品种‘索邦’的胚性愈伤组织[8]作为诱导加倍材料,将胚性愈伤组织用0.1 mg/L、0.25 mg/L、0.5 mg/L的秋水仙素分别处理24 h和48 h,无菌水冲洗3次,将愈伤组织接种于添加1.0 mg/L Picloram和0.5 mg/L 6-BA的MS培养基上,待其发育为成熟的子叶型胚时,将子叶型胚接种于含0.1 mg/L CPPU[N-(2-chloro-4-pyridyl)-N’-phenylurea]的 MS培养基上培养,发育为完整植株。组织培养条件均为温度25℃,光照强度2 500 lx,光照时间12 h。每处理至少接种2瓶,每瓶接种10个外植体,每处理重复3次,统计再生率。

1.2.2 多倍体的筛选与鉴定
1.2.2.1 形态、气孔及染色体鉴定
再生植株形态学鉴定以二倍体材料为对照,根据其叶型、植株形状、株高等指标初步判断。
解剖学鉴定根据气孔指标,具体方法为:用蒸馏水清洗成熟叶片,干燥后,用尖头镊子轻轻撕下表皮,并将其置于加蒸馏水的载玻片上,使其平整,置于显微镜下观察。根据固定视野内的气孔数量来判断是否加倍。
染色体鉴定采用根尖压片法[4],具体方法如下:取百合组培苗幼嫩根尖2—3 mm,洗净后在0.1%的秋水仙碱溶液中预处理24 h;无菌水冲洗3—5次后,加入新配制的卡诺固定液(3∶1的纯酒精∶冰醋酸溶液),于4℃冰箱固定12 h;无菌水冲洗干净后用1 mol/L的HCL在60℃下解离5—8 min,无菌水冲洗干净;用醋酸洋红染色后压片观察。
1.2.2.2 流式细胞仪倍性鉴定条件的优化
解离液:分别采用 OTTO’s buffer[9]、WPB buffer[9]、Galbraith’s buffer[9]、Kiwifruit buffer[10]4种解离液制备叶片细胞核悬液,比较试验效果,具体成分如表1所示。
在模型分析过程中,相较于以往的CAD绘制,BIM技术可以创建虚拟建筑模型,进而对建筑进行智能化分析,而且在虚拟建筑模型中还涵盖着丰富的非图形数据信息,对其数据进行相应的分析,即可实现对建筑物结构、能量、工程量等各方面数据的准确信息,进而获得对建筑物全方面的认识,从而确定最优的建筑设计方案,实现对建筑工程施工的全方位控制。通过BIM技术运用可以有效规避人为因素的影响,从而保证工程信息与建筑设计方案的一致,为后续的施工工作提供准确的方案指导,进而推动建筑工程项目的顺利完成。

表1 细胞核解离液组成成分Table 1 Com ponents of nuclear dissociation solution
提取方法:(a)在直径6 cm的玻璃培养皿中加入0.1—0.15 g叶片(组培苗新叶或温室材料老叶),滴加1.0—1.5 mL细胞核提取液,用锋利刀片一次性快速切碎叶片至糊状(整个过程中,材料须浸没在解离液里,以便更好地游离细胞核),用尼龙网滤膜(300目、400目、500目)过滤到1.5 mL离心管中,滤液保持在1.0 mL左右,置于4℃冰箱5 min。(b)取出样品在4℃下1 000 r/min离心5 min,弃上清,加入600μL解离液与60μL预冷PI染色液于4℃避光染色15 min。(c)利用Beckman Colour流式细胞仪检测,将样品移至上样管上机检测。
选择不同倍性材料(二倍体和三倍体)、不同解离液(OTTO’s buffer、WPB buffer、Galbraith’s buffer、Kiwifruit buffer)、不同滤膜目数(300目、400目、500目)、不同离心方式(不离心、离心1次或离心2次),研究不同条件对出峰效果的影响。
1.2.2.3 再生植株加倍率的统计
每种处理的再生植株随机抽取10—15株进行倍性鉴定,每处理重复3次,结合气孔鉴定、染色体压片和流式细胞仪3种方法确定加倍率。
加倍率=(每种处理加倍植株总数/接种外植体数)×100%
1.3 数据分析
试验数据采用SPSS 17.0软件进行单因素方差分析(ANOVA)。
2 结果与分析
2.1 流式细胞仪倍性鉴定条件的优化
2.1.1 不同倍性百合叶片对出峰效果的影响
温室种植的‘索邦’和‘康卡多’经Kiwifruit解离液解离和400目滤网过滤,1次离心条件下的流式细胞出峰效果如图1所示。‘索邦’收集细胞数达10 000以上且计数速度快;‘康卡多’收集有效颗粒数在5 000左右,计数速度较‘索邦’慢,且杂峰高。以上结果表明:不同倍性材料对出峰效果影响明显,二倍体较三倍体材料通过速度快、杂质少。
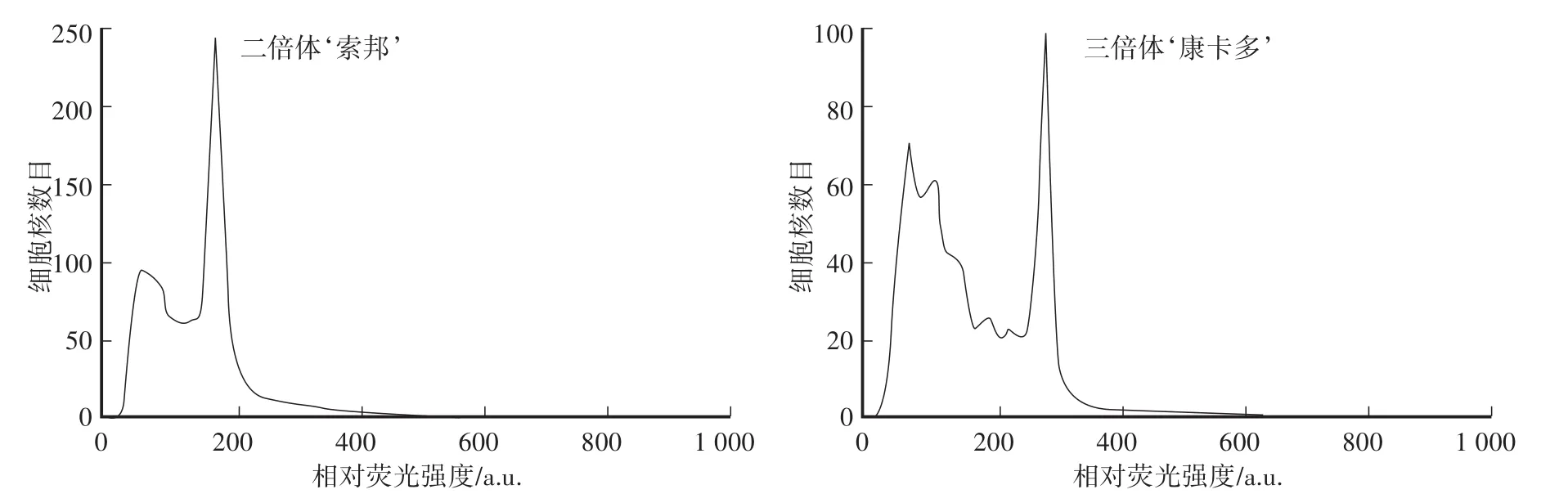
图1 不同倍性百合叶片对出峰效果的影响Fig.1 Effects of different ploidy lily leaves on peak values
2.1.2 不同解离液对出峰效果的影响
如图2所示,使用OTTO’s buffer杂质多,杂质峰高,样品峰前部分受到杂质峰的影响,很难收集到上千个细胞核数据,基本没有主峰。荧光显微镜下观察发现,大部分为碎片,完整的细胞核较少,表明其不能很好地裂解细胞;WPB buffer虽能收集够有效细胞核,但细胞核破裂情况明显,碎片峰明显高于主峰,说明其也不适用于百合叶片的解离;Galbraith’s buffer和 Kiwifruit buffer对百合叶片都有较好的裂解效果,主峰明显,细胞核多,染色效果好,G2峰明显,其中使用Kiwifruit buffer解离液杂质峰小,杂质有效减少,荧光通道值在200道的出峰明显,并且堵塞机器明显缓解;使用Galbraith’s buffer虽不堵管,但是杂质峰较Kiwifruit buffer高。相比之下Kiwifruit buffer效果略优于Galbraith’s buffer。综合考虑4种解离液的效果,Kiwifruit buffer最适合百合叶片进行流式细胞仪鉴定倍性。
2.1.3 不同滤膜目数对出峰效果的影响
如图3所示,不同滤膜目数对出峰效果影响不大,都能明显看到G2期(DNA合成后期,DNA已加倍)。
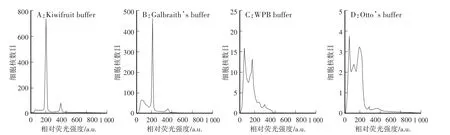
图2 不同解离液对出峰效果的影响Fig.2 Effects of different dissociation solution on peak values
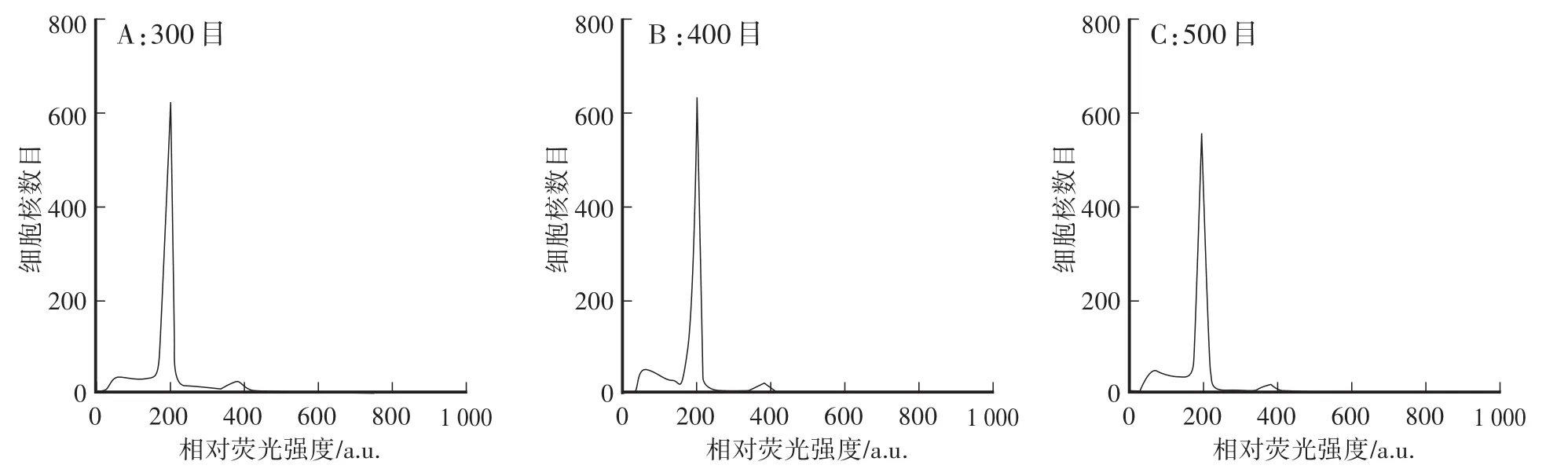
图3 不同滤膜目数对出峰效果的影响Fig.3 Effects of different filter mesh on peak values
2.1.4 不同离心次数对出峰效果影响
离心与不离心对出峰效果有较大影响。由图4可以看出,不离心杂质比1次离心多,且仪器出现堵管现象,G2期较1次离心明显;1次离心和2次离心差别不明显,仪器未出现堵管现象,且均能看到G2期。综合考虑,选择1次离心。
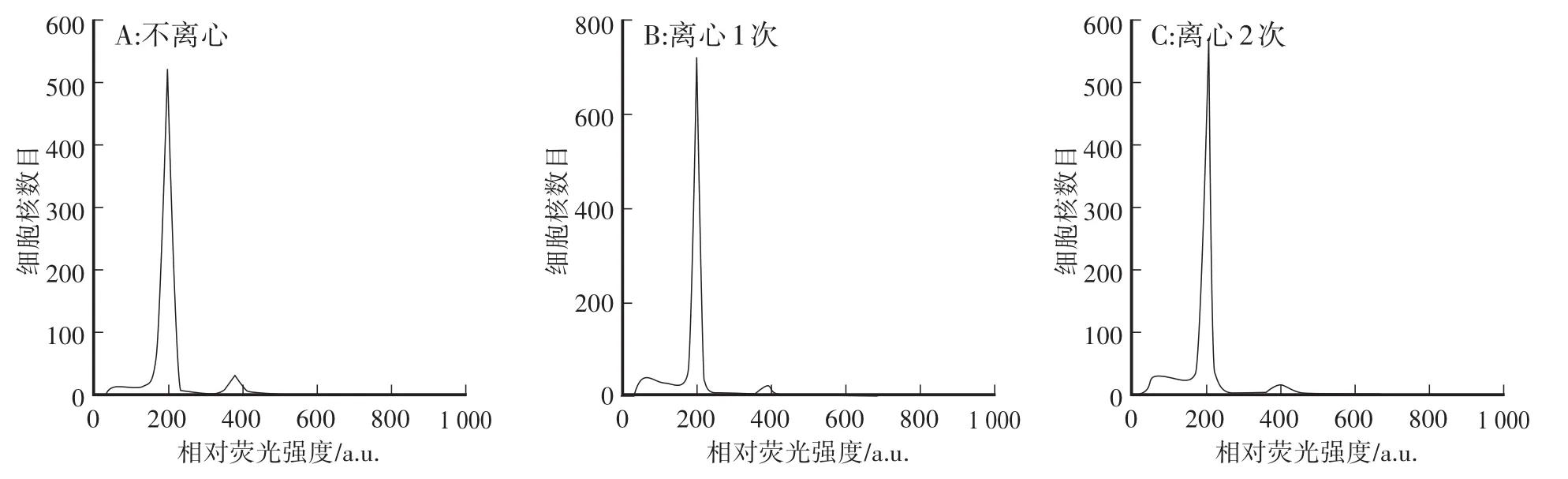
图4 不同离心次数对出峰效果的影响Fig.4 Effects of different centrifugation times on peak values
2.1.5 温室叶片与组织培养叶片对出峰效果影响
结果表明:组培新叶和温室老叶在荧光通道值为200道时均出现明显的主峰,但组培新叶效果略优于温室老叶。如图5所示,温室老叶的样品碎片峰明显高于组培新叶(50—100道附近),因此在流式细胞仪检测时应尽量选取幼嫩的组织材料。
2.2 百合胚性愈伤组织诱导加倍效果
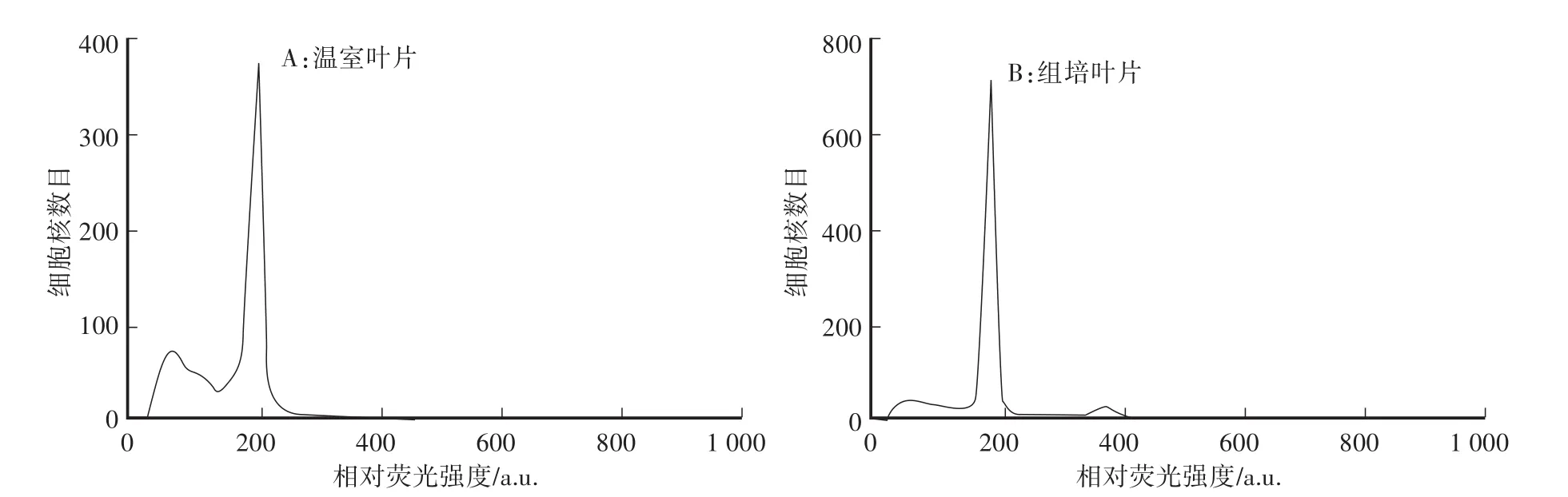
图5 温室叶片与组培叶片对出峰效果的影响Fig.5 Effect of leaves in the greenhouse and tissue-culture condition on peak values
经过秋水仙素处理的胚性愈伤组织部分褐化死亡,未褐化死亡的胚性愈伤组织0 d左右开始发育成球形胚,并陆续长成完整植株。由表2可以看出,0.1 mg/L的秋水仙素处理24 h植株再生率最高,为49.78%,但未获得加倍植株。随着秋水仙素浓度的提高和处理时间的延长,植株的再生率明显下降,0.5 mg/L处理48 h时再生率最低,只有12.21%;但再生植株的加倍率随着处理浓度的提高和时间的延长明显增加,0.5 mg/L秋水仙素处理24 h时植株的加倍率最高,达到12.14%。以上结果表明,低浓度秋水仙素处理时诱变率低,高浓度秋水仙素短时间处理诱变效果相对较好,秋水仙素在一定浓度范围和处理时间内均可获得加倍植株。
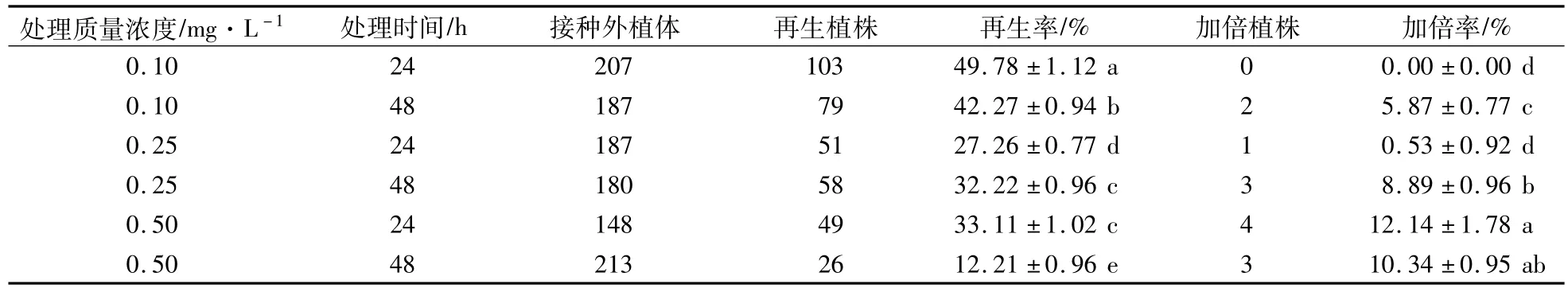
表2 不同浓度秋水仙素和处理时间对植株再生和染色体加倍的影响Table 2 Effects of different colchicine concentration and treatment time on plant regeneration rate and chromosome doubling rate
2.3 百合再生植株形态、气孔及染色体鉴定
经加倍处理的部分百合再生植株在形态上发生了明显的变异,株高较正常植株矮,叶片颜色加深并肉质化加厚(图6A、B)。对这些形态发生变异的植株继续进行气孔观察,发现变异植株气孔明显变大,单位面积内的气孔数量明显减少(图6C、D);对其进行染色体计数观察发现,二倍体‘索邦’染色体数目增加(图6E、F);对其进行流式细胞仪鉴定(二倍体为对照),发现其为四倍体百合(图7)。
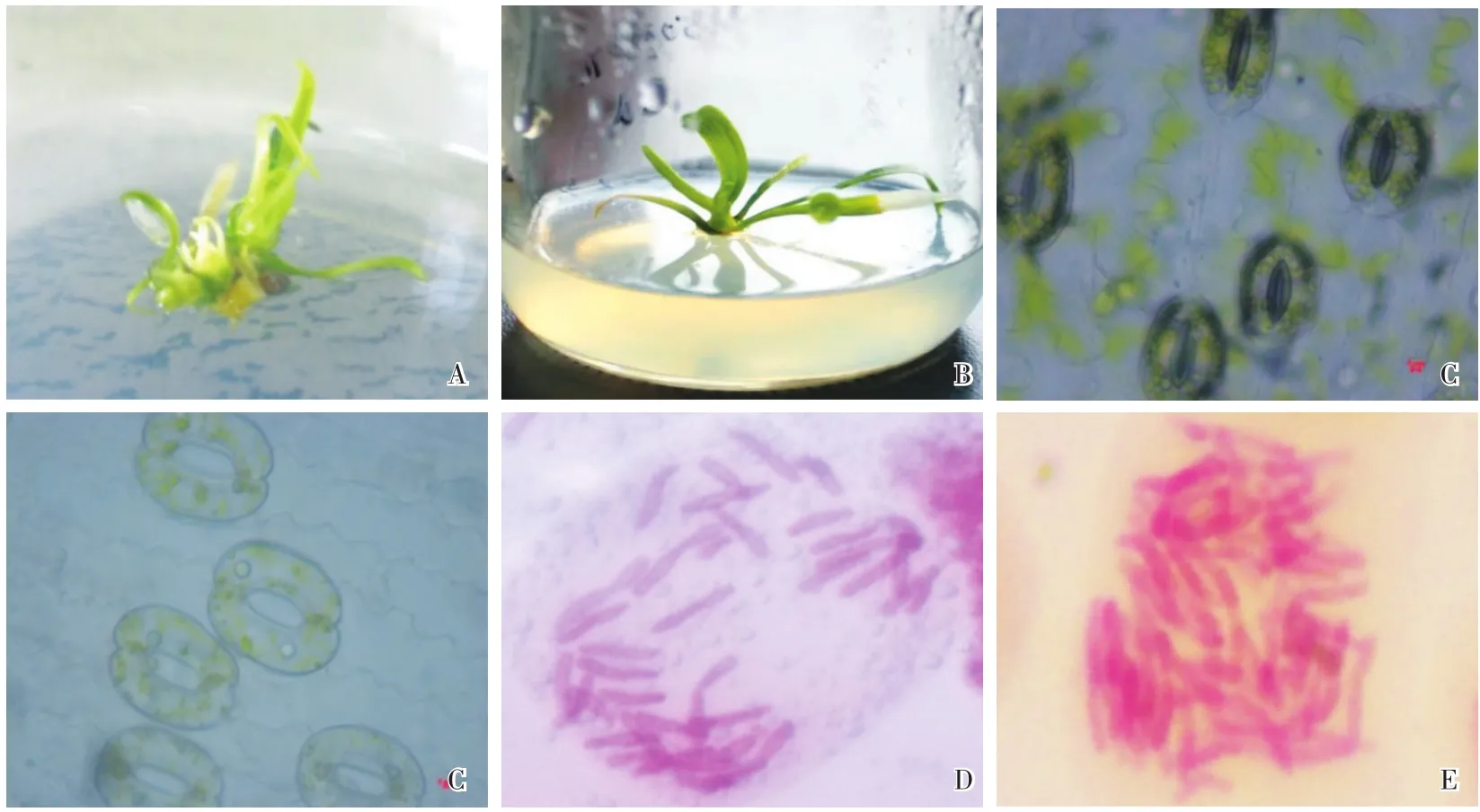
图6 不同倍性百合组培苗、气孔及染色体Fig.6 Tissue culture seed lings,stomata and chromosomes of different p loidy lily

图7 百合加倍材料流式细胞仪鉴定Fig.7 Identification of lily doubling material by flow cytometry
3 讨论
植物体细胞胚的发生多是单细胞起源,具有繁殖率大、嵌合体少、无性系变异小等优点,是诱变育种研究及转基因研究的优良再生体系。如张清国等[11]采用秋水仙素诱导落叶松体细胞胚再生建立了多倍体体细胞胚再生体系,并获得大量多倍体个体。传统的方法采用秋水仙碱处理种子或鳞茎外植体诱导多倍体易产生嵌合体。如杨英杰等[12]采用秋水仙碱处理细叶百合的种子获得了49株形态变异植株,经染色体倍性鉴定,有47株为染色体倍性发生变化的变异植株,其中有6株为四倍体,1株为三倍体,其余为染色体非整倍体变异植株。王丽艳等[13]采用秋水仙碱处理兰州百合带小鳞茎的鳞片所获得的植株也存在一定的嵌合体。本研究采用百合根外植体诱导获得的胚性愈伤组织作为诱导加倍材料,不仅获得了大量的再生植株,而且在材料的倍性鉴定中未发现嵌合体,这一再生体系可显著提高染色体加倍的成功率。本研究发现,随着秋水仙素处理浓度的增加和处理时间的延长,胚性愈伤的死亡率和相对诱变率均得到提高,但处理浓度过高或处理时间过长,胚性愈伤成苗率大大降低,很难获得诱变植株,而且在恢复生长时存在能力减弱、植株生长缓慢的现象。
细胞解离液是流式细胞技术鉴定植物倍性的关键。植物细胞解离液的组成成分不仅与荧光分辨率有关,而且还会影响细胞核从细胞质中的释放、分离后细胞核的完整性及DNA的染色。根据前人分析结果,细胞碎片产生的主要原因是植物细胞的自身结构[9]。植物细胞由于有细胞壁使得细胞有不规则形状,且细胞中的NADH和核黄素等使细胞产生自发荧光,均会影响待测样本的液流[9]。此外,细胞核解离液与待测植物样本不匹配也会导致碎片峰增多。虽然不同的解离液在组分上基本都含有细胞核染色质稳定剂、核酸酶活性抑制剂、缓冲液pH稳定剂等,但各裂解液不同组分在浓度上差异较大,当裂解液不适合时,不仅不能保持细胞核的完整性,还会加速细胞核的破裂[14]。吴青青等[15]采用CyStain UV Precise T提取液和WPB裂解液对百合花粉和叶片进行裂解,发现CyStain UV Precise T提取液明显优于WPB裂解液,WPB裂解液的碎片峰较高,与本研究采用WPB裂解液得到的结论一致。经对比选择,本研究最适合百合叶片的细胞裂解液为Kiwifruit buffer。此外,温室种植的百合叶片效果差于组培苗叶片。前人也采用流式细胞技术鉴定百合倍性[2,16],但未针对流式细胞仪倍性鉴定的因素进行详细优化,本试验对流式细胞仪鉴定百合倍性的影响因素进行了优化,可为百合科植物染色体倍性鉴定提供参考。
本研究对形态鉴定法、流式细胞仪法、染色体计数法3种鉴定方法进行比较,发现形态鉴定法最直观简单,但存在较大的不确定性;流式细胞仪检测方法在优化好条件后简单、准确性高,适合短时间内鉴定大批量样品,但费用较高;染色体计数法准确性最高,但步骤复杂,检测时间长。结合3种方法的优缺点,对大批需鉴定倍性的植物材料可以先从形态学初步判定,之后采用流式细胞仪鉴定,确定加倍后再采用染色体计数的方法最终确定材料倍性。
[1]瞿素萍,王继华,张颢,等.多倍体育种在园艺作物中的应用[J].北方园艺,2003(6):58-60.
[2]于娜丽,王良桂.百合多倍体诱导及鉴定[C]∥中国风景园林学会.中国风景园林学会2011年会论文集(下册).北京:中国建筑工业出版社,2011.
[3]简佳,方李琴,谭欣,等.盆栽亚洲百合的杂交和染色体加倍[J].农业生物技术学报,2013,21(5):627-630.
[4]兰倩,杨利平.麝香百合‘雪皇后’多倍体诱导[J].河北农业大学学报,2011,34(2):48-52.
[5]魏爱民,杜胜利,韩毅科,等.植物细胞染色体倍性鉴定方法[J].天津农业科学,2001,7(2):41-43.
[6]杨清淮.植物染色体倍性鉴定方法概述[J].现代园艺,2014(2):12-13.
[7]李克虎,周桂雪,任贵玲,等.百合品种染色体倍性观察[J].园艺学报,2011,38(5):970-976.
[8]ZHOU Y,ZHANG J J,CHEN M M,et al.Development of plant regeneration system via somatic embryogenesis from roots of Lilium hybrid cultivars[J].Propagation of Ornamental Plants,2013,13(3):130-137.
[9]沈捷,徐进,刘光欣,等.不同分离缓冲液对杉木根尖细胞核悬液DNA分辨率的影响[J].分子植物育种,2015,13(1):190-196.
[10]施春晖,徐兰兰,王晓庆,等.流式细胞仪鉴定猕猴桃倍性技术研究[J].植物研究,2014,34(6):845-849.
[11]张清国,韩素英,梁国鲁,等.落叶松体细胞胚胎发生诱导多倍体的研究[J].生物技术通报,2009(9):78-82.
[12]杨英杰,葛蓓孛,魏倩,等.秋水仙素诱导细叶百合多倍体研究[J].中国农业大学学报,2013,18(1):128-133.
[13]王丽艳,荆瑞勇.秋水仙碱诱导兰州百合四倍体[J].核农学报,2008,22(5):581-584.
[14]田新民,周香艳,弓娜.流式细胞术在植物学研究中的应用:检测植物核DNA含量和倍性水平[J].中国农学通报,2011,27(9):21-27.
[15]吴青青,胡小京,黄伟,等.流式细胞仪测定百合花粉倍性的研究[J].安徽农业科学,2015,43(28):4-6.
[16]SUPAIBULWATANA K,MASAHIRO M.Induction ofmeristematic nodular calli from various explants of Lilium spp.and long term stability in plant regeneration ability and ploidy level of the calli[J].Plant Biotechnology,1998,15(2):95-102.

