NMHC-ⅡA在PRRSV感染M arc-145细胞过程中的作用
李 红,刘成倩,孙凤萍,高 骏,易建中*
(1上海市农业科学院畜牧兽医研究所,上海 201106;2上海佳牧生物制品有限公司,上海 201106)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由PRRS病毒(PRRSV)感染所致的一种接触性传染病,主要表现为母猪发热、厌食、流产、早产、木乃伊胎、弱仔等繁殖障碍及仔猪和猪呼吸系统疾病[1-3]。已公布的 PRRSV受体中,存在于猪肺泡巨噬细胞(Porcine alveolar macrophages,PAM)的 3个受体分别为硫酸乙酰肝素 (Heparin sulfate,HS)[4-5]、唾液酸黏附素(Sialoadhesin,Sn)[5-6]和清道夫受体 CD163[7],存在于 PRRSV易感染细胞系 Marc-145上的受体为 CD151和波形蛋白(Vimentin)[8-9]。目前,PRRSV与受体之间相互作用的分子机制还不完全清楚,普遍认为HS能够调节低水平病毒的吸附,但并不能将病毒内吞。Sn能够调节病毒的吸附和内吞,但并不能将病毒内吞,且不需要硫酸乙酰肝素的协助。CD163受体的作用可能是协助唾液酸黏附素内吞、PRRS病毒脱衣壳以及基因组RNA的释放[10]。
存在于非肌肉细胞中的肌肉蛋白II称为非肌肉肌球蛋白Ⅱ(Non-musclemyosinⅡ,NMⅡ),其与肌动蛋白结合构成细胞中的分子马达[11-12]。研究发现,NMⅡ在囊泡的转移和释放、细胞吞饮、病毒入侵等方面也有一定的作用[13-14],但NMⅡ其他功能研究较少。非肌肉肌球蛋白重链Ⅱ型(Non-muscle myosin heavy chain-Ⅱ,NMHC-Ⅱ)广泛分布在生物体内,参与细胞迁移、黏附、胞质分裂等各种生理活动[15]。NMHC-Ⅱ有NMHC-ⅡA、NMHC-ⅡB、NMHC-ⅡC 3种不同的亚型,它们具有相似的结构,均为由一对大小为171—244 ku的重链和两对大小为16—23 ku的轻链组成的六聚体,其中NMHC-ⅡA的重链大小为230 ku[16]。2008年周恩民等[17]首次提出NMHC-ⅡA可能是PRRSV的受体或辅助因子,为了进一步研究该蛋白在PRRSV感染宿主细胞中的作用,本试验以NMHC-IIA为研究对象,探讨其与CD163受体的关系以及在PRRS病毒感染过程中的定位。
1 材料与方法
1.1 细胞、毒株、抗体以及试剂
Marc-145细胞系为本实验室保存;PRRSV 12#毒株(GenBank:HQ416720)、抗PRRSV N蛋白的单克隆抗体(6D10)以及PRRSV阳性猪血清(345#)为山东农业大学免疫生物学实验室提供;抗PRRSV GP5抗独特型抗体Mab2-5G2由西北农林科技大学周恩民教授提供;二抗HRP-羊抗猪IgG和FITC-标记羊抗鼠IgG购自Jackson公司;G-cy5标记的羊抗鼠二抗购自SoutherBiotech公司;Vectashield包埋试剂购自Vector labs公司;其他常规试剂均为国产分析纯。
1.2 免疫共沉淀提取NMHC-ⅡA
将Marc-145细胞从细胞培养瓶上轻轻刮下,3 000 r/min离心10min,收集细胞,PBS缓冲液(0.01mol/L,pH 7.2)重悬细胞,洗涤3次,使细胞达4×107个左右。加入RIPA细胞裂解液[18]1 mL重悬细胞,放入-70℃冰箱反复冻融裂解细胞3次,转入4℃摇床上轻摇30 min,离心,收集上清液,并加入50μL用RIPA洗涤3次的Resin,放入4℃摇床上轻摇1 h,离心,收集上清,加入5μLMab2-5G2(11 mg/mL),4℃轻摇孵育14—16 h,加入Resin 50μL,4℃轻摇孵育4 h,离心,收集沉淀物,加入1 mL RIPA洗涤沉淀,离心,弃上清,洗涤3次。取Resin 10μL于试管中,进行SDS-PAGE检测。
1.3 SDS-PAGE蛋白电泳检测NMHC-ⅡA
参照分子克隆实验指南操作制备8%分离胶和5%积层胶,进行凝胶染色和脱色[19]。按照电泳装置的使用说明,装好洁净干燥的玻璃板,灌胶、电泳。
1.4 W estern Blot检测NMHC-IIA
按照1.3 SDS-PAGE的步骤制备凝胶及电泳。将分离胶放入电转缓冲液中,按照实验室常规半干转膜法转PVDF膜[19]。取出的膜放入含2.5%脱脂奶粉的PBST中,封闭1 h。将膜放入含有Mab2-5G2的抗独特型抗体中,孵育1 h。PBST洗涤3次,每次5 min。PVDF膜放入HRP标记羊抗鼠的二抗中孵育1 h。PBST洗涤3次,每次5 min。将膜放入底物中显色,用去离子水终止反应。
1.5 NMHC-IIA与PRRSV的检测
按照2×105个/mL含量培养Marc-145细胞于含有盖玻片的细胞培养板内,24 h后,100μL细胞液接入100 TCID50的PRRSV,细胞板转入4℃孵育1 h,然后放入37℃、5%CO2培养箱内培养不同时间,分别于 0 min、5 min、10 min、15 min、30 min、60 min、90 min、120 min用预冷的 75%乙醇 4℃固定 30 min,弃去细胞板内乙醇,超净工作台内吹干。固定细胞于0.5%TritonX-100,室温处理5 min,PBS洗涤3次,每次5 min。加入阻断缓冲液[18],室温放置1 h,PBS洗涤3次,每次5min。细胞按照一定稀释度加入Mab2-5G2(1 mg/mL)和PRRSV阳性猪血清345#(1∶160),室温孵育1 h,PBS洗涤3次。将稀释好的G-cy5标记的羊抗鼠和FITC标记的羊抗猪二抗(G-cy5-羊抗鼠IgG:1μg/106个细胞,FITC-羊抗猪IgG:1μg/106个细胞)加入到细胞上,室温孵育1 h,PBS缓冲液洗涤3次。将细胞板内盖玻片取出,将盖玻片上细胞包埋在Vectashield包埋试剂中,用指甲油包封闭盖玻片,于激光共聚焦显微镜下观察、拍照。
1.6 NMHC-IIA与CD163片段的相互作用
将按照1.2方法提取的NMHC-IIA蛋白进行SDS-PAGE,然后转入PVDF膜,将转好的膜放于2.5%脱脂奶粉中4℃孵育过夜。膜用0.5%PBST洗涤3次,每次10 min,加入纯化的M1、M2、M3蛋白[20],室温孵育2 h,用0.5%PBST洗涤3次,每次10 min。加入Mab2-5G2或抗HIS标签的单克隆抗体,室温孵育2 h后,洗涤3次,每次10 min。加入羊抗鼠-HRP标记的二抗,室温孵育1 h后,加入增强型HRP-DBA底物显色液进行检测。
2 结果与分析
2.1 NMHC-ⅡA蛋白的提取与检测
通过免疫共沉淀技术获得beads-5G2-NMHC-ⅡA蛋白复合物,将此蛋白复合物洗脱、中和,获得纯化的NMHC-ⅡA蛋白,取适量NMHC-ⅡA蛋白进行SDS-PAGE电泳。如图1所示,NMHC-ⅡA蛋白大小为230 ku。
2.2 NMHC-IIA与PRRSV感染关系
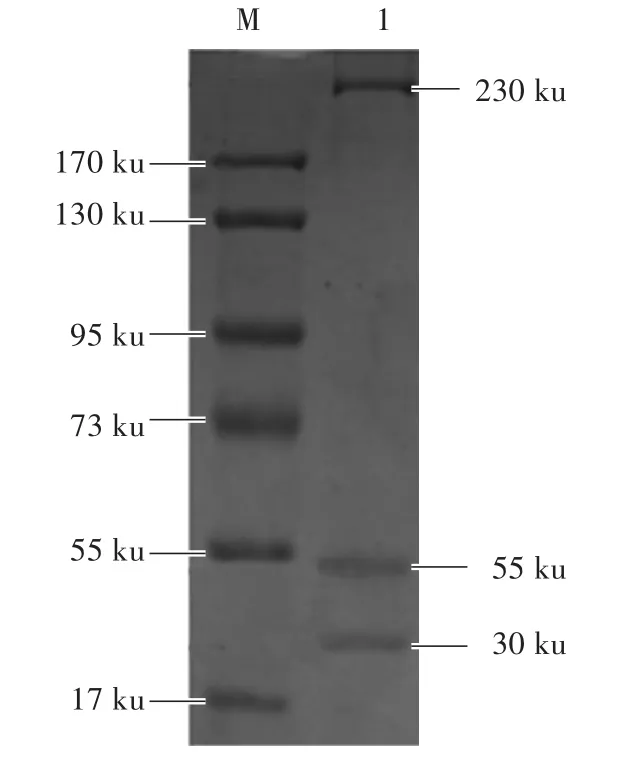
图1 SDS-PAGE检测M arc-145细胞中NMHC-IIAFig.1 Detection of NMHC-IIA in M arc-145 cells by SDS-PAGE
分别通过绿色和红色荧光二抗(FITC-标记的羊抗猪和CYTM5-标记的羊抗鼠)检测在PRRSV感染Marc-145细胞时,NMHC-ⅡA蛋白在细胞中的位置和表达量。通过激光共聚焦显微镜发现:将细胞转入4℃时,PRRS病毒主要分布在被感染细胞表面,当细胞从4℃转入37℃时,PRRS病毒在5 min左右进入细胞。随着病毒感染细胞时间的延长,NMHC-ⅡA蛋白在Marc-145细胞内的表达量增加;当PRRS病毒完全进入被感染细胞后,NMHC-ⅡA的表达量减少(图2)。
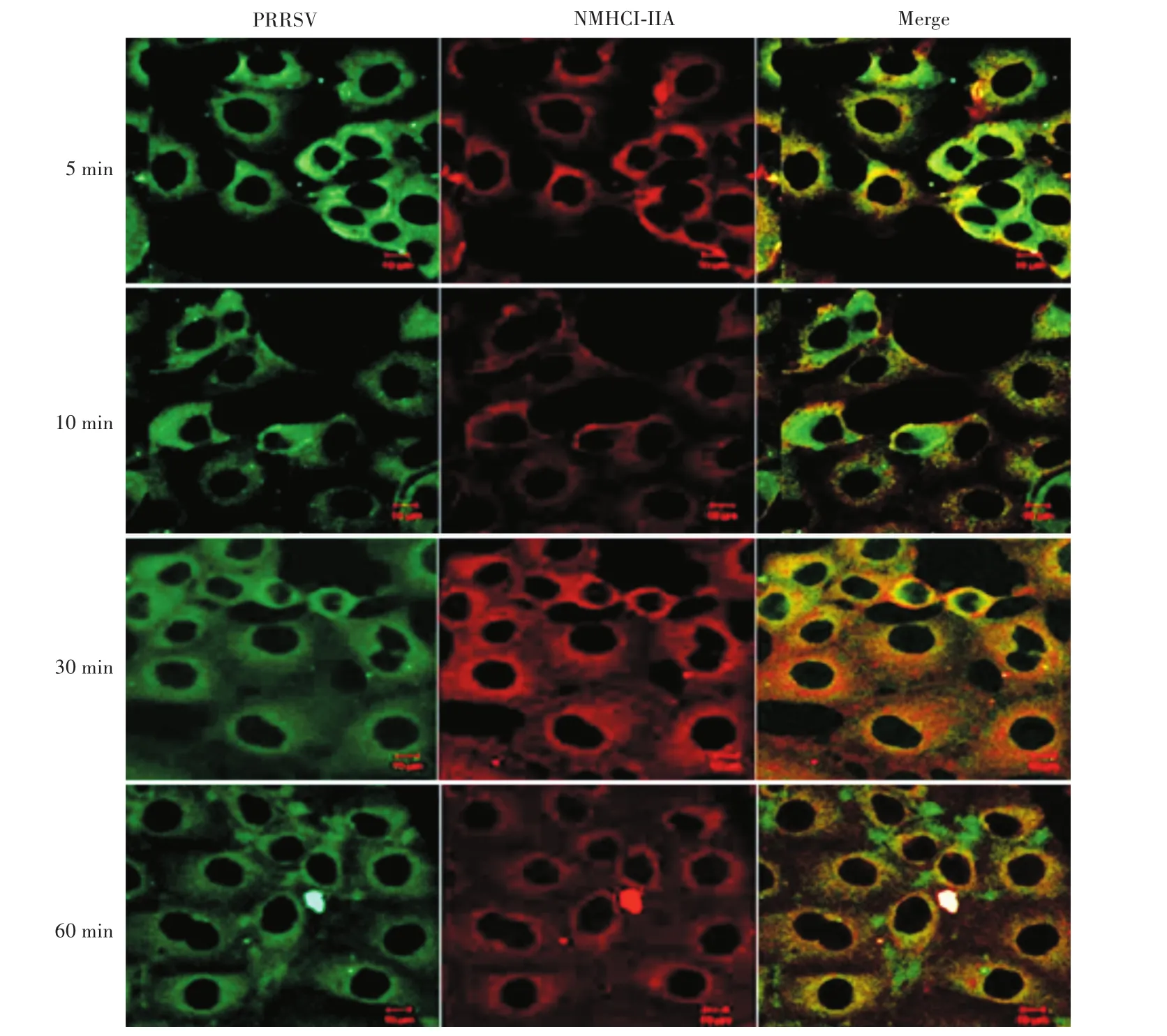
图2 NMHC-ⅡA蛋白在PRRSV感染M arc-145细胞中的分布和表达量Fig.2 Distribution and expression of NMHC-ⅡA protein in M arc-145 cells infected with PRRSV
2.3 NMHC-ⅡA蛋白与CD163蛋白的相互作用
将纯化的NMHC-ⅡA蛋白与CD163分段蛋白(M1、M2、M3)孵育1 h后,经免疫共沉淀试验发现:NMHC-ⅡA蛋白与M1和M3蛋白能够相互作用,与M2蛋白没有相互作用(图3)。
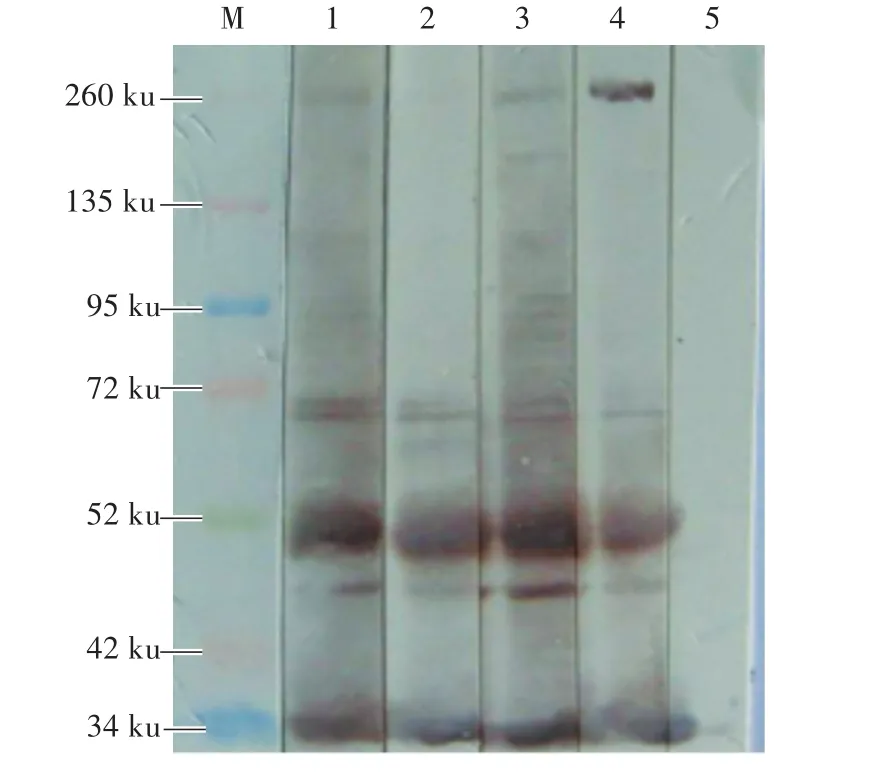
图3 Western Blot检测NMHC-ⅡA和CD163片段的相互作用Fig.3 Detection of interaction between NMHC-ⅡA and CD163 fragments by Western Blot
3 讨论与结论
目前,PRRSV感染致病机制尚不清楚。病毒感染宿主细胞,主要是通过与细胞表面的特异性受体结合,利用细胞的内吞作用感染易感细胞。PRRSV感染易感细胞系非洲绿猴肾细胞Marc-145的过程也是通过细胞表面的受体进行的,但已有报道称Marc-145细胞系上没有Sn受体[21]。PRRSV能够感染Marc-145细胞,说明PRRSV可能与Marc-145细胞上的其他受体或者辅助因子相互作用继而引起PRRSV感染和进入细胞。Kim等[22]研究发现,波形蛋白存在于Marc-145细胞表面,并能够与PRRSV的N蛋白相互作用,说明波形蛋白参与PRRSV感染Marc-145细胞的过程。周恩民等[17]通过免疫共沉淀技术,利用PRRSV结构蛋白GP5的单克隆抗独特型抗体Mab2-5G2,从PAM和Marc-145细胞中提取获得非肌肉肌球蛋白重链ⅡA(NMHC-ⅡA)。本研究发现,Marc-145细胞上的PRRSV受体CD163与NMHC-ⅡA蛋白能够相互作用,作用位点主要集中在CD163蛋白的M1(20—259 aa)和M3(714—1 040 aa)蛋白上。同时,通过激光共聚焦显微镜定位发现,NMHC-ⅡA蛋白在PRRSV感染细胞过程中随着感染时间的延长和病毒感染量的增加,其表达量也有所增加。本试验认为,NMHC-ⅡA蛋白可能在PRRSV感染Marc-145细胞过程中发挥协同作用。本研究进一步揭示了PRRSV受体或协同因子之间的相互作用,对PRRSV感染致病机制有一定的促进作用。后期可以进一步缩短结合蛋白的长度,找到相互作用位点,利用RNAi技术敲除结合位点,从而减少病毒侵染宿主细胞的机会。
[1]WENSVOORT G.Lelystad virus and the porcine epidemic abortion and respiratory syndrome[J].Vet Res,993,24(2):117-124.
[2]MEULENBERG J J.PRRSV,the virus[J].Vet Res,2000,31(1):11-21.
[3]GREBENNIKOVA T V,CLOUSER D F,VORWALD A C,et al.Genomic characterization of virulent attenuated,and revertant passages of a North American porcine reproductive and respiratory syndrome virus strain[J].Virology,2004,321(2):383-390.
[4]DELPUTTE P L,VANDERHEIJDEN N,NAUWYNCK H J,et al.Involvement of thematrix protein in attachment of porcine reproductive and respiratory syndrome virus to a heparinlike receptor on porcine alveolarmacrophages[J].JVirol,2002,76(9):4312-4320.
[5]DELPUTTE P L,COSTERS S,NAUWYNCK H J.Analysis of porcine reproductive and respiratory syndrome virus attachment and internalization:distinctive roles for heparan sulphate and sialoadhesin[J].JGen Virol,2005,86(Pt5):1441-1445.
[6]VANDERHEIJDEN N,DELPUTTE P L,FAVOREEL H W,et al.Involvement of sialoadhesin in entry of porcine reproductive and respiratory syndrome virus into porcine alveolarmacrophages[J].JVirol,2003,77(15):8207-8215.
[7]CALVERT JG,SLADE D E,SHIELDS S L,et al.CD163 expression confers susceptibility to porcine reproductive and respiratory syndrome viruses[J].JVirol,2007,81(14):7371-7379.
[8]KIM JK,FAHAD A M,SHANMUKHAPPA K,et al.Defining the cellular target(s)of porcine reproductive and respiratory syndrome virus blockingmonoclonal antibody 7G10[J].JVirol,2006,80(2):689-696.
[9]SHANMUKHAPPA K,KIM JK,KAPIL S.Role of CD151,A tetraspanin,in porcine reproductive and respiratory syndrome virus infection[J].Virol J,2007,4:62.
[10]DELPUTTE P L,NAUWYNCK H J.Porcine artervirus entry in macrophage:heparin sulfate-mediated attachment,sialoadhesin-mediated internalization,and a cell-specific factormediating virus disassembly and genome release[J].Adv Exp Med Bio,2006,581:247-252.
[11]SIMONSM,WANG M,MCBRIDE O W,et al.Human nonmuscle myosin heavy chains are encoded by two genes located on different chromosomes[J].Circ Res,1991,69(2):530-539.
[12]BERG JS,POWELL B C,CHENEY R E.A millennialmyosin census[J].Mol Biol Cell,2001,12(4):780-794.
[13]SEABROOKE S,QIU X,STEWART B A.Nonmuscle myosinⅡ helps regulate synaptic vesicle mobility at the Drosophila neuromuscular junction[J].BMC Neurosci,2010,11:37.
[14]DOREIAN BW,FULOP T G,SMITH C B.MyosinⅡ activation and actin reorganization regulate the mode of quantal exocytosis in mouse adrenal chromaffin cells[J].JNeurosci,2008,28(17):4470-4478.
[15]VICENTE-MANZANARESM,MA X,ADELSTEIN R S,et al.Non-musclemyosinⅡ takes centre stage in cell adhesion and migration[J].Nat Rev Mol Cell Biol,2009,10(11):778-90.
[16]GOLOMB E,MA X,JANA SS,et al.Identification and characterization of nonmusclemyosin II-C,a new member of themyosin II family[J].J Biol Chem,2004,279(4):2800-2808.
[17]ZHOU E M,XIAO Y,SHIY,etal.Generation of internal imagemonoclonal anti-idiotypic antibodies against idiotypic antibodies to GP5 antigen of porcine reproductive and respiratory syndrome virus[J].JVirol Methods,2008,49(2):300-308.
[18]李红.CD163及其他蛋白在PRRSV感染细胞过程中的相互作用[D].泰安:山东农业大学,2011.
[19]J萨姆布鲁克,DW拉塞尔.分子克隆实验指南[M].3版.北京:科学出版社,2002.
[20]李红,刘成倩,易建中.PRRSV受体CD163与Marc-145细胞的相互作用[J].中国兽医学报,2016,36(8)1273-1277.
[21]DUAN X,NAUWYNCK H J,FAVOREEL HW,etal.Identification of a putative receptor for porcine reproductive and respiratory syndrome virus on porcine alveolarmacrophages[J].JVirol,1998,72(5):4520-4523.
[22]KIM H S,KWANG J,YOON I J,et al.Enhance replication of porcine reproductive and respiratory syndrome(PRRSV)virus in a homogeneous subpopulation of MA-104 cell line[J].Arch Virol,1993,133(3/4):477-483.

