汞胁迫对红裸须摇蚊幼虫抗氧化酶活性的影响1)
耿飞飞 于洪贤 刘曼红 孟瑶
(东北林业大学,哈尔滨,150040)
摇蚊幼虫为完全变态类昆虫,是一种分布广泛且种类数量众多的底栖动物,具有解毒能力低、对污染物的暴露敏感、生活周期短等特性,且在实验室内易饲养,是水体质量监测中的重要指示生物。在加强水生态毒理学应用研究中,摇蚊幼虫被广泛应用于毒性测试[1-2]。依据摇蚊幼虫对水体中重金属的敏感性,开展了重金属对摇蚊幼虫的急性和慢性毒性实验[3]。相关研究有,Cu2+、Cd2+对红裸须摇蚊(Propsilocerusakamusi)幼虫和羽摇蚊(Chironomusplumosus)幼虫的急性毒性效应及对过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽-S-转移酶(GSTs)活性的影响[4-5]等。Hg2+是存在于水环境中极具毒性的重金属,其毒性涉及到氧化应激,即Hg2+可诱导自由基的形成,并改变了细胞的抗氧化能力[6-8],暴露于含有Cd和Cu的沉积物,对伸展摇蚊(Chironomustentans)幼虫具有致畸作用[9]。
关于生物体内重要解毒酶,我国近年来也开展了一些工作,研究的污染物涉及重金属、有机物污染物和工业废水。基于这些特性,摇蚊幼虫作为水生态系统食物链的关键环节,其体内抗氧化酶的活性或表达量与重金属Hg浓度之间的效应关系,可作为监测环境污染的一项灵敏指标。抗氧化酶系被用作指示环境污染的早期预警,从而成为分子毒理学生物标志物研究的热点之一[10-12]。然而,摇蚊幼虫在Hg2+的胁迫下,生物体内重要的抗氧化酶,如CAT、过氧化物酶(POD)、SOD、谷丙转氨酶(GST)的活性如何,还需要进行科学验证。
红裸须摇蚊是摇蚊中的优势种,广泛分布于我国的淡水环境中,在水生态系统食物链中占有重要的地位。本研究以红裸须摇蚊幼虫为实验材料,研究4种生物指标(CAT、POD、SOD、GST)在汞暴露下的变化规律,目的是探究汞对红裸须摇蚊幼虫抗氧化系统的效应,同时用以评估红裸须摇蚊幼虫对汞胁迫的敏感性,为将红裸须摇蚊幼虫重金属污染的生物监测提供参考。
1 材料与方法
实验用红裸须摇蚊购于哈尔滨市哈平路花鸟鱼虫市场,在实验室蒸馏水环境下,饥饿处理24h,挑选活性好、大小一致的4龄幼虫用于试验。试验用水为蒸馏水,每日投喂颗粒金鱼料作为摇蚊幼虫食物,水温(21.0±0.5)℃、pH为7.0±0.5,室内自然光下进行。试验用的Hg2+用分析纯HgCl2(质量分数为99.5%,姜堰市环球试剂厂)配置;用蒸馏水将HgCl2配成一定质量浓度的母液,再以蒸馏水稀释成所需质量浓度的实验溶液。蛋白质、CAT、POD、SOD的测定,利用相应的试剂盒(南京建成生物工程研究所)完成。采用SPSS17.0软件计算半数效应质量浓度(ch)及95%置信区间。
利用净水染毒法试验。通过预试验,根据寇氏改良法得到红裸须摇蚊幼虫的48 h半致死质量浓度(cs)为3.61 mg/L。将HgCl2用蒸馏水设置成质量浓度为0(对照组)、1.6、2.4、3.6、5.4、8.1 mg/L的处理组,每组设置3个平行样。将用于试验的红裸须摇蚊幼虫放入500 mL带有Hg2+的烧杯中,每个烧杯放50个,6、24、48、72 h取活性较好的摇蚊幼虫置于冰箱中-20 ℃保存,用作蛋白质、CAT、POD、SOD的测定。
采用SPSS16.0统计软件对试验数据进行分析。在同一时间段、不同质量浓度Hg2+对酶活性的影响,用SPSS软件的单因素方差分析进行多重比较。
2 结果与分析
2.1 Hg2+对红裸须摇蚊幼虫CAT活性的影响
用不同质量浓度的HgCl2(0、1.6、2.4、3.6、5.4、8.1 mg/L),分别处理红裸须摇蚊4龄幼虫6、24、48、72 h。6 h其体内CAT活性,在不同处理组表现为:随着汞质量浓度的增大,对酶的活性影响是先增加后减少的变化趋势,在5.4 mg/L时被显著诱导,达到最大值(0.233±0.002)U/mg;在8.1 mg/L时开始下降,为(0.039±0.025)U/mg。除了质量浓度8.1 mg/L,其它的质量浓度随着毒物作用时间的延长,在24 h被显著诱导,表现出最大的酶活性,然后在48 h以后酶的活性被抑制,即出现不同程度的下降。处理组8.1 mg/L在作用时间48 h,CAT活性最大,为(0.271±0.016)U/mg,在Hg2+作用72 h每个处理组的CAT活性被抑制,都呈现下降趋势(见表1)。同一时间不同质量浓度的Hg2+处理,对CAT活性影响的LSD法多重比较检验结果显示,48 h与72 h的各质量浓度Hg2+对CAT活性都没有明显差异,仅在24 h时SOD活性在对照组与其他质量浓度处理组之间的差异达到了显著性水平(p<0.05)(见表1)。
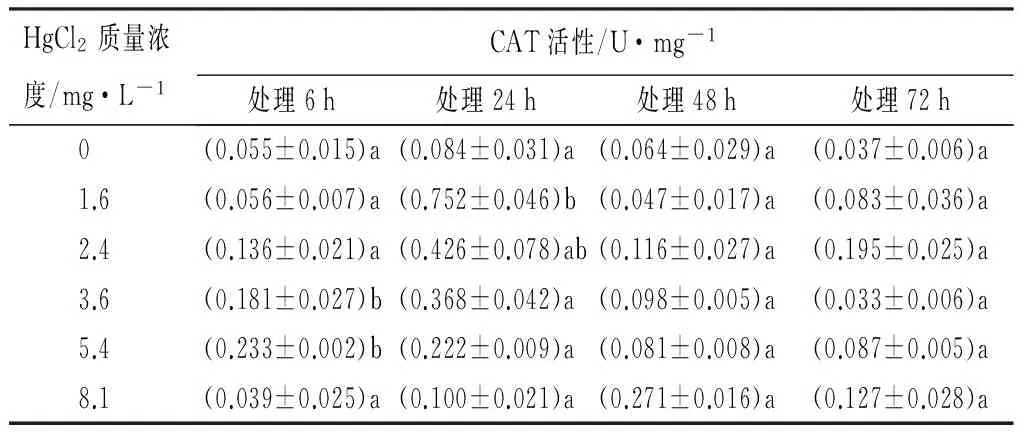
表1 Hg2+处理后红裸须摇蚊幼虫的CAT活性
注:同列不同小写字母表示差异显著(p<0.05)。
2.2 Hg2+对红裸须摇蚊幼虫POD活性的影响
在Hg2+胁迫下,不同处理组的红裸须摇蚊幼虫体内POD的活性,在24 h时被诱导,在(0.615±0.020)~(0.683±0.028)U/mg之间,随着处理时间的延长有增加的趋势。同一时间不同处理组,对POD活性影响的LSD法多重比较检验结果显示,各时间段,各质量浓度Hg2+的POD活性与对照组相比变化不显著(p>0.05)。说明POD在受到Hg2+胁迫时,不同处理时间和不同处理组的红裸须摇蚊幼虫体内POD活性,没有明显的剂量-效应关系,表现相对复杂的变化(见表2)。
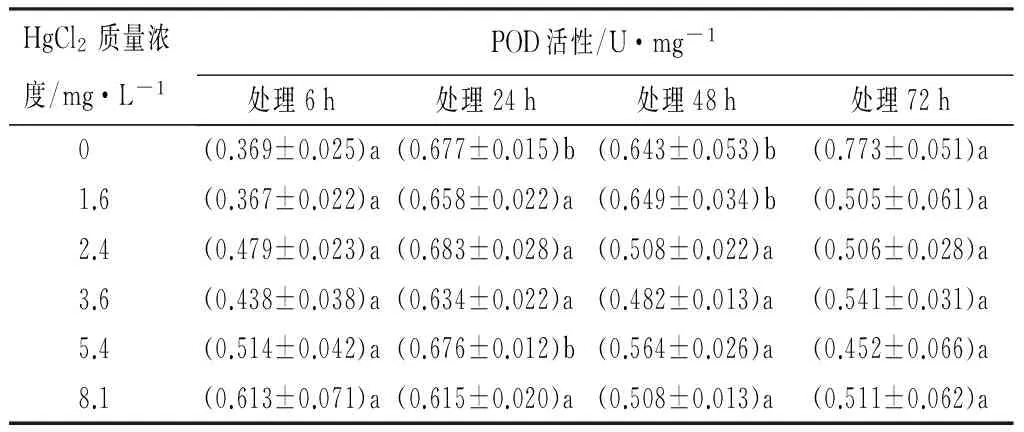
表2 Hg2+处理后红裸须摇蚊幼虫的POD活性
注:同列不同小写字母表示差异显著(p<0.05)。
2.3 Hg2+对红裸须摇蚊幼虫体内SOD活性的影响
由表3可见:Hg2+胁迫下,不同的处理组红裸须摇蚊幼虫体内SOD酶的活性,高质量浓度的处理组(5.4、8.1 mg/L),在长的暴露时间(48、72 h),SOD的活性都较高,在72 h都达到最大值,并且5.4 mg/L处理组最大,为(0.922±0.055)U/mg。不同处理组,如1.6、2.4、3.6 mg/L处理组,在48 h的SOD酶活力较低些,为(0.333±0.062)~(0.814±0.065)U/mg;5.4 mg/L处理组,随着作用时间的延长,在24 h时SOD酶活力降低,为(0.420±0.086)U/mg;8.1 mg/L处理组,在暴露6、24 h,红裸须摇蚊幼虫体内SOD酶活力均稍低于对照组。同一时间不同质量浓度的Hg2+处理,对SOD活性影响的LSD法多重比较检验结果显示,24、48 h的各质量浓度Hg2+对SOD活性都没有明显差异,仅在72 h时SOD活性在对照组与其他质量浓度处理组之间的差异达到了显著性水平(p<0.05)(见表3)。
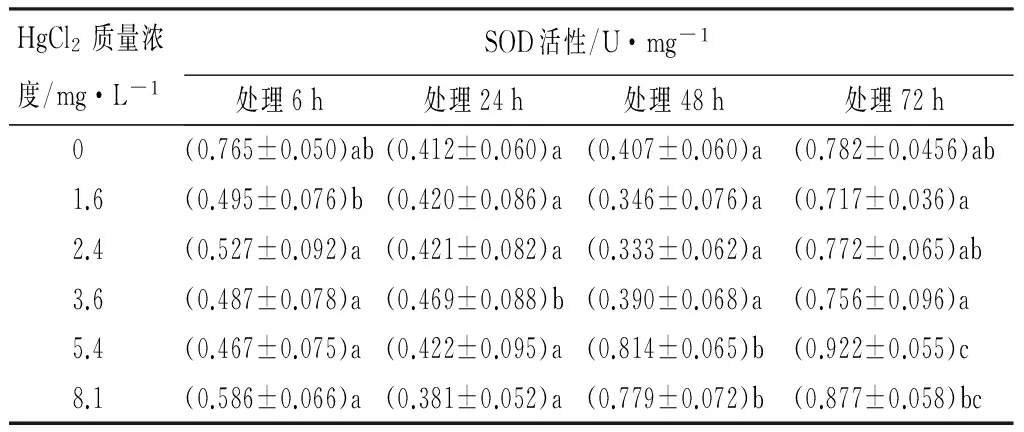
表3 Hg2+处理后红裸须摇蚊幼虫的SOD活性
注:同列不同小写字母表示差异显著(p<0.05)。
2.4 Hg2+对红裸须摇蚊幼虫体内GST活性的影响
由表4可见:Hg2+胁迫下,不同的处理组红裸须摇蚊幼虫体内GST酶的活性,在暴露24 h,1.6、2.4、3.6、5.4 mg/L各处理组,GST的活性都表现为较高,并且短的暴露时间24 h达到最大值为(0.767±0.082)U/mg。而在高质量浓度(8.1 mg/L)处理组,暴露6 h表现最高,为(0.808±0.060)U/mg。随着作用时间的延长,在24、48、72 h时,GST酶活力逐渐降低,而暴露6 h各处理组酶活性差异显著。同一时间不同质量浓度的Hg2+处理,对GST活性影响的LSD法多重比较检验结果显示,暴露48、72 h的各质量浓度Hg2+对GST活性都没有明显差异(p>0.05);在6、24 h时,GST活性在对照组与其他质量浓度处理组之间的差异达到了显著性水平(p<0.05)。说明在受到Hg2+胁迫时,不同处理组的红裸须摇蚊幼虫体内GST活性发生明显的剂量-效应关系。
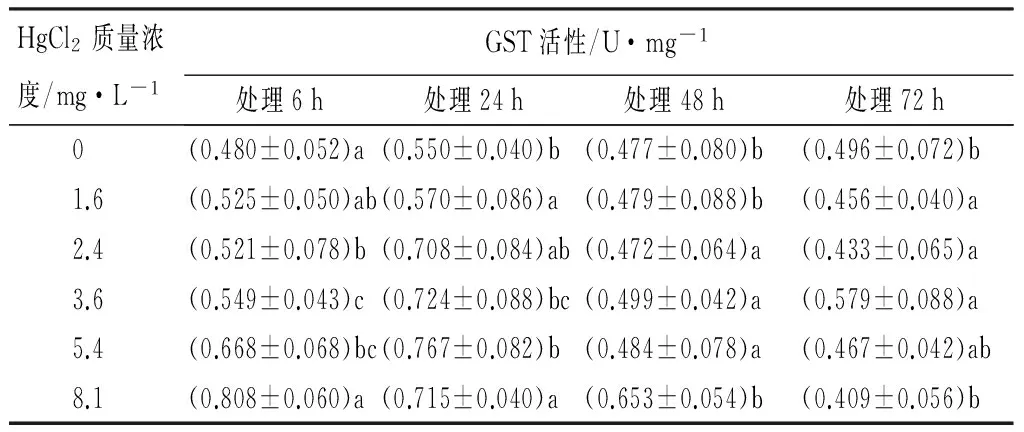
表4 Hg2+处理后红裸须摇蚊幼虫的GST活性
注:同列不同小写字母表示差异显著(p<0.05)。
3 讨论
关于汞对水生动物的急性毒性研究已有一些报道。在对鱼类和甲壳类动物的研究中,孔祥会等[13]将金鱼幼鱼置于质量浓度为0、0.2、1.0、5.0、10.0 μg/L的Hg2+溶液中,分别在汞暴露1、7、15 d时取样,测定不同质量浓度Hg2+暴露下SOD、CAT活性及丙二醛(MDA)含量。结果显示,SOD、CAT均表现出在较长的暴露时间及较高质量浓度Hg2+胁迫下的诱导效应,MDA含量也因Hg2+暴露而明显积累。
CAT、POD、SOD、GST等会受到外界刺激的影响,因而对生物机体抗氧化状态的测定、对于理解毒性效应机制及预测生物体内的潜在性损伤是十分重要的[7]。重金属对摇蚊幼虫的抗氧化酶的研究中发现,不同的摇蚊幼虫对污染物的耐受性存在一定的差异,Cd2+对红裸须摇蚊幼虫与其它摇蚊幼虫明显不同,该物种对Cd2+的急性毒性不敏感,表现出非常强的耐受能力[1]。本研究结果显示,CAT和SOD均表现出较长的暴露时间及较高质量浓度Hg2+胁迫下的诱导效应,红裸须摇蚊幼虫为了减弱汞胁迫带来的损害,CAT和SOD均有增加然后减少的抛物线形式的变化。CAT等抗氧化防御系统的一个重要特征,是其活性成分或含量可由于污染物的胁迫而发生改变,从而可间接反映环境中氧化污染的存在,因此可作为环境污染胁迫的指标。本研究发现,红裸须摇蚊幼虫体组织抗氧化防御系统中,主要抗氧化酶CAT和SOD活性对Hg2+具有较高的敏感性,而随着重金属离子暴露质量浓度的升高,其含量和活性均呈现明显的剂量-效应关系,可以作为生物标志物检测水体中Hg2+的早期污染。而且GST活性对Hg2+有诱导效应,具有极高的检测灵敏度,但是,由于检测必须在纯净的溶液中进行,因此作为实际检测物质还具有一定难度[14]。在Hg2+暴露下的红裸须摇蚊幼虫体组织,POD活性表现的规律性不明显,呈相对复杂的变化,因此认为POD不能有效用来检测水体的早期Hg2+污染。Park et al.[15]研究发现,经毒物暴露后,摇蚊幼虫体内GSTs的活性发生了显著的变化。为进一步完善Hg2+对红裸须摇蚊的抗氧化酶系统的研究,如乙酰胆碱酯酶(AChE)、GSTs等酶活性如何,还需要进一步验证。
[1] 郑先云,龙文敏,郭亚平,等.Cd2+对红裸须摇蚊(Propsilocerusakamusi)的急性毒性研究[J].农业环境科学学报,2008,21(1):86-91.
[2] 葛士林,曹传旺,王志英.3种农药对红裸须摇蚊体内蛋白质质量分数和AChE活性的影响[J].东北林业大学学报,2011,39(1):108-109,126.
[3] VERMEULEN A C, LIBERLOO G, DUMONT P, et al. Exposure ofChironomusripariuslarvae (diptera) to lead, mercury andβ-sitosterol: effects on mouthpart deformation and moulting[J]. Chemosphere,2000,41(10):1581-1591.
[4] 李浩,王琴,邓金钗,等.Cu2+对羽摇蚊幼虫(Chironomusplumosus)口器致畸作用和抗氧化酶活性的影响[J].生态和农村环境学报,2012,28(2):203-208.
[5] 李浩.铜和镉对羽摇蚊幼虫(Chironomusplumosus)和红裸须摇蚊幼虫(Propsilocerusakamusi)的毒性效应[D].武汉:华中农业大学,2012.
[6] LUND B O, MILLER D M, WOODS J S. Studies on Hg(II)-induced H2O2formation and oxidative stress in vivo and in vitro in rat kidney mitochondria[J]. Biochemical Pharmacology,1993,45(10):2017-2024.
[7] HUSSAIN S, RODGERS D A, DUHART H M, et al. Mercuric chloride-induced reactive oxygen species and its effect on antioxidant enzymes in different regions of rat brain[J]. Journal of Environmental Science and Health Part B: Pesticides, Food Contaminants, and Agricultural Wastes,1997,32(3):395-409.
[8] KOBAL A B, PREZELJ M, HORVAT M, et al. Glutathione level after long-term occupational elemental mercury exposure[J]. Environmental Research,2008,107(1):115-123.
[9] MARTINEZ E A, MOORE B C, SCHAUMLOFFEL J, et al. Morphological abnormalities inChironomustentansexposed to cadmium: and copper-spiked sediments[J]. Ecotoxicology and Environmental Safety,2003,55(2):204-212.
[10] PASCUAL P, PEDRAJAS J R, TORIBIO F, et al. Effect of food deprivation on oxidative stress biomarkers in fish (Sparusaurata)[J]. Chemico-Biological Interactions,2003,145(2):191-199.
[11] ORUC E O, SEVGILER Y, UNER N. Tissue-specific Oxidative stress responses in fish exposed to 2,4-D and azinphosmethyl[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology,2004,137(1):43-51.
[12] ZHANG J F, SHEN H, WANG X R, et al. Effects of chronic exposure of 2,4-dichlorophenol on the antioxidant system in liver of freshwater fishCarassiusauratus[J]. Chemosphere,2004,55(2):167-174.
[13] 孔祥会,王书平,仝颜娜,等.汞暴露对金鱼幼鱼抗氧化防护的影响[J].水产科学,2012,31(4):187-191.
[14] 吕彩云.重金属检测方法研究综述[J].资源开发与市场,2008,24(10):887-890,898.
[15] PARK K, BANG H W, PARK J, et al. Ecotoxicological multilevel-evaluation of the effects of fenbendazole exposure toChironomusripariuslarvae[J]. Chemosphere,2009,77(3):359-367.

