一株猪源屎肠球菌的分离鉴定及系统进化分析
韩明渠,李富伟,吴培均
(北京科为博生物技术研究院,北京 100086)
抗生素作为饲料添加剂在畜禽动物防病、抗病以及促生长等方面效果显著,为集约化畜牧业的发展做出重大贡献[1]。但是,人们发现抗生素饲料添加剂在带来巨大经济效益的同时,也造成了很大的危害,长期滥用抗生素引起病原菌产生耐药性、二重感染、破坏动物体内微生态平衡及降低动物免疫功能等,这些都对养殖业、饲料工业和动物带来严重威胁。近年来,饲用抗生素替代品的种类较多,主要有微生态制剂、酶制剂、寡糖、植物提取物、糖萜素、酸化剂等[2]。其中,微生态制剂以其无残留、无耐药性、无毒副作用以及效果显著、成本低等优点而日益受到重视。微生态制剂在促进肠道内有益菌的代谢与繁殖、维持肠道微生态平衡、提高宿主动物免疫力、改善饲料利用率和生产繁殖能力以及改善环境污染等方面都有较强的效果[3]。
2013年我国农业部发布的《饲料添加剂品种目录》中允许添加的饲用微生物有34种,其中以乳酸菌为主,包括屎肠球菌、嗜酸乳杆菌、植物乳杆菌等22种乳酸菌,还有芽孢杆菌、酵母菌及真菌。乳酸菌作为最早的饲用微生物添加剂菌种,已广泛应用于畜禽、水产养殖等各个领域。屎肠球菌具有生长速度快,有较好的黏附能力,可产生乳酸和一些抗菌物质[4]。1989年,美国联邦食品和药物管理局(FDA)和美国饲料控制官员协会(AAF⁃CO)就将屎肠球菌列为可直接添加于动物饲料的菌种之一,加之其兼性厌氧的生理特性,使其与厌氧培养保存条件苛刻的其他乳酸菌相比,更适合于生产和应用。本试验从健康猪肠道及其内容物样品中,分离获得了一株乳酸菌CE001,采用形态学、生理生化及分子生物学相结合的多相分类鉴定技术,将该菌株初步鉴定为屎肠球菌。
1 试验材料
1.1 样品
猪肠道及内容物样品采自于北京资源肉制品厂屠宰流水线。
1.2 培养基
MRS液体培养基:蛋白胨10 g,牛肉膏5 g,酵母膏5 g,葡萄糖20 g,吐温-80 1 mL,磷酸氢二钾2 g,乙酸钠5 g,柠檬酸二铵2 g,硫酸镁0.2 g,硫酸锰0.05 g,蒸馏水1 L(pH 6.8,121℃灭菌20 min)。
固体筛选培养基:MRS液体培养基+1.5%(w/v)琼脂+1%轻质碳酸钙。
2 试验方法
2.1 菌种分离与纯化
2.1.1 菌种分离
采用10倍梯度稀释法对样品进行稀释,用无菌移液管准确吸取1 mL不同稀释度的菌液,分别放入3组平行的培养皿中,然后在培养皿中倒入已融化并冷却至约50℃的固体筛选培养基,轻轻转动平板,使菌液与培养基混合均匀,37℃倒置培养48 h。
2.1.2 菌种纯化
待菌落长出后,挑取钙溶圈明显的菌落,采用三线法接种于固体筛选培养基平板上,37℃倒置培养48 h,获得单菌落,保存备用。
2.2 菌种鉴定
2.2.1 形态学鉴定
对划线纯化后的菌株进行革兰氏染色镜检,筛选革兰氏阳性球菌。
2.2.2 生理生化鉴定
接触酶、氧化酶测定及碳水化合物发酵产酸试验方法,参照《常见细菌系统鉴定手册》[5]。
2.2.3 分子生物学鉴定
16S rRNA基因的PCR扩增与测序。按照细菌基因组DNA抽提试剂盒提取CE001菌株的基因组DNA。以基因组DNA为模板PCR扩增16S rRNA基因,扩增引物采用细菌通用引物27F(5'-AGAG TTT⁃GATCCTGGCTCAG-3')和 1492R(5'-GGTTACC TT⁃GTTACGACTT-3')(北京睿博兴科生物技术有限公司合成)。PCR反应体系(20 μL):10×Buffer 2 μL,dNTPs 2 μL,10 mol·L-1引物 1 μL,TaqDNA 聚合酶 0.1 μL,DNA 模板1 μL,ddH2O 补足至20 μL。PCR反应程序为:95℃预变性5 min;95℃30 s,55℃1 min,72℃90 s,共35个循环,72℃10 min延伸,扩增的PCR产物在1%琼脂糖凝胶上进行电泳检测。
pheS基因的PCR扩增与测序。以基因组DNA为模板PCR扩增pheS基因,扩增引物采用pheS-21F(5'-CAYCCNGCHCGYGAYA TGC-3')和 pheS-22R(5'-CCWARVCCRAARGCAA ARCC-3')(北京睿博兴科生物技术有限公司合成)[6]。PCR反应体系(20 μL):10×Buffer 2 μL,dNTPs 2 μL,10 mol·L-1引物1 μL,TaqDNA聚合酶0.1 μL,DNA模板1 μL,ddH2O补足至20 μL。PCR反应程序为:95℃预变性5 min;95℃ 1 min,46℃ 135 s,72℃ 75 s,3个循环后,95℃变性35 s,46℃75 s,72℃75 s,30个循环后72℃ 7 min,扩增的PCR产物在1%琼脂糖凝胶上进行电泳检测。
基因序列测定及系统发育分析。将所得序列在GenBank数据库中进行BLAST,然后选择相似性较高的模式菌株序列,利用MEGA 6.0软件进行多序列同源性比对,由于序列测序结果中前后的数十个碱基的错误率较高等原因,可将同源性比对结果中前后差异较大的部分去除,用邻位相连法构建系统发育树,并进行1 000次重复的Bootstraps统计学检验。
3 结果与分析
3.1 形态特征
在固体筛选平板上,菌落呈灰白色,圆形、完整、不透明;革兰氏染色呈阳性,细胞为球形,如图1所示。
3.2 生理生化特征
接触酶和氧化酶反应均呈阴性,碳水化合物发酵产酸试验结果见附表。
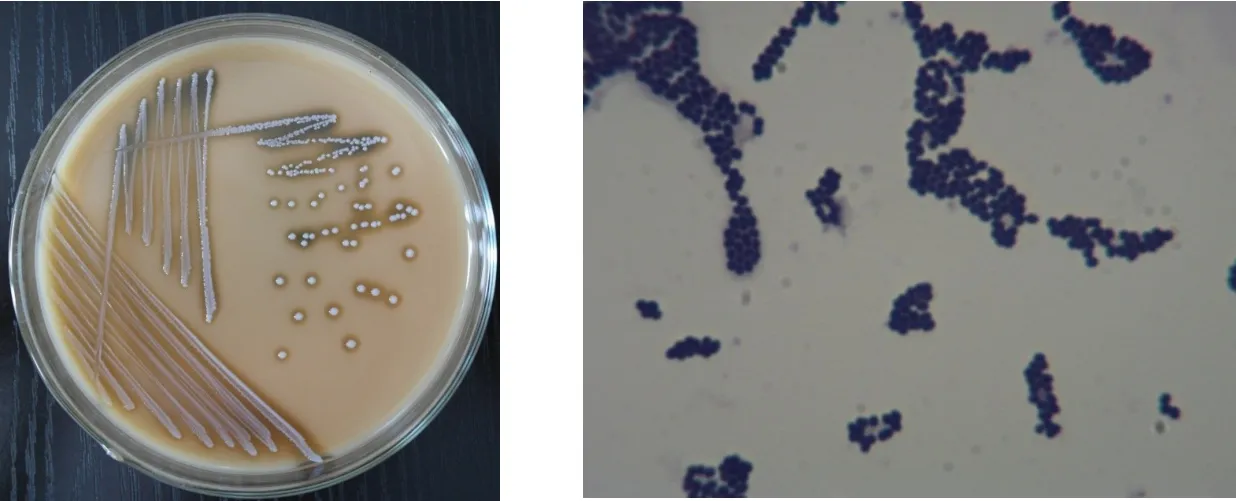
图1 菌株CE001菌落形态及显微形态
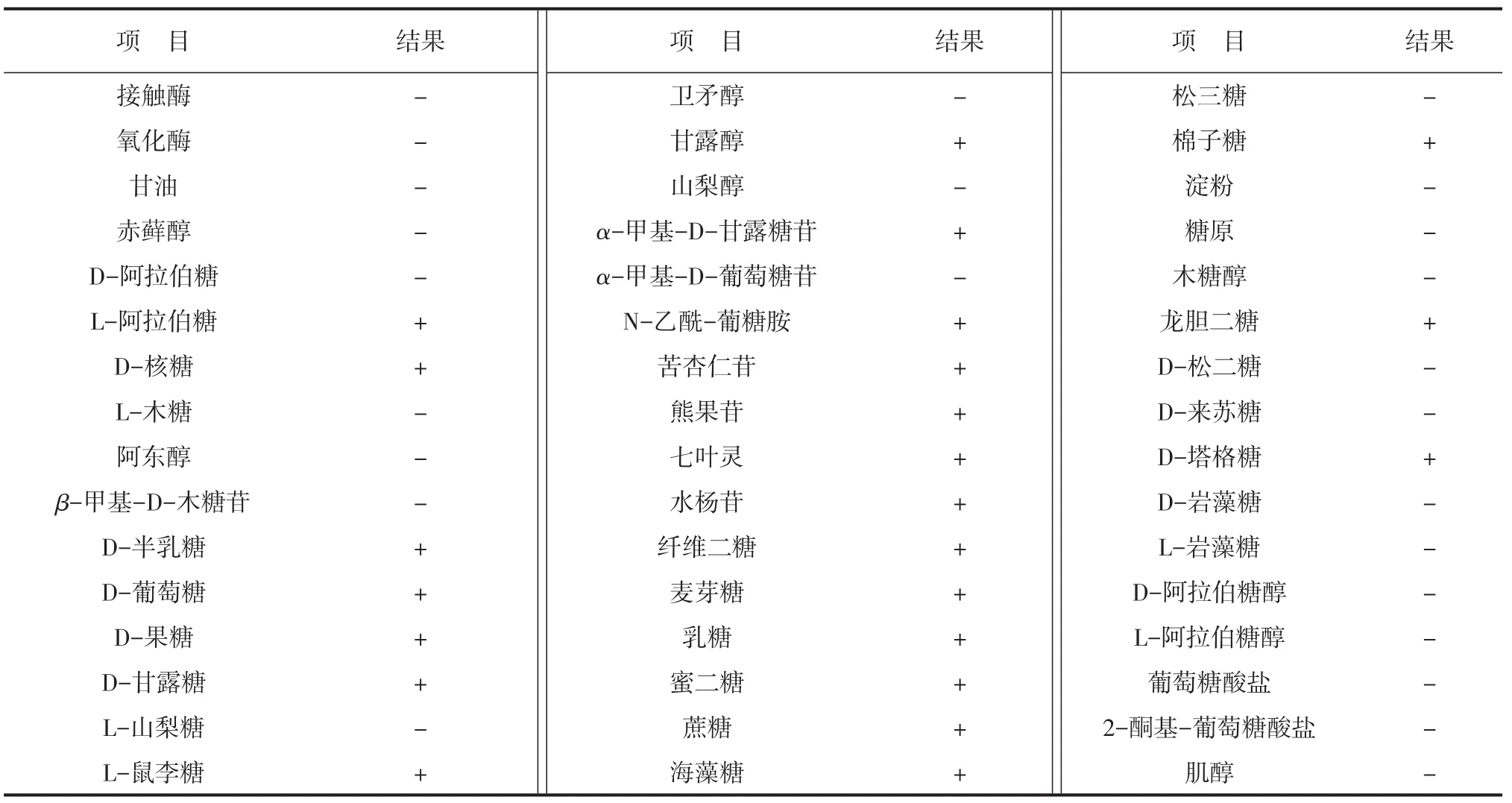
附表 生理生化特征
3.3 16S rRNA基因和pheS基因序列系统进化分析
菌株CE001的16S rRNA基因测序结果在Gen⁃Bank中进行Blast比对分析,其序列全长为1 393 bp,与肠球菌属的16S rRNA基因序列相似性最高。选取Lactobacillus plantarum subsp.argentoratensisDKO 22T(AJ640078)作为外类群,利用Mega 6.0软件构建菌株CE001与肠球菌属部分模式种16S rRNA基因系统发育树见图2。如图2所示,菌株CE001与Enterococcus faeciumATCC 19434T(DQ411813)同 处一个进化分支,亲缘关系最近。
3.4 pheS基因序列分析
菌株CE001的pheS基因测序结果在GenBank中进行Blast比对分析,其序列全长为472 bp,与肠球菌属的pheS基因序列相似性最高。选取Lactobacillus plantarumLMG 6907T(AM087714)作为外类群,利用Mega 6.0软件构建菌株CE001与肠球菌属部分模式种pheS基因系统发育树见图3。
如图3所示,菌株CE001与Enterococcus faeciumLMG 13590T(AJ843388)同处一个进化分支,亲缘关系最近。
综合菌落形态特征、生理生化特征以及16S rRNA基因和pheS基因序列的系统发育分析结果,将菌株CE001初步鉴定为屎肠球菌,在中国普通微生物菌种保藏中心的保藏号为CGMCC9666。
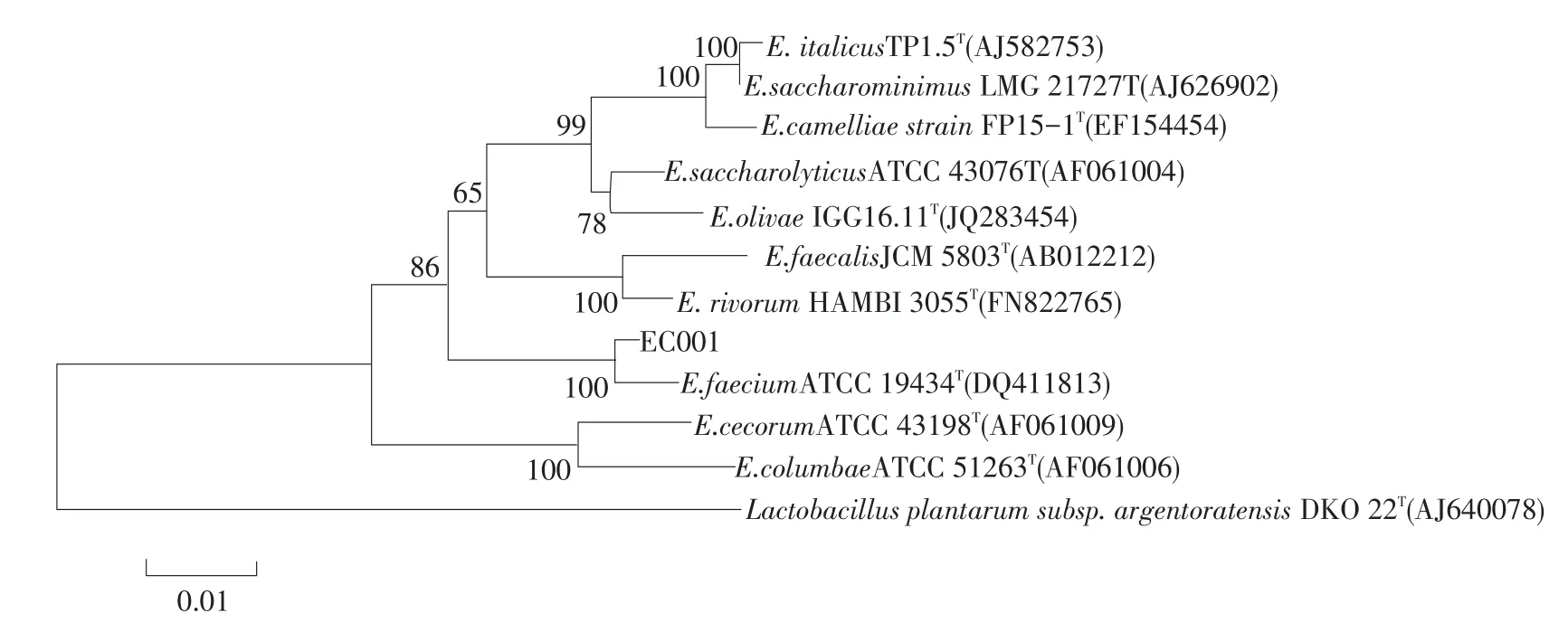
图2 16S rRNA基因序列系统发育树

图3 pheS基因序列系统发育树
4 小结
细菌的鉴定方法包括以形态特征、生理生化特征为参照的经典分类法,脂肪酸指纹分析和Bio⁃log碳源分析等化学分类法,以及基于16SrRNA基因和持家基因的序列分析的分子生物学分类法[7-8]。其中,利用分子生物学技术根据菌株的基因进行鉴定,可以将菌株的分类地位划分的更确切。16S rRNA基因在原核生物中高度保守性,逐渐成为细菌检测和鉴定的一种强有力工具[9]。但是,人们发现16S rRNA基因对于相近种或同一种内的不同菌株之间的分辨率较低。研究发现编码苯丙氨酰-tRNA合成酶α亚基的pheS基因,具有高保守性和差异性且分辨率高于16S rRNA,因而被应用于乳酸菌分子分类鉴定的研究[10]。综合应用表型分类、化学分类和分子分类等方法,即采用多相分类鉴定技术可得出准确的鉴定结果。
本研究中分离获得的菌株CE001,综合菌落形态特征、生理生化特征以及16S rRNA基因和pheS基因序列的系统发育分析结果,初步鉴定为屎肠球菌,在中国普通微生物菌种保藏中心的保藏号为CGMCC9666。目前,屎肠球菌在畜牧生产上应用广泛,在提高生产性能、降低饲料利用率、维持肠道微生物菌群平衡、提高免疫力、提高肉质品质等方面效果显著[11-13]。本研究在建立动物源乳酸菌优良菌种高效筛选及鉴定的基础上,下一步将对菌株的抗逆性能、产酸性能和抗菌性能等生物功能进行综合评价,从而为微生态制剂的开发利用提供优良菌种资源。
[参考文献]
[1] 魏建英,张然,丁胜,等.抗生素类饲料添加剂在畜牧业中的使用[J].北方农业学报,2004(4):52-53.
[2] 李爱科,林燕,赵永欣.饲用抗生素替代品研究进展[J].饲料工业,2013(20):1-6.
[3] 张日俊.动物微生态制剂(益生菌)的标准、评价规程、功能和发展趋势[J].饲料工业,2015,36(4):1-7.
[4] 龚琪,曾娟娟,石德时,等.益生性屎肠球菌HDRsEf1对雏鸡盲肠菌群发育的影响[J].华中农业大学学报,2015,34(1):78-82.
[5] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].科学出版社,2001.
[6] Naser S M,Thompson F L,Hoste B,et al.Application of multilo⁃cus sequence analysis(MLSA)for rapid identification ofEntero⁃coccus speciesbased onrpoAandpheSgenes[J].Microbiology,2005,151(7):2 141-2 150.
[7] 石禹.芽孢杆菌的多态性研究及硅酸盐细菌的分类鉴定[D].哈尔滨:东北农业大学,2008.
[8] 程池,杨梅,李金霞,等.Biolog微生物自动分析系统——细菌鉴定操作规程的研究[J].食品与发酵工业,2006,32(5):50-54.
[9] 杨霞,陈陆,王川庆.16S rRNA基因序列分析技术在细菌分类中应用的研究进展[J].西北农林科技大学学报:自然科学版,2008,36(2):55-60.
[10] Naser S M,Ancanneyt M V,Snauwaert C,et al.Reclassification ofLactobacillus amylophilusLMG 11400 and NRRL B-4435 asLactobacillus amylotrophicussp.nov[J].International Journal of Systematic&Evolutionary Microbiology,2006,56(Pt11):2 523-2 527.
[11] 葛龙,李波.屎肠球菌在饲用微生态制剂中的研究与应用[J].饲料与畜牧:新饲料,2013(6):57-59.
[12] 王凡,王建设,刘婷,等.一株猪源屎肠球菌的分离、鉴定及益生功能初步研究[J].中国畜牧兽医,2012,39(7):231-234.
[13] 张利勃,张瑞,王小杰,等.一株猪源屎肠球菌的分离及其种属鉴定[J].现代畜牧兽医,2014(2):41-43.

