饲料工业中应用的酵母及其衍生产品
陈 鹏,丁武亿
(1.北京英惠尔生物技术有限公司,北京 100081;2.赣州市畜牧研究所,江西 赣州 341000)
酵母在分类中是真菌界的单细胞真核微生物。大小通常为3~4 μm,具有核膜和细胞壁,但与植物不同,其无叶绿体。酵母是异养生物,依靠活的和死的有机物质作为能量和营养的来源。酵母细胞有两种方式获得营养,一是通过产生和释放各种蛋白水解酶,糖酵解酶或脂肪分解酶来消化有机物质,二是通过细胞壁吸收氨基酸和单糖[1]。酵母繁殖是出芽和分裂生殖过程。出芽生殖是指当母本细胞体积增加时,沿着细胞壁形成突起的“芽”,从母本细胞上断裂或部分连接在细长细胞上。当母本细胞分裂成两个子细胞时是分裂生殖[2]。酵母是兼性厌氧菌,可以在有氧或无氧条件下生存和生长。在有氧条件下,酵母繁殖,通过氧化代谢将氧气和糖转化为二氧化碳和能量,酵母细胞高效的生长。在厌氧条件下,比如在酒和燃料的乙醇生产中,酵母生长的效率低得多,此时生产乙醇[3]。
动物饲料中使用各种形式的酵母和酵母衍生物已有100多年的历史。由于欧盟和美国政府最近限制或取消具有促生长作用的抗生素在动物饲料中使用,对使用可替代产品(包括酵母产品)保证动物健康和促进生长性能的关注显著增加。此外,近年来通过酵母发酵工艺生产的饲料原料(例如DDGS)也大幅度增加[4]。因此,含有酵母的饲料添加剂和饲料原料的种类很多,形式多样。但动物营养学家不确定这些产品之间的特定差异,及其在动物营养和健康方面的潜在作用。此外,尽管含酵母的添加剂和饲料原料已经在饲料工业中被广泛使用了数十年,但还没有标准的检测分析方法来量化酵母及其重要的生物化学成分。目前,关于能准确和实际地定量检测饲料业中使用的酵母的成分的报道很少。因为需要确定使用量和日粮添加比例以达到最佳的生物活性物质量,不能准确量化饲料添加剂和饲料原料中的酵母和酵母组分成为了一个重要的问题,因此值得去研究。酵母和酵母组分的定量检测对于在动物发挥最佳健康和性能以及防止对酵母生物活性成分的过度摄取是至关重要的。因此,本文的目的是描述饲料添加剂和饲料原料中各种形式的酵母,评估各种检测量化酵母和已知活性成分的各种方法。
1 商业用途酵母菌
酵母菌数量巨大,在自然环境中几乎无处不在。可以在水果、蜂蜜、土壤、水、植物茎、叶和花中被分离出来。天然存在于常见饲料原料如谷物、谷物副产品、青贮饲料和干草饲料中。大多数酵母菌种对人类和动物既不有害也不有益。一些酵母属(假丝酵母属,隐球酵母属,球形酵母属和丝孢酵母属)是致病的,而一些种类(酿酒酵母,马克思克鲁维酵母,产朊假丝酵母)能产生有益的作用[5]。
酵母约有60个不同属,由约500个不同的种组成。酵母菌种的差异体现在细胞形态、不同底物的代谢和繁殖过程。仅有少数的菌种有商业用途。商业应用包括生产酒精饮料(如啤酒、葡萄酒和烈酒)、非酒精饮料(如克瓦斯、红茶菌、酸牛奶)、面包和糕点烘烤、生物治疗、生产工业乙醇、营养补充剂、益生菌、食品添加剂和调味剂,科学研究和基因工程生物材料。啤酒酵母是用于生产食品、饮料(蒸馏酒和啤酒)和燃料乙醇生产过程的主要菌种,将葡萄糖和蔗糖转化为乙醇。其他具有商业用途的重要的酵母菌株包括以牛奶中的葡萄糖和乳糖为底物的乳清酵母和在造纸木浆中使用木糖和葡萄糖作为底物的Torula酵母[6]。
酵母细胞内的化学成分包括氨基酸、肽、碳水化合物、盐、谷氨酸钠、核酸(RNA)、酶和辅因子[7]。酵母细胞壁由葡聚糖、糖蛋白、甘露聚糖和几丁质组成[8-9]。这种组合使酵母无论作为动物饲料中的营养补充剂,还是作为有用的营养保健品都受到关注。
2 酵母和含有酵母的饲料原料
2.1 活性酵母产品
活性酵母产品通常添加到饲料中利用其潜在的益生作用。饲料工业中常用的活酵母是约95%干物质的活性干酵母。还有在烘焙业广泛使用的湿酵母饼(30%干物质)和酵母膏(约20%干物质)。这3种活酵母菌株都可以作为接种物来生产酵母培养物。酵母培养物也是饲料工业中常见的酵母发酵产品。
每g活性干酵母含有150~250亿个活酵母细胞(菌落单位cfu)。3种最常用的加工方法包括隧道干燥酵母(粒状粉末),流化床干燥酵母(椭圆形球体中快速上升)和旋转干燥酵母(生产小球)。美国最常见的是隧道干燥和流化床干燥方法,而在欧洲和拉丁美洲,旋转干燥法更常见。这些干燥方法中,流化床干燥已经成为最流行的方法,因为其对酵母细胞的损害较小,活力得以保持。
另外,纯活性干酵母在稀释饲料添加剂产品中也有发现(稀释原料如稻壳和酒糟可溶物)。许多稀释的产品仅含5×109cfu·g-1,占纯活性干酵母cfu的20%~25%。因此,比较这些产品与商业纯活性干酵母产品的价格非常重要。另外,只有了解了产品中的cfu数,才能达到所需的饲喂剂量和预期的生长和健康效果。
储存方法对维持活性干酵母的稳定性和发酵活性非常重要。活性干酵母在氧气或空气中储存时,其稳定性降低。因此,使用真空包装或使用惰性气体储存在包装材料中将有助于确保最佳的稳定性。
许多饲料制粒后才饲喂动物。造粒过程使用蒸汽(湿热)来调节进料,然后挤压制成颗粒。杀死微生物的最有效的方法之一就是湿热,使酶系统变性,机体代谢活动和生存受到抑制。因此,活性干酵母产品添加到饲料中制粒时,其活力很可能会降低或被消除,失去益生菌的效果。评估不同的饲料生产条件下酵母的存活率的研究很少。在85℃下加热8 min,活性干啤酒酵母(7%水分)的存活率未受影响,但是当水分增加到19%,只有0.1%存活。计算不同的水分和温度条件下活性酵母细胞数量,结果表明,湿热和脱水是造成酵母细胞死亡的主要因素[10]。这些结果和Aguirreguzman等研究都表明,在典型造粒过程之后,未受保护的酵母细胞的存活率降变低[11]。因此,在评估颗粒饲料中酵母细胞的功能时,必须测定细胞繁殖力和细胞活力,并比较不同方法评估活性和活力的的优缺点[12]。
2.2 酵母培养物
酵母培养物是一种独特的酵母产品,是酵母生物质和在特定发酵过程中产生的发酵代谢物的混合物。生产酵母培养物,要用活酵母细胞接种到特定的培养基,并在特定的条件下发酵,随后将整个发酵的培养基干燥。随着酵母细胞发酵,培养基中的糖产生各种各样的代谢产物,包括肽、醇、酯和有机酸。然而,产生什么样的代谢物取决于所使用的发酵培养基的组成和发酵条件。因此,酵母培养物是独特的饲料添加剂,含有几种对动物营养和健康有有益作用的不确定代谢物,但不是饲料中的营养素。
2.3 营养性酵母产品
干酵母、啤酒干酵母、啤酒液体酵母、产朊假丝酵母和乳清酵母是营养性酵母产品,由死酵母细胞的酵母生物质组成,具有饲喂营养价值。干酵母价格高,主要用于食品工业作为营养补充剂[13]。啤酒酵母常用于饲料工业,作为特种氨基酸、维生素和矿物质的补充剂。啤酒酵母粗蛋白质含量约为46.5%,与去皮豆粕相似。然而,酵母中约20%的粗蛋白质相当于核酸(总组分的6%~8%),这限制了酵母产品能够饲喂动物的量[9]。此外,虽然啤酒酵母产品的总赖氨酸、蛋氨酸和苏氨酸含量优于去皮豆粕,但所有必需氨基酸的标准化回肠消化率(猪)显著低于去皮豆粕。啤酒酵母中的脂质(乙醚提取物)和中性洗涤纤维含量分别是去皮豆粕的两倍和一半,因此啤酒酵母的代谢能(猪)更高。此外,与去皮豆粕相比,啤酒酵母含有更多的磷,富含B族维生素。
酵母细胞(比如啤酒酵母或活性干酵母)中的大多数营养物质来源于细胞内部。因此,必须溶解酵母细胞以释放这些营养物质供动物消化和吸收。细胞溶解可以通过动物胃肠道中的微生物分泌蛋白酶和葡聚糖酶来完成,水解酵母细胞壁并释放其内容物。活酵母细胞内的酶可引起细胞壁的自溶以释放营养素。氨基酸和维生素的消化率和生物有效性在活酵母和死酵母中的差异是还是未知,但是活酵母细胞可能更高,原因是用于生产死酵母产品的干燥温度较高。有研究表明,在干燥饲料原料时使用过高的温度会形成美拉德产物,降低氨基酸利用度,并且可以加速脂质过氧化,降低脂溶性维生素的生物活性[14]。
用低价值、非食用木质纤维素生物质生产营养酵母产品用于水产饲料的技术正在兴起。用木质纤维素生物质生产酵母的一般过程涉及4个主要步骤,预处理、酶水解、发酵和后加工。研究表明,一些酶能够切割存在于木质纤维素生物质中的顽拗性多糖中的糖苷键[15]。并且通过基因工程酵母菌株将该生物质中的糖转化为酵母生物质[16]。尽管源自木质纤维素生物质的营养酵母产品没有成为商品,但是这种技术是有希望的,并且会创造更多的高价值,可持续营养性酵母产品。
2.4 特色酵母产品
2.4.1 辐射酵母
辐射酵母含有麦角甾醇,当用紫外线照射时可转化为维生素D2(麦角钙化醇)[17]。辐射酵母曾经是维生素D的重要来源,但是市场上更低价的合成维生素D3(胆钙化醇)已经将其取代。
2.4.2 酵母硒
商业化生产和销售的酵母硒是高生物有效性硒(硒代蛋氨酸)。与喂食无机硒相比,酵母硒有独特的代谢作用,改善动物的健康状况,并增加肉和蛋中的硒含量[18]。尽管啤酒酵母含硒1~2 mg·kg-1,但一些商品高含量硒酵母含硒高达2 000 mg·kg-1。
2.4.3 酵母铬
酵母铬是三价铬,并结合生物活性肽、氨基酸和烟酸,发挥类似于“葡萄糖耐受因子”的功能,作为胰岛素活性的生理增强剂以改善碳水化合物代谢。Mowat等研究表明,在牛受到运输应激后饲喂含有酵母铬的饲料,降低了发病率,并能改善生长性能[19]。Lindemann等比较了4种有机形式铬的相对生物有效性和安全性,结果表明,三铬酸铬的生物有效性最高,其次是蛋氨酸铬、酵母铬和丙酸铬,与对照组相比,饲喂酵母铬的猪的生长速度有所提高[20]。
2.4.4 法夫酵母
法夫酵母产生红色素或类胡萝卜素(虾青素),在鳟鱼和鲑鱼饲料上使用可增强鱼片红色素沉着。虽然这种来源的虾青素比合成形式的类胡萝卜素更昂贵,但生物利用度更高。
2.5 酵母片段产品
酵母浓缩可溶物、水解产物、提取物和细胞壁是食品和饲料行业另外一类原料。酵母自溶产物由裂解的全酵母细胞组成(使用酸或酶或高盐溶液增加渗透压而使细胞破裂),含有细胞内和细胞壁组分。酵母提取物仅由细胞内成分组成,而酵母细胞壁仅由在细胞壁中的碳水化合物组成。酵母自溶物和提取物主要用在食品工业增强食物的风味。酵母提取物也被用作发酵和制药工业中的微生物刺激剂,和微生物学家用于优化细菌生长和实验室生长培养基[7]。
酵母的碳水化合物含量和组成根据生长环境而变化,通常被分为细胞内或细胞壁碳水化合物[21]。细胞内碳水化合物主要由糖原和海藻糖组成,是酵母细胞的主要能量储备。据报道,面包酵母含有16%~20%的糖原和6%~10%的海藻糖[22]。细胞壁约占酵母细胞干重的15%~20%,主要的多糖组分是β-葡聚糖和甘露聚糖。
葡聚糖是酿酒酵母中的主要多糖组分,支持细胞壁结构的高度不溶性部分。酵母细胞壁内层由不溶性β-葡聚糖(30%~35%)组成,中间层为可溶性β-葡聚糖(20%~22%),外层由糖蛋白组成(30%)[23]。葡聚糖的结构由具有β-1,6分支连接的β-1,3葡聚糖组成,在酵母自溶时产生内切和外切β-1,3葡聚糖酶[21]。β-葡聚糖对动物健康和生长性能具有潜在的有益作用,在饲料行业中应用盛行。研究表明其能吸附或结合毒素、病毒和病原菌[24]。免疫细胞(巨噬细胞)具有β1,3/1,6支链葡聚糖的受体。营养学和药物学对其作用机理研究透彻,有证据表明,日粮中的β-葡聚糖可以提高幼畜动物和鱼虾的免疫能力[25]。
甘露聚糖是酵母细胞壁的第二重要组成部分,甘露聚糖是高度分支的多聚体,以α-1,6-甘露糖为骨架链,大部分甚至全部的残基具有α-1,2或α-1,3连接的含有2~5个甘露糖残基的侧链[21]。磷与甘露聚糖相连,含量为0.04%~4.4%。甘露寡糖(MOS)作为益生元或胃肠道中某些微生物的营养来源,发挥益生效应。Spring等评估了MOS对伴侣动物、马、兔、家禽、猪、小牛和各种水产动物的影响,表明体增重和饲料转化率总体上有正向的改善,同时死亡率降低[26]。作用机制是MOS能结合并限制病原体在胃肠道中的定殖,改善肠黏膜的完整性,调节免疫系统活性,并参与抗氧化和抗诱变防御的结果。
酵母也是高浓度核苷酸和蛋白质的来源。水解酶(核酸酶和蛋白酶)位于酵母细胞基质中,自溶分解核苷酸和蛋白质。核酸酶将核酸、DNA和RNA降解成核苷酸,蛋白酶将蛋白质降解为肽和氨基酸衍生物[27]。据报道,酵母中总核酸的浓度在3.3%~9.5%和7%~12%[21,28]。了解酵母类产品中核酸的含量很有必要,越来越多的证据表明在单胃动物日粮中补充核苷酸可能影响肠道形态及功能、免疫反应、肠道微生物群的组成、肝功能及形态和生长性能[29]。
2.6 玉米乙醇副产品中的酵母和酵母成分
在乙醇生产中,酵母发酵谷物(例如玉米)后生产大量的各种副产品,作为饲料原料饲喂给动物。包括DDS、DDG、DDGS、浓缩酒糟可溶物、酒糟湿谷物、谷物酒糟干酵母,都是饮料和燃料乙醇工业生产的副产品[14]。生产这些副产品的酿酒酵母菌株和生产工艺都是不同的,因此含有的酵母数量和营养成分各异。
这些副产品中酵母的组成和功能特性研究尚不完善,缺乏标准化的检测方法来确定这些成分中的死酵母数量及其化学成分。Han等开发了一种多元线性回归模型,用DDGS整个生产过程中氨基酸组成的相对百分比变化,确定酵母蛋白质对总DDGS蛋白质含量的贡献:
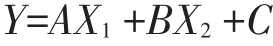
Y为乙醇生产流程中氨基酸的相对百分比,X1为粉碎玉米氨基酸的相对百分比,X2为酵母氨基酸的相对百分比,A为玉米对氨基酸贡献的常数,B为酵母对氨基酸贡献的常数,C为Y轴上截距常数。这个分析中,A、B、C变量在不同的工艺上变化很大,但是不同的样本来源之间变化不大。根据这个以玉米和酵母的氨基酸组成为因变量的方程,估计酵母蛋白占DDGS粗蛋白含量的20%,玉米蛋白占总蛋白的80%[30]。
多元线性回归模型考虑了玉米和酵母中所有氨基酸组成,基于氨基酸的相对百分比而不是氨基酸的绝对浓度,并可用于估计中间工艺流程和DDGS中的酵母含量。然而,不同品种和年份玉米的氨基酸组成是不同的,不同酵母菌株的氨基酸组成也可能不同。尽管可以以蛋白质或氨基酸为基础计算DDGS中酵母的含量,但可能发挥更大潜在营养和健康作用的是玉米副产品中的酵母β-葡聚糖,甘露寡糖和核苷酸含量。
与计算DDGS中酵母含量一样,DDG中β-葡聚糖含量的研究报道结果差异很大。Chhon等估计DDGS含有β-葡聚糖0.57%[31]。而Kim等报道,DDGS中葡聚糖的平均含量为21.2%。这种差异可能是由于分析方法的差异和所测定的β-葡聚糖的实际组成[32]。Alizadeh等研究表明,小麦-玉米DDGS中甘露糖和核苷酸的浓度分别为1.6%和0.13%。因此,缺少标准化的检测方法,对发酵谷物副产品中酵母含量和衍生物分类也存在固有难度[33]。
3 测定酵母和酵母衍生物含量的方法
3.1 直接测量酵母细胞
其可以快速且低廉地检测饲料添加剂和原料中酵母和酵母衍生物的商用仪器受到广泛需要。量化饲料添加剂和原料中酵母组分的唯一一种已开发的方法仅适用于活酵母产品(活性干酵母)。评估纯酵母样品的浓度和活力的方法已经开发了几种,包括使用血细胞计数器的光和荧光显微镜、流式细胞术和荧光显微镜[34]。血细胞计数法相对便宜且使用简单,但容易出现人为错误,导致测定的高度变异性[35]。流式细胞术具备自动化的数据采集,缺点是价格昂贵,技术人员需要经过培训来正确操作和清洁设备,避免样品之间的交叉污染[36]。一些研究评估了荧光显微镜对酵母的定量,包括对纯酵母样品的分析[37]。使用血细胞计数器手工计数方法测定玉米粉中酵母含量的得出了不一致的结果,因为玉米粉中的碎片会干扰流式细胞仪系统并引起非特异性荧光信号[38]。最近,Chan等开发并评估了一种简单的成像细胞计数方法,确定生物乙醇生产中玉米粉发酵酵母的浓度和活力[39]。该方法使用自动细胞计数器、稀释缓冲液和染色溶液通过荧光准确检测活的和死的酵母含量,但尚未用作评估干燥玉米副产物。
手工酵母平板计数似乎是最准确的方法,因其可测定产品中活的和有活性酵母细胞的实际数量。简单来说,将含酵母的产品悬浮液连续稀释于水中,然后将不同的稀释液铺在营养培养基上约3 d,使其生长繁殖。计算每个平板上酵母菌落数量。
亚甲基蓝染色是手工计数非活性染色酵母的标准方法,但含量和活力结果不稳定,很难在玉米粉碎片中鉴别和区分非活性的酵母[40]。该方法需要破坏酵母细胞壁以使染色剂进入细胞。如果酵母细胞由于受热使酶系统变性而死亡,死细胞的细胞壁不能吸收染色剂,染色失败。用亚甲基蓝染色计数酵母细胞也很耗时,并且技术人员的精准性也是不同的,难以自动化[41]。另一种方法是直接测定代谢终产物或底物消失来分析酵母的代谢活性。但这种方法不如酵母平板计数方法可靠,因为其他微生物(如细菌)产生的代谢物可能会产生大量的干扰。
3.2 确定酵母繁殖力和活力的方法
酵母繁殖力可以描述为活酵母细胞相对于总酵母细胞的百分比,而细胞活力是指酵母细胞的生理能力[12]。在商品益生菌饲料产品中经常添加酵母细胞,酵母的浓度和活力是确定潜在有效性的重要指标。因此,不仅要确定副产品和含酵母的饲料添加剂中酵母细胞的浓度,而且还可以确定其活力。比较测定酵母细胞生存力和活力不同方法的优缺点,结果表明,不同方法的结果不尽相同,无一种方法足够量化繁殖力和活力[12]。使用6种不同的培养基比较了酵母分化的复原和有效性,结果表明,从含有霉菌的样品中分离和计数酵母菌很不容易,霉菌很快遮盖了琼脂平板的表面[42]。因此,用这个方法对乙醇玉米副产品中的酵母定量挑战很大,因其副产品中可能存在霉菌。比较测定活性干酵母、用谷物载体稀释的干活酵母混合物、与活性干酵母混合的矿物混合物、谷物全价饲料、以及酵母培养物中的酵母繁殖力的8种不同方法,结果是,除了使用FDA的细菌分析手册DG18方法外,其他方法之间无区别,可以互换使用[43]。然而,评估用细胞内糖原和海藻糖浓度作为酵母活力预测因子的可能性,表明酵母繁殖力与酵母细胞的酸溶性糖原或海藻糖之间存在相关性,但这种相关性对实验环境和细胞碳水化合物含量有特异性[44]。如果不事先了解酵母的储存条件,不能用这种相关性预测酵母繁殖力。
3.3 确定DDGS中酵母和酵母衍生物的方法
尽管DDGS总蛋白质中一部分来源于酵母,但尚无明确的分析方法来确定酒糟副产品中的死酵母及其化学成分。有研究通过对玉米和酵母中氨基酸的相对百分比与DDGS总氨基酸进行多元线性回归分析,结果表明,DDGS中约20%的蛋白质来源于酵母,其余80%来源于玉米。然而,并不能推断酵母生物量对DDGS生物量的贡献率为20%[30]。这种方法并不能准确估算发酵玉米副产品中酵母含量。
可以利用酵母细胞壁独特的化学特征,例如甘露聚糖含量,更准确地评估玉米副产品中的酵母含量。最近研究表明,各种乙醇酵母产品的平均甘露聚糖含量为10.3 mg·100 mg-1。DDGS的甘露聚糖含量为1.0 mg·100 mg-1,一种新玉米酒糟干酵母(50%粗蛋白)的甘露聚糖含量为3.0 mg·100 mg-1。因此,通过计算玉米副产品甘露聚糖含量相对于纯乙醇酵母产品甘露聚糖含量的比例,得出DDGS含有约10%的酵母,高蛋白玉米副产物含约29%的酵母。还可采用酶法测定大麦和燕麦中β-葡聚糖的含量,判断DDGS含有0.57%的β-葡聚糖[31]。但这种方法是否适用于发酵谷物副产品尚不清楚。对3个实验室研究的纤维素生物质组成进行平均分析,判断DDGS中总葡聚糖浓度为21.2%(干物质基础),其中16%来源于纤维素,5.2%来源于淀粉[32]。然而,虽然在细菌、真菌、酵母和谷物中都有葡聚糖,但其在分子构型、溶解性和功能性方面不同。
4 小结
大量研究表明,酵母及其衍生物对动物生长性能和健康提供有益的作用,特别是当动物饲养环境差或受疾病影响时。营养学家必须了解这些产品之间的内在差异,以及在添加到饲料中时发挥的作用。尽管已经开发许多检测方法,但对比活性干酵母产品中活酵母含量和酵母活力的分析,每种方法都有局限性,全球饲料工业还没有标准的程序。更值得关注的是尚缺乏分析含有酵母的添加剂和原料中的死酵母和酵母细胞组分的商业化检测方法。使用纯酵母产品的甘露聚糖含量评估玉米副产品中酵母含量比使用氨基酸组成更精确。市售的Mega⁃zyme国际酵母β-葡聚糖测定法是一种准确和实用确定玉米副产品中β-葡聚糖含量的方法。评估酵母类产品中的功能性营养成分,需要采取恰当的检测方法,从而有利于营养学家对这些成分进行量化,执行精确的营养和饲喂方案。
[参考文献]
[1] Baron S.Medical microbiology[M].Galveston:The University of Texas Medical Branch,1996.
[2] Evans E G V,Heritage J,Killington R A.Introductory Microbiolo⁃gy[M].New York:Cambridge University Press,2000.
[3] Bekatorou A,Psarianos C,Koutinas A A.production of food grade yeasts[J].Food Technology&Biotechnology,2006,44(3):407-415.
[4] Shurson G C.The role of biofuels co-products in feeding the world sustainably[J].Annual Review of Animal Bioscience,2017,5(1):229-254.
[5] Kandel J S,Stern T A.Killer phenomenon in pathogenic yeast[J].Antimicrob Agents Chemother,1979,15(4):568-571.
[6] Reed G,Nagodawithans T W.Yeast technology[M].New York:Avi Publishing,1991.
[7] Hassan H M M.Antioxidant and Immunostimulating Activities of Yeast(Saccharomyces cerevisiae)Autolysates[J].World Applied Sciences Journal,2011,15(8):1 110-1 119.
[8] Alexandre H,Guilloux-Benatier M.Yeast autolysis in sparkling wine-a review[J].Australian Journal of Grape&Wine Research,2006,12(2):119-127.
[9] Kollár R,Petráková E,Ashwell G,et al.Architecture of the yeast cell wall[J].Journal of Biological Chemistry,1997,270(3):1 170-1 178.
[10] Bayrock D,Ingledew W M.Fluidized bed drying of baker's yeast:moisture levels,drying rates,and viability changes during drying[J].Food Research International,1997,30(6):407-415.
[11] Aguirreguzman G,Ricquemarie D,Cruzsuarez L E.Survival of ag⁃glomerated Saccharomyces cerevisiae in pelleted shrimp feeds[J].Aquaculture,2002,208(1):125-135.
[12] Kwolek-Mirek M,Zadrag-Tecza R.Comparison of methods used for assessing the viability and vitality of yeast cells[J].Fems Yeast Research,2014,14(7):1 068-1 079.
[13] Dubey R C,Maheshwari D K,Saravanamurthu R.Industrial Ex⁃ploitation of Microorganisms[J].New Delhi:International Publish⁃ing House Pvt.Ltd.,2010.
[14] Shurson G C,Kerr B J,Hanson A R.Evaluating the quality of feed fats and oils and their effects on pig growth performance[J].Jour⁃nal of Animal Scienceand Biotechnology,2015,6(1):10-21.
[15] Lane M M,Morrissey J P.Kluyveromyces marxianus:a yeast emerging from its sister's shadow[J].Fungal Biology Reviews,2010,24(1):17-26.
[16] Jeffries T W,Jin Y S.Metabolic engineering for improved fermen⁃tation of pentoses by yeasts[J].Applied Microbiology&Biotech⁃nology,2004,63(5):495-509.
[17] Hohman E E,Martin B R,Lachcik P J,et al.Bioavailability and efficacy of vitamin D2from UV-Irradiated yeast in growing,vita⁃min D-deficient rats[J].Journal of Agricultural&Food Chemis⁃try,2011,59(6):2 341-2 346.
[18] Lyons T P,Jacques K A.Biotechnology in the Feed Industry[M].Nottingham,UK:Nottingham University Press,1999.
[19] Mowat D N,Change X,Yang W Z.Chelated chromium for stress feeder calves[J].Canadian Journal of Animal Science,1993,73(1):49-55.
[20] Lindemann M D,Cromwell G L,Monegue H J,et al.Effect of chro⁃mium source on tissue concentration of chromium in pigs[J].Jour⁃nal of Animal Science,2008,86(11):2 971-2 978.
[21] Halasz A,Lasztity R.Use of yeast biomass in food production[M].Boca Raton,FL:CRC Press,Inc,1991.
[22] Rose A H,Harrison J S.The YeastsⅡ[M].London:Academic Press,1971.
[23] Tokunaka K,Ohno N,Adachi Y,et al.Application of Candida,sol⁃ubilized cell wallβ-glucan in antitumor immunotherapy against P815 mastocytoma in mice[J].International Immunopharmacology,2002,2(1):59-67.
[24] Vetvicka V,Oliveira C.β(1-3)(1-6)-D-glucans modulate im⁃mune status in pigs:potential importance for efficiency of commer⁃cial farming[J].Annals of Translational Medicine,2014,2(2):16.
[25] Saeed S,Quintin J,Kerstens H H,et al.Epigenetic programming of monocyte-to-macrophage differentiation and trained innate im⁃munity[J].Science,2014,345(6 204):1 251 086.
[26] Spring P,Wenk C,Connolly A,et al.A review of 733 published trials on Bio-Mos®,a mannan oligosaccharide,and Acti⁃gen®,a second generation mannose rich fraction,on farm and companion animals[J].Journal of Applied Animal Nutrition,2015,3:1-11.
[27] Sommer R.Yeast extracts:production,properties and components[J].Food Australia Official Journal of Cafta&Aifst,1998,50(4):181-183.
[28] Bacha U,Nasir M,Ali M A,et al.Review article:nucleotides sup⁃plementation improves various function of the body[J].Journal of Animal Health and Production,2013,1(1):1-5.
[29] Sauer N,Mosenthin R,Bauer E.The role of dietary nucleotides in single-stomached animals[J].Nutrition Research Reviews,2011,24(1):46-59.
[30] Han J,Liu K.Changes in composition and amino acid profile dur⁃ing dry grind ethanol processing from corn and estimation of yeast contribution toward DDGS proteins[J].Journal of Agricultural&Food Chemistry,2010,58(6):3 430-3 437.
[31] Chhorn L,Mediha Y A,Philliph K.Growth response and resis⁃tance to edwardsiella ictaluri of channel catfish,ictalurus puncta⁃tus,fed diets containing distiller's dried grains with solubles[J].JournaloftheWorld AquacultureSociety,2009,40(2):182-193.
[32] Kim Y,Mosier N S,Hendrickson R,et al.Composition of corn dry-grind ethanol by-products:DDGS,wet cake,and thin stillage[J].Bioresour Technol,2008,99(12):5 165-5 176.
[33] Alizadeh M,Rodriguezlecompte J C,Rogiewicz A,et al.Effect of yeast-derived products and distillers dried grains with solubles(DDGS)on growth performance,gut morphology,and gene expres⁃sion of pattern recognition receptors and cytokines in broiler chickens[J].Poultry Science,2016,95(3):507-517.
[34] Smart K.Brewing yeast fermentation performance[M].Blackwell Science,2003.
[35] Szabo S E,Monroe S L,Fiorino S,et al.Evaluation of an automat⁃ed instrument for viability and concentration measurements of cryopreserved hematopoietic cells[J].Lab Hematol,2004,10(2):109-111.
[36] Michelson A D.Flow cytometry:a clinical test of platelet function[J].Blood,1996,87(12):4 925-4 936.
[37] Zandycke S M V,Simal O,Gualdoni S,et al.Determination of yeast viability using fluorophores[J].Journal of the American Soci⁃ety of Brewing Chemists,2003,61(1):15-22.
[38] Taylor F,Mcaloon A J,Jr C J,et al.Fermentation and costs of fuel ethanol from corn with Quick-Germ process[J].Applied Biochem⁃istry&Biotechnology,2001,94(1):41-49.
[39] Chan L L,Lyettefi E J,Pirani A,et al.Direct concentration and viability measurement of yeast in corn mash using a novel imaging cytometry method[J].Journal of Industrial Microbiology and Biotechnology,2011,38(8):1 109-1 115.
[40] Abbott D A,Ingledew W M.Buffering capacity of whole corn mash alters concentrations of organic acids required to inhibit growth of Saccharomyces cerevisiae,and ethanol production[J].Biotechnology Letters,2004,26(16):1 313-1 316.
[41] Boyd A R,Gunasekera T S,Attfield P V,et al.A flow-cytometric method for determination of yeast viability and cell number in a brewery[J].Fems Yeast Research,2003,3(1):11-16.
[42] Bovill R,Bew J,Robinson S.Comparison of selective media for the recovery and enumeration of probiotic yeasts from animal feed[J].International Journal of Food Microbiology,2001,67(1-2):55-61.
[43] Poppy G.Understanding yeast enumeration important[J].Feed⁃stuffs,2008,80:18-19.
[44] Slaughter J C,Nomura T.Intracellular glycogen and trehalose contents as predictors of yeast viability[J].Enzyme&Microbial Technology,1992,14(1):64-67.

