不同月龄阶段陕北白绒山羊生精细胞发育规律研究
韩 聪,方 乾,李 浩, 胡 姗, 朱海鲸, 胡建宏*(.西北农林科技大学 动物科技学院,陕西 杨凌 700; .榆林学院 生命科学学院,陕西 榆林 79000)
雄性动物睾丸发育情况直接影响其性成熟早晚及精液品质,从而决定雄性动物繁殖性能。精子发生起始于精原干细胞(SSCs)的自我更新和分化,睾丸组织中各级生精细胞分布反映了睾丸组织发育程度,睾丸组织学分析可直接观察睾丸结构变化规律及生精细胞分布情况[1]。
陕北白绒山羊是我国经过30年培育而成的优秀绒山羊地方品种,绒肉兼用,主要分布在陕北地区,具有耐粗饲、耐寒冷、抗风沙、适应性较强等特性[2-3]。但由于品种育成后陕北白绒山羊处于自然发展状态,缺乏系统研究。睾丸组织HE染色后,镜下观察细胞形态能辨别各级生精细胞,其中精原细胞呈圆形,核大,呈圆形或轻微卵圆形,胞质较少,核内常染色质占绝对优势,异染色质极少[4]。Kimura等[5]发现,成年男性睾丸中初级精母细胞、圆形精子细胞和长形精子细胞与支持细胞的比率随年龄增大明显下降,而精原细胞与支持细胞的比率无明显变化。说明在不同发育期,动物睾丸中生精细胞分布有一定差异。张旭静[6]研究发现,1.5岁牦牛曲细精管内可见1~2层生精细胞,精原细胞及精母细胞数较少、多处于休止期,可见极少数精子,处在性成熟前期,曲细精管直径达到119.54 μm,精原细胞数达到27.79,精母细胞数21.83。展微[7]研究报道,辽宁绒山羊自出生后睾丸内精原细胞数量呈逐渐增加的趋势,并在1月龄时可见初级精母细胞,2月龄时有次级精母细胞发现,3月龄时有精子细胞和精子出现,6月龄时精子细胞数量开始减少而精子数量开始增加。睾丸发育情况及不同发育期睾丸中SSCs浓度至关重要。Chiarini-Garcia等[8]研究认为,睾丸是一个动态的组织,其SSCs不断增殖并分化成为成熟的精子,在各个发育阶段都存在SSCs的增殖和分化。但在牛[9]、犬[10]和猪[11]睾丸移植研究中,年轻未达到性成熟的睾丸组织比新生的睾丸组织移植后生精效率更高。目前,大多数SSCs体外培养研究中,都选择青春期前睾丸组织[12-13],这主要是由于年轻睾丸组织中有更多未分化的SSCs。
目前,对各家畜睾丸组织结构及发育规律都有报道,但陕北白绒山羊睾丸组织学及生精细胞发育的研究还未见报道。本试验取不同发育阶段睾丸作组织切片,并用苏木精-伊红染色,观察曲细精管形态,统计曲细精管横切面各生殖细胞数,分析不同发育阶段陕北白绒山羊睾丸发育程度,为进一步探讨陕北白绒山羊的种质特性,了解其睾丸发育规律,挖掘其发展潜力奠定理论基础。
1 材料与方法
1.1 生物学材料
分别取1月龄、3月龄、6月龄、成年陕北白绒山羊睾丸组织,用4%多聚甲醛溶液固定备用。另取1月龄、3月龄、6月龄、成年陕北白绒山羊新鲜睾丸组织,于-80 ℃ 冻存备用。
1.2 试验方法
1.2.1 组织切片制备 活体取不同生理阶段陕北白绒山羊睾丸组织,4%多聚甲醛固定,于PBS溶液洗3次,经梯度酒精脱水,二甲苯透明,常规石蜡包埋。切片厚 5 μm (每连续三刀内只取一张),贴于载玻片上,37 ℃ 干燥备用。
1.2.2 HE染色 常规HE染色参照病理学技术[14]进行。切片于二甲苯中脱蜡10 min (两次),经梯度乙醇溶液逐级复水后,苏木素染液染色 5 min ,蒸馏水冲洗,于1% 盐酸酒精溶液中分化30 S,蒸馏水冲洗,用淡氨水返蓝1 min ,蒸馏水冲洗,0.5% 伊红染液中浸染2 min ,蒸馏水冲洗,经梯度酒精脱水,二甲苯透明后用中性树胶封片。自然干燥,于显微镜下观察照相。
1.2.3 实时定量PCR 用RNAiso plus试剂分别从1月龄、3月龄、6月龄、成年陕北绒山羊睾丸组织提取总RNA。使用反转录试剂盒(TAKARA,大连)反转录合成cDNA。引物设计如表1。内参为GAPDH,每个检测重复3次。定量PCR反应体系如表2。
1.2.3 统计分析 组织切片于400倍显微镜下观察,测量细精管直径,计数曲细精管内细胞层数及各细胞数。每个样本计数50个曲细精管。结果均用“平均值±标准差”(Mean ± S.D)表示。定量PCR内参为GAPDH,每个检测重复3次。本试验所有数据使用SPSS软件17.0进行方差分析,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 睾丸组织学观察
对1月龄、3月龄、6月龄及成年陕北白绒山羊睾丸组织进行组织学分析,1月龄陕北白绒山羊曲细精管管径较小,内有支持细胞,精原细胞及少数性原细胞(gonocytes)(图1A)。其中性原细胞位于曲细精管内侧,体积较大,HE染色着色较浅,已有多数性原细胞分化为精原细胞并附着于基膜。3月龄时管径明显增大,不见性原细胞,均发育成精原细胞附着于曲细精管基膜,一般在相邻的精原细胞之间有多个支持细胞(图1B)。6月龄时管径继续增大,已经有空腔形成,少数精原细胞和支持细胞附着于基膜,其内侧由大量精母细胞占据,曲细精管的中央存在许多圆形精子细胞和长形精子细胞(图1C)。成年羊曲细精管管径较6月龄略有增大,生殖细胞排列与6月龄相同,与6月龄相比,成年陕北白绒山羊曲细精管中央有更多的长形精子细胞(图1D)。

表1 定量PCR引物表Table 1 Primer sequences of quantitative PCR

表2 定量PCR反应体系Table 2 The reaction system of quantitative PCR
2.2 曲细精管发育规律
从表3知,1月龄、3月龄、6月龄绒山羊曲细精管直径随着年龄的增长而显著增大(P<0.05),成年羊比6月龄曲细精管略有增大,差异不显著(P>0.05)。细胞层数随年龄的增长而增长,其中3月龄、6月龄和成年羊差异显著(P<0.05),3月龄比1月龄略高(P>0.05)。与1月龄、6月龄、成年羊相比,3月龄曲细精管中精原细胞最为丰富,明显高于其他月龄(P<0.05)。陕北白绒山羊曲细精管横截面细胞总数随年龄增长而增长,其中6月龄和成年羊曲细精管横截面细胞总数显著高于1月龄和3月龄(P<0.05)。
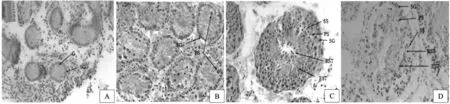
图1 陕北白绒山羊睾丸组织学观察(HE,×400)A. 1月龄陕北白绒山羊睾丸组织;B. 3月龄陕北白绒山羊睾丸组织;C. 6月龄陕北白绒山羊睾丸组织;D. 成年陕北白绒山羊睾丸组织;SG. 精原细胞;PS. 初级精母细胞;SS. 次级精母细胞;RST. 圆形精子细胞;EST. 长形精子Fig. 1 Histological observation of cashmere goat testis (HE ×400)A. cashmere goat testis in 1 month;B. cashmere goat testis in 3 months;C. cashmere goat testis in 6 months;D. cashmere goat testis in adulthood;SG. spermatogonium;PS. primary spermatocyte; SS. secondary spermatocyte;RST. round spermatid; EST, elongated spermatid

表3 不同阶段陕北白绒山羊曲细精管形态学分析Table 3 The morphology of seminiferous tube analysis of Cashmere Goat in different stages
注:同行数据上标不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)。下同。
Note:Values with different lowercase superscripts in the same row indicate significant difference(P<0.05),and the same lowercase superscripts indicate insignificant difference(P>0.05). The same below.
2.3 生精细胞发育规律
对四个阶段陕北白绒山羊睾丸曲细精管横切面各细胞计数,结果见表4。性原细胞只见于1月龄睾丸;精原细胞存在于四个发育期,1月龄精原细胞数显著低于其他组(P<0.05),3月龄、6月龄及成年羊无明显差异(P>0.05);3月龄睾丸可见极少数初级精母细胞,其数量显著低于6月龄和成年羊(P<0.05),6月龄和成年羊无明显差异(P>0.05)。次级精母细胞、圆形精子细胞及长形精子只见于6月龄和成年羊睾丸,6月龄睾丸中长形精子细胞数显著低于成年羊(P<0.05)。此外,6月龄陕北白绒山羊与成年羊曲细精管横切面上各细胞分布相近。
2.4 实时定量PCR
实时定量PCR结果见图2。SSCs标记基因(CD49f、PLZF、Thy1、ETV5、VASA)及多能性相关基因(Oct4、Nanog、Nanos2),均在3月龄陕北白绒山羊睾丸组织中高表达。其中Thy1、VASA及PLZF在3月龄睾丸中表达量最高(P<0.05),其次是6月龄和成年羊(P<0.05);在1月龄睾丸中表达量最低(P<0.05);6月龄和成年羊差异不显著(P>0.05)。ETV5、Nanog及Nanos2在3月龄睾丸中表达量最高,显著高于其他发育期(P<0.05),其次是6月龄(P<0.05);在1月龄和成年羊睾丸中表达量最低(P<0.05),1月龄与成年羊差异不显著(P>0.05)。另外,CyclinA在6月龄羊睾丸中表达量最高,显著高于其他发育期(P<0.05),其次是3月龄(P<0.05),在1月龄和成年羊睾丸中表达量最低(P<0.05);1月龄和成年羊差异不显著(P>0.05)。CD49f在1月龄和3月龄高表达,且显著高于6月龄和成年羊(P>0.05),其次是成年羊(P<0.05),在6月龄睾丸中表达量最低(P<0.05),1月龄和3月龄差异不显著(P>0.05)。
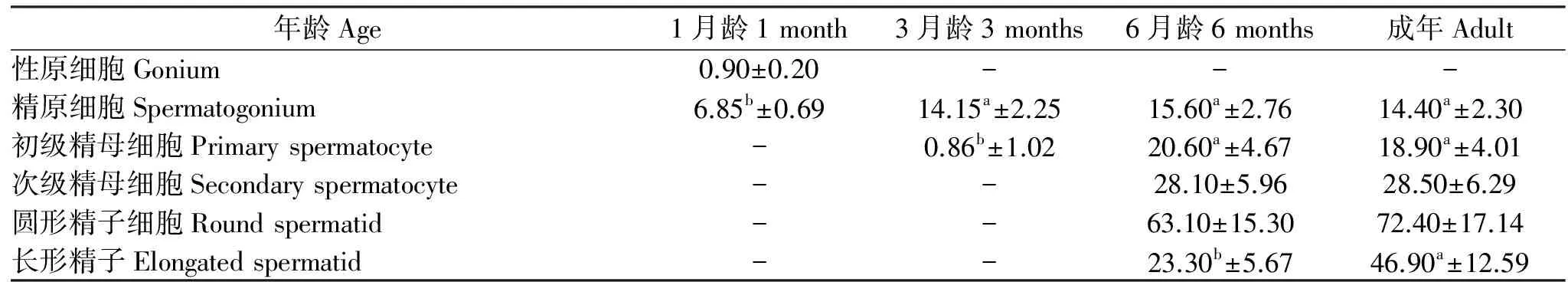
表4 不同发育期陕北白绒山羊生精细胞分布Table 4 The distribution of spermatogenic cells of Cashmere goat in different stages
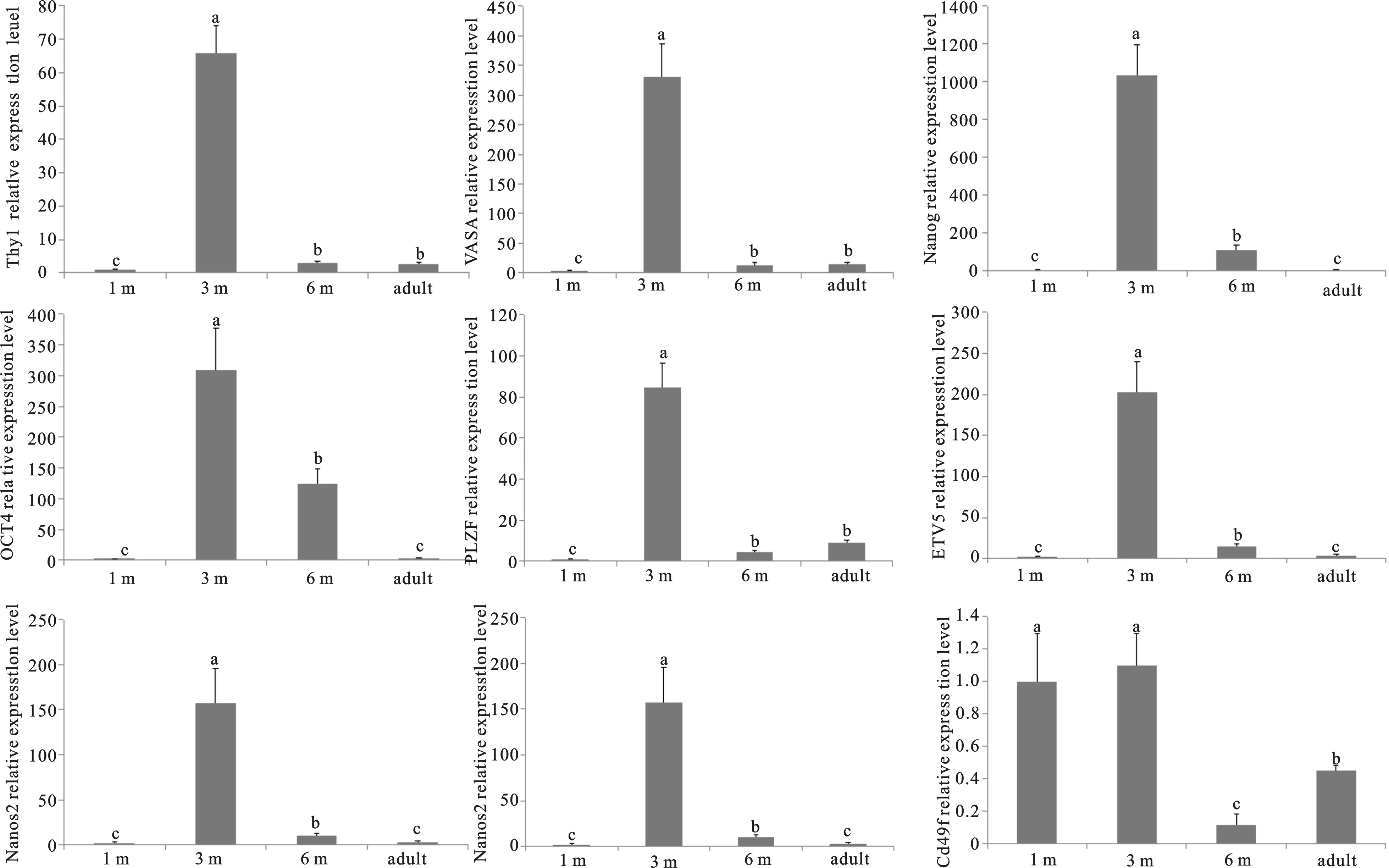
图2 多能性基因在不同阶段陕北白绒山羊睾丸组织中的表达同一指标不同小写字母表示差异显著(P<0.05)Fig. 2 The expression of pluripotent genes in Cashmere goat testis at different stagesDifferent lowercase letters of the same index differ significantly (P<0.05).
3 讨 论
睾丸内生精细胞的发育进程是研究雄性精子发生机制的重要基础,组织学分析是研究睾丸及生精细胞发育的重要技术手段。睾丸是一个动态的组织,其SSCs不断增殖并分化成为成熟的精子,在各个发育阶段都存在SSCs的增殖和分化[8]。本研究得到了相似的结果,四个发育期陕北白绒山羊睾丸都有不同类型精原细胞(包括SSCs)存在,并且与1月龄、6月龄(性成熟)及成年羊相比,3月龄睾丸中精原细胞(包含SSCs)浓度最高,达到46.40%。生精细胞的发育包括精原细胞增殖分裂、精母细胞减数分裂为精子细胞以及精子形成[15],睾丸组织学观察可以通过细胞形态分辨各级生精细胞并分析其分布规律。本研究中,1月龄睾丸中有支持细胞、精原细胞及少数性原细胞,已有多数性原细胞分化为精原细胞并附着于基膜。到3月龄时,睾丸中不见性原细胞,性原细胞均发育成精原细胞,精原细胞明显增多,并可见极少数初级精母细胞。6月龄时可见精原细胞、初级精母细胞、次级精母细胞、圆形精子细胞和少数长形精子细胞从曲细精管基底膜向中央有序排列。这与Griswold[16]研究一致,哺乳动物的生精过程表现出严格的周期性规律和同源群现象。成年羊生精细胞分布与6月龄相似,曲细精管中央有更多的长形精子细胞。说明6月龄陕北白绒山羊已经达到性成熟。展微[7]研究报道,辽宁绒山羊在1月龄时就可见初级精母细胞,2月龄时就有次级精母细胞出现,3月龄可见各级生精细胞和精子,6月龄时有大量精子产生。可见陕北白绒山羊生精细胞发育比辽宁绒山羊晚1~2个月,推测这可能是受母本遗传影响。陕北白绒山羊是以辽宁绒山羊作为父本,陕北子午岭黑山羊作为母本培育而来[17],而子午岭黑山羊体型较小,生长较慢[18]。
曲细精管是睾丸的主要组成部分,内壁衬有生精上皮,主要包含生精细胞和支持细胞,是精子发生的场所。曲细精管直径能反应睾丸发育程度及雄性动物繁殖力,展微[7]研究报道了不同月龄辽宁绒山羊曲细精管直径,1月龄羊35.54 μm,3月龄103.97 μm,6月龄178.63 μm。本研究得到相似的结果,陕北白绒山羊曲细精管随年龄增长而增长,与辽宁绒山羊相比,陕北白绒山羊曲细精管生长较慢;展微[7]研究发现,辽宁绒山羊的公羔的性行为发育较早,各个性行为在3月龄时已全部出现及完善,说明辽宁绒山羊的公羔初情期和性成熟时间较早。本研究中6月龄陕北白绒山羊睾丸曲细精管直径及其总细胞数与成年羊无明显差异,细胞层数达到7.7层,并在6月龄能产生大量精子。可见陕北白绒山羊在6月龄前已达到性成熟,具有生育能力。在实际生产中,陕北绒山羊在成年前后达到体成熟才进行配种工作。郑亦辉等[19]研究认为,4月龄湖羊附睾内可见有大量成熟精子,且4月龄公羊可使母畜受胎。武和平等[20]研究发现,布尔山羊公羊平均在242.5日龄达到性成熟。除品种因素外,外界环境因子,如季节、气温、光照、饲养方式等也会影响睾丸及生精细胞发育[21]。
动物组织越接近青春期,精原细胞的浓度最高[22]。本试验中,精原细胞在3月龄睾丸组织中浓度最高。SSCs相关标记基因均在3月龄睾丸组织高表达,其中CD49f、ETV5、VASA、PLZF及Thy1被认为是SSCs特异性标记基因[23],OCT4、Nanog及Nanos2被认为是多能性相关基因,而ETV5在SSCs的自我更新中起重要调节作用[24-26]。细胞周期蛋白与有丝分裂、减数分裂密切相关,其中Cyclin A、Cyclin B、Cyclin H 等基因与精子发生密切相关。Cyclin A1 基因特异性表达于哺乳动物睾丸组织生精细胞,且只有在第一次减数分裂前的精原细胞和第一次减数分裂过程中的初级精母细胞检测到表达[27]。PCR结果显示,Cyclin A基因在6月龄羊睾丸中高表达,这可能是由于6月龄羊睾丸中有更多的精原细胞和初级精母细胞。有研究认为,睾丸中PLZF 只在SSCs和未分化的精原细胞内表达[28-29]。本研究结果显示,PLZF在3月龄羊睾丸中表达量显著高于其他阶段,3月龄陕北白绒山羊睾丸中几乎还没有初级精母细胞,曲细精管中除了支持细胞外,大多是精原细胞(包含SSCs),这与前人的研究结果相一致。
4 结 论
与1月龄、6月龄和成年羊相比,3月龄陕北白绒山羊睾丸组织含有更加丰富的精原细胞(含精原干细胞),且显著高于其他组,选择3月龄前后睾丸组织更有利于陕北白绒山羊精原干细胞的体外分离。6月龄陕北白绒山羊睾丸中有较多精子细胞,并且各生殖细胞数目与成年羊无明显差异,已经达到性成熟。
参考文献:
[1] 罗兰,张彦,张闻,等. 小鼠睾丸发育全过程中生精细胞的自发性凋亡[J]. 云南大学学报(自然科学版),2011,33(1): 113-117.
[2] 姜怀志, 韩迪, 郭丹, 等. 辽宁绒山羊的若干种质特性[J]. 中国草食动物科学, 2011,31(6): 72-75.
[3] 黄帅, 孙旺斌, 高晔, 等. 陕北白绒山羊屠宰性能和器官发育的研究[J]. 中国草食动物科学, 2017,37(1): 11-14.
[4] SHEKARFOROUSH S, EBRAHIMI Z, HOSEINI M. Sodium metabisulfite-induced changes on testes, spermatogenesis and epididymal morphometric values in adult rats[J]. International Journal of Reproductive Biomedicine, 2015, 13(12):765-770.
[5] KIMURA M, ITOH N, TAKAGI S, et al. Balance of Apoptosis and Proliferation of Germ Cells Related to Spermatogenesis in Aged Men[J]. Journal of Andrology, 2003, 24(2):185-191.
[6] 张旭静. 牦牛和普通牛种间杂种公牛睾丸的组织学观测与研究[J]. 畜牧兽医学报, 2001,32 (4): 314-318.
[7] 展微. 辽宁绒山羊公羊精子发生与生精性能的研究[D].长春:吉林农业大学,2015.
[8] CHIARINI-GARCIA H, RAYMER A M, RUSSELL L D. Non-random distribution of spermatogonia in rats: evidence of niches in the seminiferous tubules[J]. Reproduction, 2003, 126(5):669-680.
[9] OATLEY J M, BRINSTER R L. Regulation of spermatogonial stem cell self-renewal in mammals[J]. Annual Review of Cell & Developmental Biology, 2008,24(1): 263-286.
[10] KIM Y, TURNER D, NELSON J,et al.Production of donor-derived sperm after spermatogonial stem cell transplantation in the dog[J]. Reproduction, 2008.136(6): 823-831.
[11] CURABA M, VERLEYSEN M, AMORIM C A, et al. Cryopreservation of prepubertal mouse testicular tissue by vitrification[J]. Fertil Steril,2011, 95(4): 1 229-1 234.
[12] LI L, WANG M, WANG M, et al. A long non-coding RNA interacts with Gfra1 and maintains survival of mouse spermatogonial stem cells[J]. Cell Death Dis, 2016,7(3): e2140.
[13] APOHTE P M. Spermatogonial stem cells: current biotechnological advances in reproduction and regenerative medicine[J]. World Journal of Stem Cells, 2015,7(4): 669-680.
[14] 王伯沄, 李玉松, 黄高升,等. 病理学技术[M]. 北京: 人民卫生出版社,2000.
[15] SHREEE RAM SINGH, OZANNA BURNICKA-TUREK, CHHAVI CHAUHAN,et al. Spermatogonial stem cells, infertility and testicular cancer[J]. Journal of Cellular & Molecular Medicine, 2011. 15(3): 468.
[16] GRISWOLD M D. The central role of Sertoli cells in spermatogenesis[J]. Semin. Cell Dev. Biol,1998,9(4): 411-416.
[17] 王兴涛,雷耀庚,李碧波,等. 日粮蛋白水平和采精频率对绒山羊血清生化指标及生殖激素的影响[J]. 西北农林科技大学学报(自然科学版),2016,44(12):45-50.
[18] 余刚.横山县陕北白绒山羊部分种质特性的调查分析[J]. 中国畜禽种业,2006(11):22-24.
[19] 郑亦辉,吕宝铨.湖羊性行为的表现及精子产生[J].中国畜牧杂志,1987(3): 5-7.
[20] 武和平,周占琴,陈小强,等. 布尔山羊的繁殖特性观察[J]. 西北农业学报,2007,16(3):47-50.
[21] 杨从雨,李兆连,申永明. 肉用种鸡性成熟影响因素分析[J]. 畜牧兽医杂志,1999,18(1):33-34.
[22] ORWIG K E, SCHLATT S. Cryopreservation and transplantation of spermatogonia and testicular tissue for preservation of male fertility[J]. Journal of the National Cancer Institute Monographs, 2005, 34(34):51-56.
[23] Phillips B T, Gassei K, Orwig K E. Spermatogonial stem cell regulation and spermatogenesis[J]. Philosophical Transactions of the Royal Society of London, 2010,365(1546):1 663.
[24] CHEN C, OUYANG W, GRIGURA V, et al. ERM is required for transcriptional control of the spermatogonial stem cell niche[J]. Nature,2005,436(7053):1 030-1 034.
[25] SCHLESSER H N, SIMON L, HOFMANN M C, et al. Effects of ETV5 (ets variant gene 5) on testis and body growth, time course of spermatogonial stem cell loss, and fertility in mice[J]. Biol Reprod,2008,78(3): 483-489.
[26] WU X, GOODYEAR S M, TOBIAS J W, et al.Spermatogonial stem cell self-renewal requires ETV5-mediated downstream activation of Brachyury in mice[J]. Biol Reprod, 2011,85(6): 1 114-1 123.
[27] RAVNIK S E, WOLGEMUTH D J. Regulation of meiosis during mammalian spermatogenesis: the A-type cyclins and their associated cyclin-dependent kinases are differentially expressed in the germ-cell lineage.[J]. Developmental Biology, 1999, 207(2):408-418.
[28] BUAAS F W, KORSJ A L, SHARMA M,et al. Plzf is required in adult male germ cells for stem cell self-renewal[J]. Nat Genet, 2004,36(6): 647-652.
[29] COSTOYA J A, HOBBS R M, BARNA M, et al. Essential role of Plzf in maintenance of spermatogonial stem cells[J]. Nat Genet, 2004,36(6): 653-659.

