Cu2+胁迫对中华绒螯蟹毒性作用及免疫相关基因表达的影响
毛振方,林奇辰,王彬宇,张翠真,陈志和,简少卿,赵大显*
(1.南昌大学 生命科学学院,江西 南昌 330031;2.江西省水产动物资源与利用重点实验室,江西 南昌 330031)
中华绒螯蟹作为我国重要的经济甲壳动物,随着其规模化生产发展,养殖用水污染也在不断地加剧,其中除了受工业、农业和生活污水影响外,生产中大量使用硫酸铜等进行病害防治和清塘灭藻已成为重要的水污染原因之一。研究表明,养殖水环境Cu2+浓度超标会引起甲壳动物免疫力的下降,继而提高病原易感性,导致养殖过程中疾病的爆发[1-3]。因此,有关养殖水体中的Cu2+浓度对中华绒螯蟹毒性作用及其对免疫系统影响的研究倍受关注,国内外学者已从生理生化水平分析了Cu2+浓度对中华绒螯蟹血淋巴免疫指标的影响[4-6],而有关Cu2+胁迫对中华绒螯蟹免疫相关基因表达的影响还鲜有报道。本研究以重金属Cu2+为应激源,测定和分析了其对中华绒螯蟹的毒性作用及对免疫相关基因表达的影响,旨在阐明重金属Cu2+胁迫对中华绒螯蟹免疫系统影响的分子机理,并为利用甲壳动物的免疫相关基因表达预测环境早期污染提供理论依据。
1 材料与方法
1.1 试验材料
本实验所用中华绒螯蟹(100 g)购于江西省南昌市水产批发市场,于实验室采用经充分曝气的自来水暂养7 d,水温为23 ℃,pH为6.35,后选取健康、活泼且四肢健全的蟹进行重金属铜离子(Cu2+)胁迫实验,期间日换水1/2~1/3,及时清除污物,并于胁迫后0、12、24、36、48、60、72 h随机取蟹抽提血淋巴,4 ℃ 12 000 r/min离心20 min收集血细胞作为实验材料。
1.2 试验方法
1.2.1 重金属Cu2+梯度设置 重金属铜离子种类和来源为:Cu2+(Cu2SO4·5H2O)。按《中华人民共和国渔业水质标准 GB11607-89》Cu2+的质量浓度(Cu2+≤0.01 mg/L)的10倍、50倍、100倍设置实验浓度梯度,即Cu2+的质量浓度分别设置为:0.10,0.50,1.00 mg/L。各浓度均设置3个重复,并以不加Cu2+组为对照组。
实验在50 cm×40 cm×30 cm的塑料水箱内进行,各质量浓度梯度分别放健康中华绒螯蟹10只,试验期间的养殖管理与暂养期间完全相同,换水时分别加入相对应Cu2+浓度的养殖用水。试验开始后于0、12、24、36、48、60、72 h取样,用预先加入灭菌预冷抗凝剂(NaCl 510 mmol/L;C6H12O6100 mmol/L;C6H8O7200 mmol/L;C6H5Na3O730 mmol/L;EDTA-2Na 10 mmol/L;pH 7.3)的消毒5号针头和5 mL注射器从中华绒螯蟹第三步足基部血窦处抽取血淋巴,并将收集好的血淋巴于4 ℃ 12 000 r/min离心 20 min,弃上清,所得沉淀即为血细胞。血细胞样品均保存于-70 ℃下冰箱待测。
1.2.2 总RNA的提取 于血细胞沉淀中按0.1 g/mL加入Unizol Reagent,振荡混匀,加入等体积的氯仿,盖紧盖子,颠倒摇动15 s,室温放置2~3 min;4 ℃、12 000 r/min离心15 min,取上清,移至新的EP管中;向EP管中加入0.8倍体积的异丙醇,颠倒混匀,-20 ℃沉淀30 min,4 ℃、12 000 rmp离心10 min;弃上清,加入等体积75%乙醇洗涤,7 500 r/min离心5 min,溶于一定体积的DEPC水中。用紫外分光光度计检测总RNA的浓度和纯度,根据其浓度,取约150 ng进行凝胶电泳分析,观察是否被降解。
1.2.3 cDNA模板的准备 以总RNA为模板,按反转录试剂盒TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)方法步骤(for SYBR®Green qPCR)进行cDNA合成。主要包括以下步骤:
第一步:总RNA样品去基因组DNA污染反应。反应体系:5 × gDNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,Total RNA 1μg,RNase Free dH2O 补足到10 μL;反应程序:将上述10 μL体系于42 ℃反应2 min,保存于4 ℃;
第二步:逆转录cDNA合成反应。反应体系:第一步反应产物10 μL,5× PrimeScript Buffer 2(for Real Time)4.0 μL,PrimeScript RT Enzyme Mix I 1.0 μL,RT Primer Mix 1.0 μL,RNase Free dH2O 4.0 μL,反应体系总体积为20 μL;反应程序:将上述20 μL体系于37 ℃反应15 min,85 ℃反应5 s,4 ℃保存。
1.2.4 实时荧光定量PCR 实时荧光定量PCR引物采用Primer 5.0软件设计,其中包括内参基因(β-actin)和免疫相关基因(LGBP、PPAF、GPx、GST、Integrin、PXN、Tube、Dorsal)引物各1对,具体序列详见表1;引物由生工生物工程(上海)股份有限公司合成。
实时荧光定量PCR反应在Bio-Rad CFX Connect real-time PCR detection system仪器上进行。20 μL PCR反应体系为:SYBR Premix ExTaq(Tli RNaseH Plus)(2×)10 μL,PCR Forward Primer(10 μmol/L)0.4 μL,PCR Reverse Primer(10 μmol/L)0.4 μL,cDNA 2 μL,dH2O 7.2 μL。反应程序为:95 ℃预变性5 min后进入循环;95 ℃ 30 s、58~60 ℃ 30 s、72 ℃ 30 s,40个循环;95 ℃ 5 s、60 ℃ 1 min、95 ℃ 1 min,1 cycle。每个反应设3个重复。
1.3 数据分析
实验数据使用CFX ManagerTM软件进行分析,将CT值作为样本表达量标准,使用Livak法[7],即2-△△CT法,来计算胁迫组相对于对照组的基因表达水平。其中,△△CT=(待测组目的基因平均CT值-待测组内参基因平均CT值)-(对照组目的基因平均CT值-对照组内参基因平均CT值)。利用SPSS软件进行方差分析,Excel软件制成柱形直观图。

表1 实时荧光定量PCR反应引物
2 结果与分析
2.1 水体Cu2+胁迫浓度对中华绒螯蟹的毒性作用
不同质量浓度Cu2+对中华绒螯蟹进行胁迫发现,对照组和10倍浓度组(Cu2+质量浓度为0.1 mg/L)中,中华绒螯蟹在试验期间(72 h)无明显死亡现象,且活力正常;50倍和100倍浓度组(Cu2+质量浓度分别为0.5 mg/L和1.0 mg/L)中,中华绒螯蟹死亡现象比较明显,表现为:胁迫12 h时,50倍浓度组中,中华绒螯蟹死亡率达25%,而100倍浓度组中,中华绒螯蟹死亡率达50%;胁迫24 h时,50倍浓度组中,中华绒螯蟹死亡率达75%,而100倍浓度组中华绒螯蟹死亡率达100%;胁迫36 h后,50倍浓度组中,中华绒螯蟹死亡率达100%。结果表明,在Cu2+胁迫中华绒螯蟹72 h后,低浓度组(10倍浓度组和对照组)中,中华绒螯蟹无明显死亡现象,而高浓度组(50倍和100倍浓度组)中,中华绒螯蟹均全部死亡(图1),说明高浓度Cu2+胁迫对中华绒螯蟹具有明显的毒性作用。鉴于以上结果,本试验选用10倍浓度组(Cu2+质量浓度为0.1 mg/L)和对照组(Cu2+质量浓度为0 mg/L)来探讨Cu2+胁迫对中华绒螯蟹免疫相关基因表达的影响。
2.2 水体Cu2+胁迫对中华绒螯蟹免疫相关基因表达的影响
2.2.1 Cu2+胁迫对中华绒螯蟹模式识别相关基因LGBP mRNA表达的影响 对0.1 mg/L Cu2+胁迫中华绒螯蟹不同时间组别进行qRT-PCR和电泳检测发现,内参基因(β-actin)与LGBP基因在各组别中均被检测到特异性扩增,且扩增效率均基本一致。进一步对不同组别LGBP表达量分析发现,在胁迫36 h组,中华绒螯蟹LGBP表达量显著高于对照组(P<0.05),而后表现为降低趋势,在胁迫60 h组中,LGBP表达量显著低于对照组(P<0.05)(图2)。

图1 Cu2+胁迫对中华绒螯蟹的毒性作用Fig.1 Toxic effects of Cu2+ stress on Eriocheir sinensis
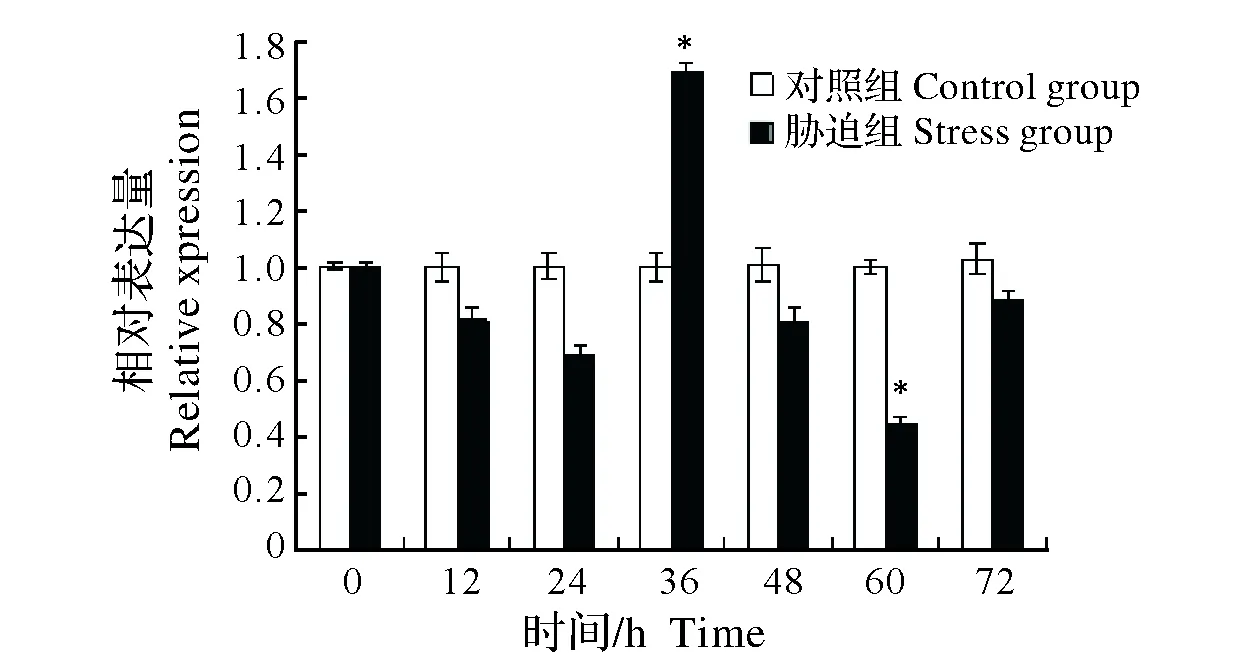
图2 Cu2+胁迫对中华绒螯蟹LGBP基因mRNA表达的影响Fig.2 Effect of Cu2+ stress on the expression of LGBP mRNA in Chinese mitten crab Eriocheir sinensis
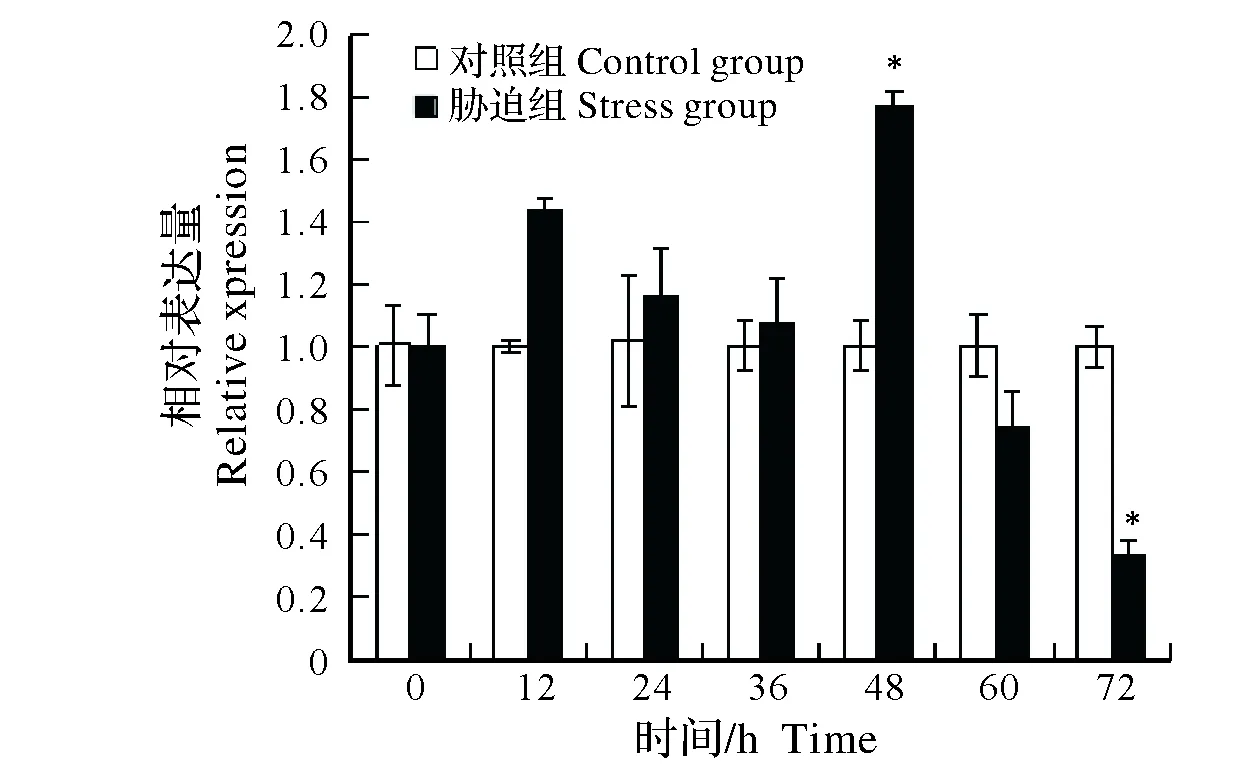
图3 Cu2+胁迫对中华绒螯蟹Tube基因mRNA表达的影响Fig.3 Effect of Cu2+ stress on the expression of Tube mRNA in Chinese mitten mrab Eriocheir sinensis

图4 Cu2+胁迫对中华绒螯蟹Dorsal基因mRNA表达的影响Fig.4 Effect of Cu2+ stress on the expression of Dorsal mRNA in Chinese mitten crab Eriocheir sinensis
2.2.2 Cu2+胁迫对中华绒螯蟹免疫信号传导相关基因表达的影响 对0.1 mg/L Cu2+胁迫中华绒螯蟹不同时间组别进行qRT-PCR和电泳检测发现,内参基因(β-actin)与免疫信号传导相关基因Tube和Dorsal在各组别中均被检测到特异性扩增,且扩增效率均基本一致。进一步对不同组别Tube和Dorsal表达量分析发现,在胁迫48 h组,中华绒螯蟹Tube表达量显著高于对照组(P<0.05),而后表现为降低趋势,在胁迫72 h组中,Tube表达量显著低于对照组(P<0.05)(图3);在胁迫48 h组,中华绒螯蟹Dorsal 表达量显著高于对照组(P<0.05),在胁迫60 h组中,Dorsal表达量显著低于对照组(P<0.05)(图4)。
2.2.3 Cu2+胁迫对中华绒螯蟹免疫效应相关基因表达的影响 对0.1 mg/L Cu2+胁迫中华绒螯蟹不同时间组别进行qRT-PCR和电泳检测发现,内参基因(β-actin)与免疫效应相关基因PPAF、GPx、GST和PXN在各组别中均被检测到特异性扩增,且扩增效率均基本一致。进一步对不同组别PPAF、GPx、GST和PXN表达量分析发现,在胁迫12 h、48 h组,中华绒螯蟹PPAF表达量显著高于对照组(P<0.05),而后在胁迫60 h、72 h组中,PPAF表达量显著低于对照组(P<0.05)(图5);在胁迫36 h组,GPx表达量显著高于对照组(P< 0.05),而后在胁迫72 h组中,GPx表达量显著低于对照组(P<0.05)(图6);GST表达量逐步下降,在24 h组中显著低于对照组(P<0.05),而后在胁迫36 h、48 h组中,GST表达量显著高于对照组(P<0.05),随后在72 h组又表现为显著低于对照组(P< 0.05)(图7);在胁迫12 h组,PXN表达量显著高于对照组(P<0.05),而后呈下降趋势,至72 h组中,PXN表达量显著低于对照组(P<0.05)(图8)。
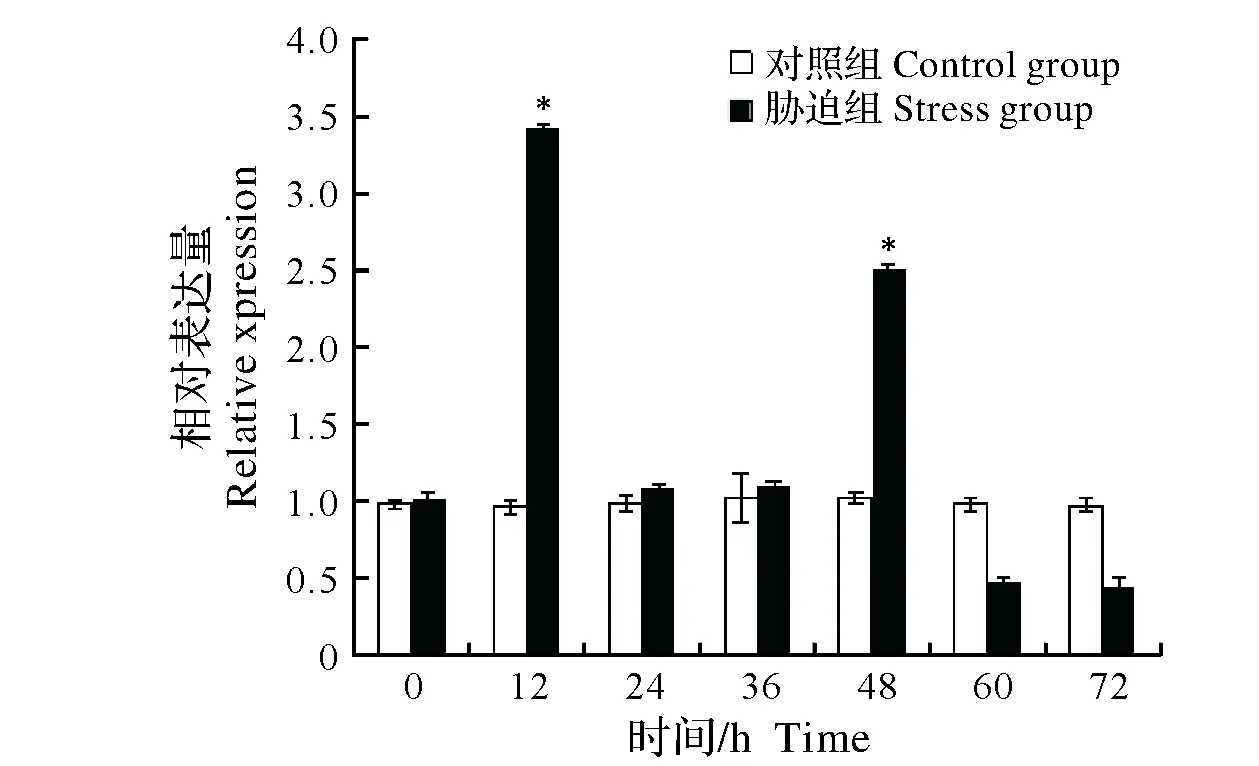
图5 Cu2+胁迫对中华绒螯蟹PPAF基因mRNA表达的影响Fig.5 Effect of Cu2+ stress on the expression of PPAF mRNA in Chinese mitten crab Eriocheir sinensis
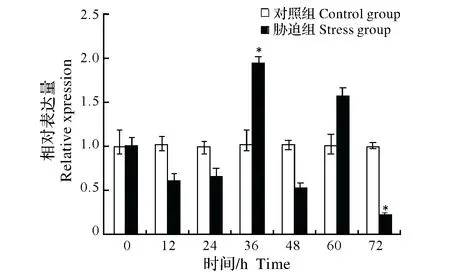
图6 Cu2+胁迫对中华绒螯蟹GPx基因mRNA表达的影响Fig.6 Effect of Cu2+ stress on the expression of GPx mRNA in Chinese mitten crab Eriocheir sinensis
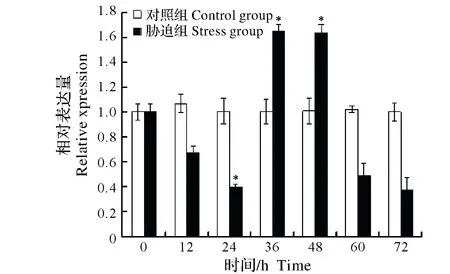
图7 Cu2+胁迫对中华绒螯蟹GST基因mRNA表达的影响Fig.7 Effect of Cu2+ stress on the expression of GST mRNA in Chinese mitten crab Eriocheir sinensis
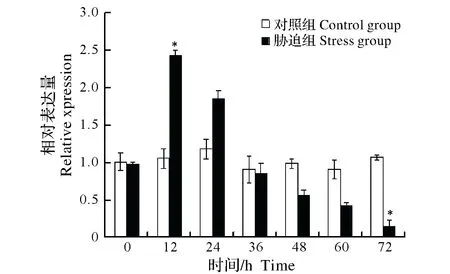
图8 Cu2+胁迫对中华绒螯蟹PXN基因mRNA表达的影响Fig.8 Effect of Cu2+ stress on the expression of PXN mRNA in Chinese Mitten Crab Eriocheir sinensis
3 讨论与结论
本研究结果表明,高浓度Cu2+对中华绒螯蟹具有明显的毒性作用。铜作为甲壳动物重要的营养素,也是合成血蓝蛋白的必需成分之一,对多种生长发育相关的生物酶如细胞色素氧化酶、碳酸酐酶多的组成和功能有重要的意义[3-8]。然而,过量的Cu2+会对生物机体产生毒害作用,这种危害可以反映在生物大分子(如 DNA、RNA、各种酶)、细胞、器官、个体、种群和生态系统等各个水平上[9]。杨志彪[4]发现,随着Cu2+浓度的增高,中华绒螯蟹鳃、肝胰腺、XO-SG和YO等组织器官的结构和功能受到了不可逆的损害,XO-SG分泌MIH和YO分泌20-HE的场所受到破坏,20-HE的分泌受到了抑制,导致蜕皮率下降,从而影响中华绒鳌蟹的生长。本试验发现,在试验浓度条件下,中华绒螯蟹的死亡率随着Cu2+浓度的升高而增加。
本研究结果还表明,水体Cu2+胁迫显著影响中华绒螯蟹免疫识别、信号传导和效应反应相关基因的表达。甲壳动物栖息于水底,受环境中重金属污染的机会较大[10],Cu2+是甲壳动物体内最容易被检测到的重金属之一[11],因此,有关养殖水体中的Cu2+浓度及其对甲壳动物免疫和生理生化反应影响的研究已倍受关注[12]。已有研究表明,水体Cu2+胁迫对甲壳动物细胞和体液免疫功能具有显著影响[5]。LGBP作为一种模式识别蛋白,在甲壳动物的免疫系统中发挥着重要作用[13-15]。它通过识别革兰氏阴性菌的细胞壁成分脂多糖和真菌的细胞壁成分β-1,3-葡聚糖促进血淋巴细胞的吞噬、黑化、包囊、凝集等细胞免疫反应和激活蛋白酶级联反应,引起抗菌肽的合成等体液免疫反应[13];Dorsal基因作为核转录因子家族中的重要一员,能够通过信号通路所具有的信号级联反应,将免疫信号传递到细胞核内,调控抗菌肽等免疫相关基因的表达和分泌,从而在抗真菌和细菌的免疫应答反应中起着重要作用[16];Tube基因作为Toll信号通路中的重要组分,在机体存活、发育以及先天性免疫等生理活动中具有重要的作用[17]。Yu等[17]发现,Tube在中华绒螯蟹免疫和发育方面具有重要的作用,具有免疫和发育的双重功能。PPAF、GPx、GST和PXN作为免疫效应基因,在中华绒螯蟹先天免疫应答中也发挥重要作用[18-20]。本实验发现,Cu2+胁迫对中华绒螯蟹免疫模式识别蛋白相关基因(LGBP)、免疫信号传导相关基因(Dorsal、Tube)及免疫效应相关基因(PPAF、GPx、GST、PXN)的表达均有显著影响,从分子水平说明水体Cu2+胁迫对中华绒螯蟹免疫系统的具有影响。综上所述,重金属Cu2+胁迫对中华绒螯蟹具有明显的毒性作用,且显著影响其免疫相关基因的表达。
参考文献:
[1] Le Moullac G,Haffner P.Environmental factors affecting immune responses in Crustacea[J].Aquaculture,2000,191:121-131.
[2] Lorenz S,Francese M,Smith V J,et al.Heavy metals affect the circulating haemocyte number in the shrimpPalaemonelegans[J].Fish Shellfish Immunol,2001,11:459-472.
[3] Yeh S T,Liu C H,Chen J C.Effect of copper sulfate on the immune response and susceptibility toVibrioalginolyticusin the white shrimpLitopenaeusvannamei[J].Fish Shellfish Immunology,2004,17:437~446.
[4] 杨志彪.水体Cu2+对中华螯蟹(Eriocheirsinensis)毒性作用机制的研究[D].上海:华东师范大学,2005.
Yang Z B.Studies on the toxic mechanism of water-born Cu2+onEriocheirsinensis[D].Shanghai:East China Normal University,2005.
[5]孙汉.pH和硫酸铜对中华绒螯蟹(Eriocheirsinensis)非特异性免疫的影响[D].苏州:苏州大学,2011.
Sun H.Effects of pH and copper sulfate on nonspecific immunity of Chinese mitten crab(Eriocheirsinensis)[D].Suzhou:Suzhou University,2011.
[6] Sun S,Ge X,Hu J,et al.Effects of water-borne copper on the survival,antioxidant stats,metallothionein-I mRNA expression and physiological responses of the Chinese mitten crab,Eriocheirsinensis(Decapoda:Brachyura)larvae[J].Scientia Marina,2014,78(1):91-97.
[7] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTMethod.[J].Methods,2001,25(4):402-408.
[8] 许安阳,王安利.锌铜铁对水产动物免疫机能的影响[J].水产科学,2004,23(9):36-39.
Xu A Y,Wang A L.Effects of zinc,copper and iron on immunity of aquaculture animals[J].Fisheries Science,2004,23(9):36-39.
[9] Li N,Zhao Y L,Yang J.Effects of water-borne copper on digestive and metabolic enzymes of the giant freshwater prawnMacrobrachiumrosenbergii[J].Archives of Environmental Contamination and Toxicology,2008,55:86-93.
[10] Schuwerack P M,Lewis J W,Jones P.The potential use of the South African river crab,Potamonauteswarreni,as a bioindicator species for heavy metal contamination[J].Ecotoxicology,2001,10(3):159-166.
[11] Ip C C,Li X D,Zhang G,et al.Heavy metal and Pb isotopic compositions of aquatic organisms in the Pearl River Estuary,South China[J].Environmental Pollution,2005,138(3):494-504.
[12] Xian J A,Wang A L,Ye C X,et al.Phagocytic activity,respiratory burst,cytoplasmic free-Ca2+concentration and apoptotic cell ratio of haemocytes from the black tiger shrimp,Penaeusmonodonunder acute copper stress[J].Comparative Biochemistry and Physiology C,2010,152(2):182-188.
[13] Du X J,Zhao X F,Wang J X.Molecular cloning and characterization of a lipopolysaccharide and beta-1,3-glucan binding protein from fleshy prawn(Fenneropenaeuschinensis)[J].Molecular Immunology,2007,44(6):1085-1094.
[14] Zhao D X,Chen L Q,Qin C J,et al.Molecular cloning and characterization of the lipopolysaccharide and β-1,3-glucan binding protein in Chinese mitten crab(Eriocheirsinensis)[J].Comparative Biochemistry and Physiology B,2009,154(1):17-24.
[15] 张行.脂多糖和β-1,3-葡聚糖结合蛋白(LGBP)激活中华绒螯蟹(Eriocheirsinensis)酚氧化酶原系统的研究[D].上海:华东师范大学,2016.
Zhang H.Lipopolysaccharide and beta-1,3-glucan binding protein(LGBP)stimulates prophenoloxidase activating system in Chinese mitten crab(Eriocheirsinensis)[D].Shanghai:East China Normal Univer sity,2016.
[16] Yu A Q,Jin X K,Li S,et al.Molecular cloning and expression analysis of a dorsal homologue fromEriocheirsinensis[J].Developmental and Comparative Immunology,2013,41:723-727.
[17] Yu A Q,Jin X K,Wu M H,et al.Identification and characterization of Tube in the Chinese mitten crabEriocheirsinensis[J].Gene,2014,541:41-50.
[18] 赵大显.中华绒螯蟹表达序列标签(EST)分析及免疫相关基因的克隆、表达模式研究[D].上海:华东师范大学,2009.
Zhao D X.Expressed sequence tags analysis and immune-related genes cloning、express pattern in Chinese mitten crab(Eriocheirsinensis)[D].Shanghai:East China Normal University,2009.
[19] Zhao D X,Chen L Q,Qin C J,et al.A delta-class glutathione transferase from the Chinese mitten crabEriocheirsinensis:cDNA cloning,characterization and mRNA expression[J].Fish and Shellfish Immunology,2010,29:698-703.
[20] Lv S,Lu B,Xu J,et al.Immune response of peroxinectin of Chinese mitten crabEriocheirsinensisto exterior stimulation[J].Developmental and Comparative Immunology,2015,51(1):56-64.

