电诱导自组装玉米醇溶蛋白膜的制备与性质
陈桂芸,陈 野,徐 慧,赵 宇
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
玉米醇溶蛋白是玉米胚芽的主要蛋白质成分,其相对分子质量为 25,000~45,000[1],结构为 9个相同重复单位经反平行排列而形成的长条形螺旋状结构[2],在蛋白分子的每个转角处都连接有 1个谷氨酸,并由氢键相连接达到稳定状态.其中螺旋状的外表面成疏水性,而顶部与底部富含谷氨酰胺表现为亲水性[3],玉米醇溶蛋白的双亲性是其自组装的主要驱动力[4].玉米醇溶蛋白具有特殊的溶解性质,由于分子含有大量的含硫氨基酸,且非极性侧链的含量远大于极性侧链,如赖氨酸、脯氨酸、丙氨酸[5],在纯水或无水乙醇中不溶解,而易溶于60%~90%,乙醇溶液或70%~80%,丙酮溶液.在乙醇溶液中,玉米醇溶蛋白带电荷,当溶液 pH低于等电点时,蛋白粒子带正电荷;pH 高于等电点时带负电荷,并且电位越高,粒径越小[6].然而当蛋白粒子静电引力大于斥力,体系不稳定,会发生蛋白凝聚现象[7].
玉米醇溶蛋白成膜性良好,具有较好的阻湿性和生物降解性[8],常用于可降解食品包装材料.但传统浇铸法制备的薄膜机械性质差,影响了其进一步应用. 因此,对其改性以拓宽应用领域成为近年来的热点.
电诱导技术是指通过电信号指导膜自组装过程的一种物理改性方法.该技术一直广泛应用于合金类金属材料的防护涂层制作和集成电路的生产等.近年来,制备纳米材料、功能梯度材料[9]及蛋白质、聚合物等软物质与电沉积的结合应用在各领域引起了广泛关注.在电诱导自组装膜技术中,带电分子可在电场力作用下自发迁移,依靠范德华力、疏水键作用力和氢键等微弱作用力对自组装过程进行调节,随着溶剂中乙醇的蒸发,水分含量不断增加,亲水环境促进了两亲性分子中疏水结合与结构的自组装[10],形成稳定并且结构有序的聚集体,沉积在电极板上或其他载体上,达到一定规则排列的效果,形成结构稳定、性质良好的薄膜材料.
本文利用具有双亲性的带电玉米醇溶蛋白分子在匀强电场中可进行自组装的技术特点,制备稳定结构的电诱导沉积膜,观察微观结构,探究电诱导法处理前后薄膜理化性质的变化,旨在为玉米醇溶蛋白在食品、医药中的应用提供制备工艺和基础数据.
1 材料与方法
1.1 原料、试剂与仪器
玉米醇溶蛋白(94.7%),江苏高邮日星药用辅料有限公司;无水乙醇(分析纯),天津市光复科技发展有限公司;丙三醇(分析纯),天津市化学试剂一厂.
1.2 方法
1.2.1 电诱导法制备玉米醇溶蛋白膜
将适量玉米醇溶蛋白溶于 75%,~95%,的乙醇溶液,加入20%,甘油,制成0.1,g/mL的玉米醇溶蛋白溶液,搅拌均匀,60,℃水浴 20,min后,将电极置于溶液中连入电路,如图1所示.选用ITO导电玻璃作为电极,电极间距 25,mm,在 100,V、5,A/m2的场强下通电,正、负电极表面均有玉米醇溶蛋白胶束层沉积,在负电极沉层较厚,取出电极板,常温条件下放置于通风橱中,干燥 1,h,轻轻将薄膜剥离,膜厚为 50~100,μm.同条件下处理溶液,利用流延法将溶液浇铸于聚乙烯纤维板(150,mm×250,mm)上,常温条件下放置于通风橱中,干燥 1,h,即得到未经电场处理的流延膜.所有的薄膜置于相对湿度(50±4)%、温度(23±2)℃干燥器中保存待用.
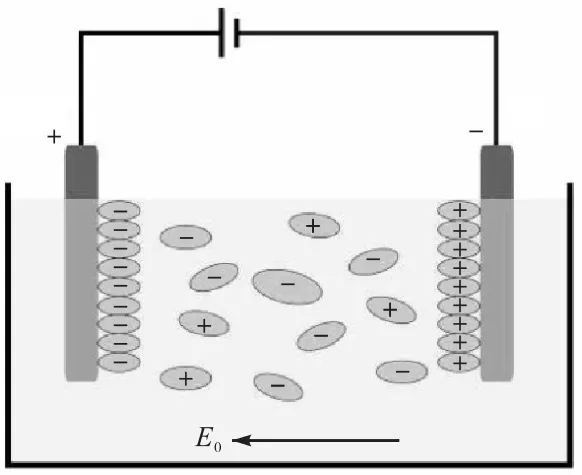
图1 电诱导过程示意图Fig. 1 Schema of electric induction process
1.2.2 膜机械性质
将平衡后的电诱导膜与流延膜裁成 100,mm×60,mm 的长条,用螺旋测微器测量膜的厚度,每个长条随机测 4个点,取平均值作为膜厚度.拉伸速率为10,mm/min.实验室温度保持在 20~23,℃,相对湿度(50±4)%,,每种试样测量4次.
1.2.3 膜表面疏水性测定
选取膜的静态接触角,以此表征不同电场模式对膜的表面疏水性的影响.实验利用JY-82A型视频接触角测定仪,先将薄膜未与电极或聚乙烯纤维板接触的一面朝上,固定在实验平台上,调至薄膜表面水平,再将 5,μL去离子水滴竖直滴加在不同体积分数乙醇下制备的诱导膜和流延膜表面,通过静态接触角测量仪记录水滴下落过程,软件拍照速度为每秒 5张,连续记录 10,s,记录液滴在膜表面的形状变化,采用量角法测定接触角大小,每张膜随机测定 4个点,取平均值.
1.2.4 膜吸水性测定
测量膜的吸水率,以此表征膜的耐水性.将1.2.1节中的试样剪裁成 30,mm×30,mm 的样品,置于60,℃下预干燥 48,h,记录质量 m1;然后置于盛有纯净水的烧杯中浸渍 24,h后取出,用干燥洁净纱布擦干膜表面水,称得吸水后的质量 m2;再将其放入60,℃的烘箱中 24,h后称质量 m3,每种试样测量 4次,取平均值,按照式(1)计算吸水率.
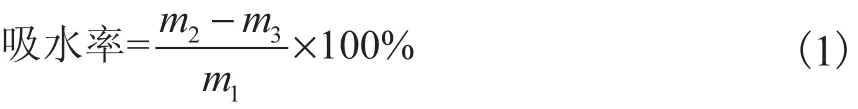
1.2.5 膜水蒸气透过率测定
将试样裁成有效直径为 10,mm 的圆片,用螺旋测微器测量膜的厚度,每个圆片随机测 4个点,以平均值作为膜厚度,并将其密封在含 10,g无水 CaCl2测试杯上,置于相对湿度 90%,、温度 25,℃的环境中96,h,每隔 24,h测试杯子的质量,按照式(2)和式(3)计算膜的水蒸气透过率.
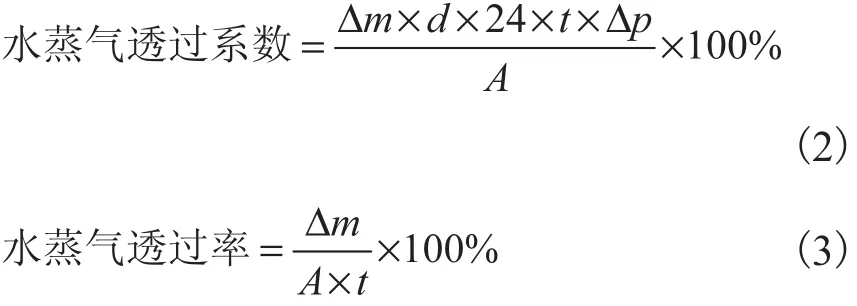
式中:水蒸气透过系数,g·m·d·kPa/mm2;水蒸气透过率,g/(m2·d);t 为测量时间,h;d 为膜的厚度,mm;Δp内外水蒸气压差,kPa;A为膜的测试面积,mm2;Δm 为水蒸气迁移量,g;纯水在 25,℃时的饱和水蒸气压为3.167,1,kPa.
1.2.6 膜热稳定性测定
称取2~4,mg试样放于铝坩埚中密封,另取一个空密封坩埚作为参考.仪器校准铟(ΔH=28.59,J/g,初始熔点 156.60,℃).室温加热至 200,℃,升温速度10,℃/min.
1.2.7 膜微观结构观测
观察薄膜的表面和横断面,将试样液氮脆断成大小为 2,mm×2,mm的碎片,用镊子固定到样品台上,喷金镀膜处理 5,min,真空度为 0.2,kPa,加速电压为20,kV,放大倍率为5,000倍.
1.3 统计分析
数据采用SAS Software统计分析软件进行差异性分析,每个试样测 4次,数据以“平均值±标准差”表示.采用 t检验法进行显著性分析,不同字母表示组间有显著性差异(P<0.05).
2 结果与分析
薄膜结构受到溶液中玉米醇溶蛋白粒子的初始浓度、表面电位的分布均匀程度影响[11].实验发现:随沉积时间的增加,蛋白薄膜厚度持续增加;但若初始蛋白浓度过大,导致电诱导玉米醇溶蛋白膜表面形成簇状沉积,诱导膜表面粗糙;若通电时间过长,某一时刻残留量过低,带电粒子向两极移动过快,导致溶液中间形成了带电粒子的“真空带”,使得沉积过程无法继续进行;若功率过大,负极氧化反应严重,影响负极薄膜性质,而正极所沉积的薄膜性质几乎不受还原反应的影响.
基于此,实验选择制备条件为:电场强度100,V,5,A/m2,通电 10,min,实验初始溶液的蛋白质量浓度为0.1,g/mL.
2.1 机械性能
图 2和图 3分别为乙醇体积分数 75%,、80%,、85%,、90%,、95%,条件下,电诱导膜和普通流延膜的抗拉强度与断裂伸长率.
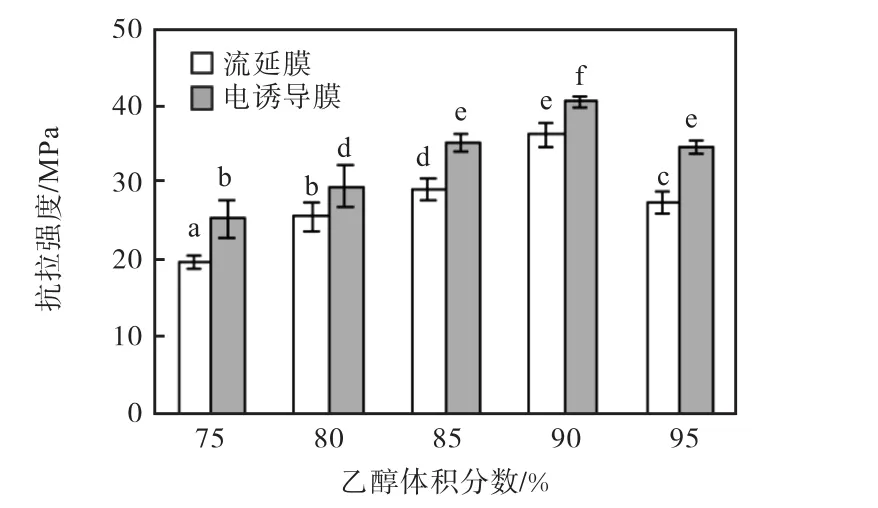
图2 不同乙醇体积分数下流延膜与电诱导膜的抗拉强度Fig. 2 Effect of different ethanol concentrations on the tensile strength of the modified and cast films

图3 不同乙醇体积分数下流延膜与电诱导膜的断裂伸长率Fig. 3 Effect of different ethanol concentrations on the elongation of the modified and cast films
当乙醇体积分数 90%,时,电诱导膜的抗拉强度最大,达(40.6±0.8)MPa,断裂伸长率为(7.3±0.3)%,,电诱导对材料力学性质影响显著(P<0.05).这是由于随着乙醇浓度的增加,玉米醇溶蛋白的胶束结构逐渐发生倒置,原来外部的亲水基团变为疏水基团[12],蛋白质的非共价键破坏程度增加,蛋白分子内部的疏水基团暴露,表面形成疏水层.蛋白分子间的疏水作用力逐渐增加,抗拉强度与断裂伸长率增加.整体上,电诱导膜机械性能增加,这是由于在电场力作用下,胶束粒径有效降低,蛋白内部交互作用增强,并在极板形成排列规律,且结构更致密的薄膜.
2.2 表面接触角测定
图 4为 75%,~95%,乙醇体积分数下,电诱导膜和普通流延膜的表面接触角变化规律.随着乙醇体积分数的增大,电诱导膜和普通流延膜的表面接触角均呈现先增大后降低的波动趋势.当乙醇体积分数为 90%,时,电诱导膜的表面接触角最大,为 69.39°±0.63°;75%,时电诱导膜的表面接触角最小,为58.15°±0.96°.较流延膜,电诱导膜整体上表面接触角变小.这是由于玉米醇溶蛋白为亲疏水两性分子,含有亲水性和疏水性氨基酸残基[13],经电诱导,更多亲水性基团暴露,在正电极表面聚集时,亲水基团朝外排列,使得电诱导改性后薄膜表面疏水性降低.

图4 不同乙醇体积分数下流延膜与电诱导膜的表面接触角Fig. 4 Effect of different ethanol concentrations on the contact angle of the modified and cast films
2.3 阻湿性能
图 5为 75%,~95%,乙醇体积分数下,电诱导膜和普通流延膜的吸水性规律.

图5 不同乙醇体积分数下流延膜与电诱导膜的吸水率Fig. 5 Effect of different ethanol concentrations on the water absorption of the modified and cast films
吸水性随着乙醇体积分数的增大整体均呈现降低趋势,整体上电诱导对阻湿性影响显著(P<0.05),当乙醇体积分数 90%,时,吸水性最小.较流延膜,经电诱导改性后玉米醇溶蛋白膜吸水性有所减小,说明电诱导可以加强蛋白分子间交联程度,形成更为致密网络结构,阻碍水分子吸收与扩散.水蒸气透过率的变化趋势相同(图6).
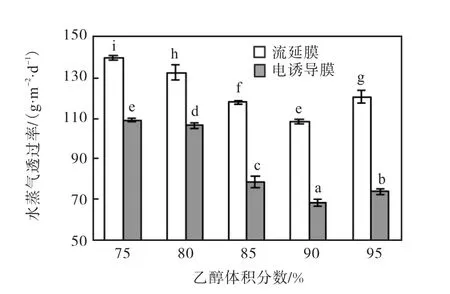
图6 不同乙醇体积分数下流延膜与电诱导膜的水蒸气透过率Fig. 6 Effect of different ethanol concentrations on the water vapour transmission of the modified and cast films
2.4 微观结构
流延膜和电诱导膜的表面与断面的微观结构如图7所示.

图7 流延膜和电诱导膜的表面与断面SEM图Fig. 7 SEM images of the surface and section of the cast and modified films
由图 7可知:流延膜表面粗糙,有堆叠现象,断面松散,部分蛋白仍为椭球形颗粒.这是由于流延成膜过程中,分子受重力作用向下沉淀,溶剂中乙醇相先于水相挥发,造成溶液极性变大,蛋白空间结构再次发生变形.相反,经电诱导改性的诱导膜表面与断面更为光滑、致密.这是由于玉米醇溶蛋白在溶液中两性解离,侧链基团中显正电性,—COO-显负电,带电胶束在基板层层规则的沉积,薄膜内作用力均匀,形成的薄膜不会像传统流延膜发生蛋白未溶解完全或蛋白胶束堆积成簇现象.该结果可良好解释电诱导膜水蒸气透过率与机械强度的改善现象.
2.5 热稳定性分析
不同乙醇体积分数下流延膜与电诱导膜的 DSC曲线如图8所示.图8中80-A表示80%,乙醇溶液下的流延膜,80-B表示 80%,乙醇溶液下的电诱导膜,90-A表示90%,乙醇溶液下的流延膜,90-B表示90%,乙醇溶液下的电诱导膜.由图 8可知,90%,乙醇溶液制备的电诱导膜(B)和传统流延膜(A)变性温度均高于 80%,乙醇溶液制备的薄膜,90%,乙醇溶液制备的电诱导膜热变性温度提高到 122.37,℃,且电诱导膜的变性温度大于普通流延膜.这说明电场力的作用使玉米醇溶蛋白薄膜稳定性提高,电场引起不同程度的疏水相互作用,形成紧凑的薄膜结构,导致了更高的变形温度,膜稳定性增强.
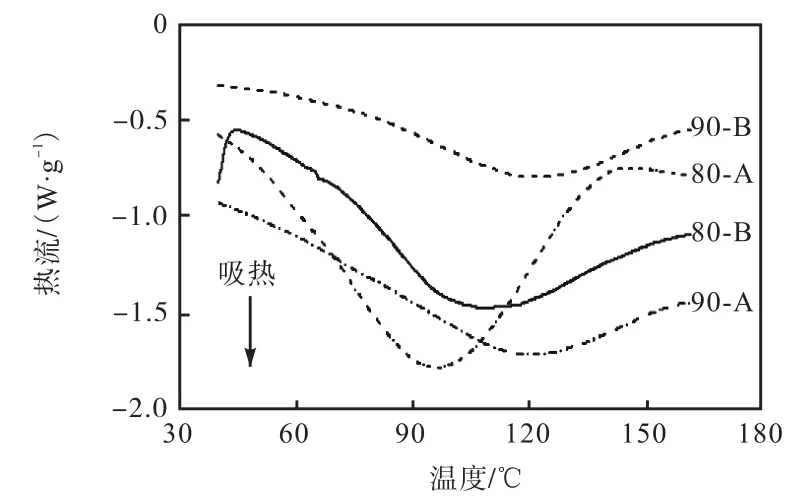
图8 不同乙醇体积分数下流延膜与电诱导膜的DSC曲线Fig. 8 DSC curves of the modified and cast films
3 结 论
玉米醇溶蛋白带电分子在电场中自组装,所得电诱导沉积膜的理化性质较传统流延膜均有改善,薄膜结构致密、性质稳定,并有亲水性方向转变趋势.电诱导膜在食品保鲜、制备生物传感器、生物相容性医学材料、蛋白与电沉积技术的结合应用等方面有潜在应用价值.
参考文献:
[1] 任婷婷,李艳娟,李书国. 玉米醇溶蛋白的提取、功能特性及其应用研究[J]. 粮油食品科技,2014,22(3):6-10.
[2] Wang Y,Su C P,Schulmerich M,et al. Characterization of core-shell structures formed by zein[J]. Food Hydrocolloids,2013,30(2):487-494.
[3] Lai H M,Geil P H,Padua G W. X-ray diraction characterization of the structure of zein-oleic acid fi lms[J].Journal of Applied Polymer Science,1999,71:1267-1281.
[4] LoWik D W P M,Hest J C M V. Peptide based amphiphiles[J]. Chemical Society Reviews,2004,33(4):234-245.
[5] Shukla R,Cheryan M. Zein:The industrial protein from corn[J]. Industrial Crops & Products,2001,13(3):171-192.
[6] 吴磊燕. 玉米醇溶蛋白改性、界面特性及成膜性研究[D]. 广州:华南理工大学,2010.
[7] Sakuno M M,Shinya M,Shigeru K,et al. Adsorption and structural change of beta-lactoglobulin at the diacylglycerol-water interface[J]. Langmuir,2008,24(20):11483-11488.
[8] 吴国际,吕长波,鲁传华,等. 玉米醇溶蛋白的物理化学改性[J]. 中国组织工程研究与临床康复,2011,15(25):4665-4668.
[9] 李莉,魏子栋,李兰兰. 电沉积纳米材料研究现状[J].电镀与精饰,2004,26(3):9-14.
[10] Yi W,Padua G W. Formation of zein microphases in ethanol-water[J]. Langmuir,2010,26(15):12897-12901.
[11] Guo H X,Heinämäki J,Yliruusi J. Stable aqueous film coating dispersion of zein[J]. Journal of Colloid & Interface Science,2008,322(2):478-484.
[12] Kim S,Xu J. Aggregate formation of zein and its structural inversion in aqueous ethanol[J]. Journal of Cereal Science,2008,47(1):1-5.
[13] Wang Q,Wang J F,Geil P H,et al. Zein adsorption to hydrophilic and hydrophobic surfaces investigated by surface plasmon resonance[J]. Biomacromolecules,2004,5(4):1356-1361.

