PEG10在人胃癌组织中的表达及其临床意义
田 山,彭秀兰,詹 娜,曾 智,贾雪梅,董卫国
1.武汉大学人民医院消化内科,湖北 武汉 430060; 2.武汉市第五医院肿瘤一科; 3.武汉大学人民医院病理科
胃癌是消化道发生率最高的肿瘤,而且是世界上死亡人数第二的恶性肿瘤[1-2]。近年来,胃癌的发病率有下降趋势,但全球每年仍有70万例患者死于胃癌[3]。尽管胃癌的治疗方式多样,尤其是靶向治疗效果颇具成效,5年生存率较前有所上升,但晚期胃癌患者往往由于转移而预后较差[4-5]。因此,寻找新的胃癌分子标记物对早期诊断和改善患者预后意义重大[6]。
基因印迹是一种普遍存在的表观遗传学现象,参与基因表达的调控。正常的印迹基因与细胞增殖、分化及胚胎发育等密切相关,而印迹基因甲基化则参与多种肿瘤的发生、发展。印记基因10(paternally expressed gene 10,PEG10)位于人染色体的7q21区域[7-8],也称为EDR、HB-1、Mar2、MEF3L、Mart2或RGAG3,是一种印记基因。其特征为仅有来自父本的等位基因表达,而来自母本的等位基因沉默。已有研究[9-12]表明,PEG10在肺癌、乳腺癌、前列腺癌、胰腺癌、胆囊癌和肝癌等多种恶性肿瘤中过表达。此外,PEG10是判断肺癌、胆囊癌、肝癌等预后的潜在生物学标志物。然而,目前关于PEG10在胃癌中表达的研究甚少,PEG10的表达与胃癌的临床病理特征及预后的关系尚不明确。因此,本研究旨在探讨PEG10与胃癌的发生及其临床病理特征与预后的相关性。
1 资料与方法
1.1一般资料收集2010年1月至2017年1月武汉大学人民医院手术切除的胃癌组织(84例)及其癌旁组织(距癌边界<2 cm)、正常胃组织标本(10例),并构建组织芯片。84例胃癌患者中,男55例,女29例,年龄23~84岁,其中<60岁患者48例,≥60岁患者36例。84例胃癌患者均具有完整的临床病理资料及术后随访资料,所有肿瘤患者术前均未接受放疗、化疗及分子靶向治疗。按照2010年WHO胃肠道肿瘤组织学分类标准[13]对胃癌的诊断、分级进行修订,诊断意见统一。
1.2主要试剂及方法PEG10(稀释浓度1∶500)购自Abcam公司,SP试剂盒和二氨基联苯胺(DAB)显色剂购自福州迈新生物技术开发有限公司。染色时用磷酸缓冲液代替一抗作为阴性对照,已知阳性组织(胃癌组织)为阳性对照。所有样本均经质量浓度为40 g/L的中性甲醛固定,常规石蜡包埋,4 μm连续切片。武汉爱威尔生物科技有限责任公司提供技术构建组织芯片。免疫组化采用SP法,切片经甲醛及乙醇脱蜡、水化后,用pH 6.0的柠檬酸盐缓冲液进行抗原热修复,滴加一抗后在37 ℃的水浴锅中孵育1 h,分别加入二抗、三抗后再行DAB显色,苏木素复染细胞核,冲洗晾干后中性树胶封片。
1.3结果判读PEG10阳性为棕黄色,主要位于胞浆和胞膜。采用半定量积分法[14]判断结果,具体操作如下:(1)阳性强度:无色为0分,淡黄色为1分,黄色为2分,棕黄色为3分;(2)阳性面积:<10%为0分,10%~25%为1分,26%~50%为2分,>50%为3分。总分(0~9)=阳性面积×强度,总分0分为不表达,1~3分为弱表达;4~6分为中度表达;7~9分为强表达,将不表达和弱表达(0~3分)定义为阴性,中度和强表达(4~9分)定义为阳性。
1.4统计学处理采用SPSS 20.0软件进行统计学分析,计数资料采用χ2检验,应用Kaplan-Meier法对胃癌患者的生存时间进行分析,应用Cox回归模型进行胃癌患者的预后因素分析。P<0.05为差异有统计学意义。
2 结果
2.1PEG10在胃癌及其癌旁组织中的表达在84例胃癌组织中,有63例(75.00%)PEG10阳性表达;对应的84例癌旁组织中,有50例(59.52%)PEG10阳性表达,差异有统计学意义(χ2=4.601,P=0.032)。标本中PEG10着色主要位于胞浆和胞膜,未见细胞核着色。其中,胃癌组织PEG10以强阳性表达为主,而癌旁组织以弱阳性表达及中度阳性表达为主。10例正常胃组织中均无PEG10阳性表达(见图1)。
2.2PEG10与胃癌患者临床病理参数之间的关系在55例伴淋巴结转移的胃癌患者中,46例PEG10阳性表达,而29例不伴淋巴结转移的患者中,17例PEG10阳性表达,差异有统计学意义(χ2=6.115,P=0.013),表明PEG10的表达与淋巴结转移相关。35例早期胃癌(Ⅰ+Ⅱ)患者中,有21例患者PEG10阳性表达,而在49例中晚期胃癌(Ⅲ+Ⅳ)患者中,42例患者PEG10阳性表达(χ2=7.710,P=0.007),表明PEG10与肿瘤TNM分期相关。PEG10的表达与性别、年龄、肿瘤类型、分化程度、浸润深度、Lauren’s分型及肿瘤直径无相关性(P>0.05)(见表1)。
2.3PEG10的表达与胃癌患者预后的关系Kaplan-Meier生存分析显示,PEG10阳性表达的胃癌患者3年生存率为70.80%,5年生存率为32.80%,6年生存率为2.70%,中位生存时间(49.00±1.64)个月。PEG10阴性表达的胃癌患者3年生存率为89.60%,5年生存率为53.20%,6年生存率为26.60%,中位生存时间为(63.00±6.75)个月,经Log-rank检验发现,两者差异有统计学意义(χ2=5.516,P=0.019)(见图2)。通过Cox单因素回归分析发现,胃癌患者年龄及PEG10阳性表达是影响患者生存的危险因素(P<0.05),而Cox多因素回归分析发现,PEG10阳性表达是患者预后不良的独立危险因素(P=0.03)(见表2)。
3 讨论
PEG10是近年来发现的一种印记基因,其功能取决于甲基化水平[15-16]。同时,PEG10也是一种癌基因,参与多种肿瘤的发生与发展[11,17-18]。本研究发现,PEG10在胃癌组织中高表达(强表达为主),在相应癌旁组织中相对低表达(中度或弱表达为主),而在正常胃组织中不表达。王凯[19]的一项研究发现,PEG10在胃腺癌组织中强表达,在相应癌旁组织中低表达,而在正常胃组织中不表达,差异有统计学意义,与此次研究的结果一致。王凯等[20]通过RT-PCR法检测PEG10 mRNA表达时,得出其在胃癌组织中高表达,具有促进胃癌细胞生长这一结论。本次研究结果推测,尽管癌旁组织在形态上尚无明显改变,但其分子生物学水平却已发生改变,PEG10表达较正常胃组织上调。因此,我们推测PEG10上调可能是胃癌早期的分子生物学改变的原因。

图1 PEG10在胃癌、癌旁及正常组织中的表达(100×) A:PEG10在胃癌组织中强阳性表达(黄褐色);B:PEG10在癌旁组织中弱阳性表达(浅黄色);C:PEG10在正常胃组织中不表达Fig 1 The expression of PEG10 in the gastric cancer tissues, adjacent tissues and normal gastric tissues (100×) A: PEG10 was strongly expressed in the gastric cancer tissues (tan); B: PEG10 was weakly expressed in the adjacent tissues (light yellow); C: PEG10 was hardly expressed in the normal gastric tissues
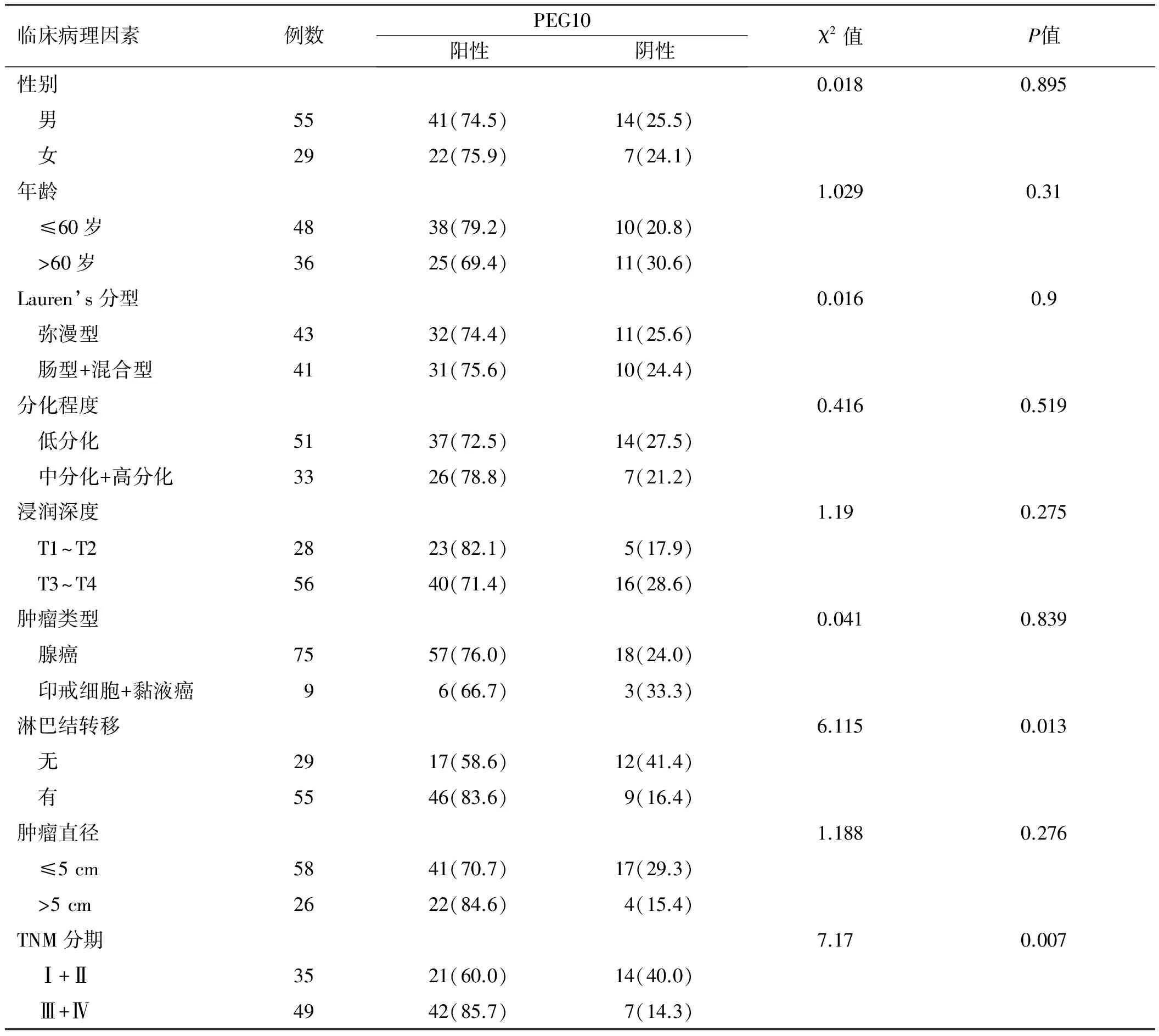
表1 胃癌组织中PEG10的表达与临床病理因素的相关性Tab 1 Correlation between the expression of PEG10 and clinicopathological factors in gastric cancers 例数/%
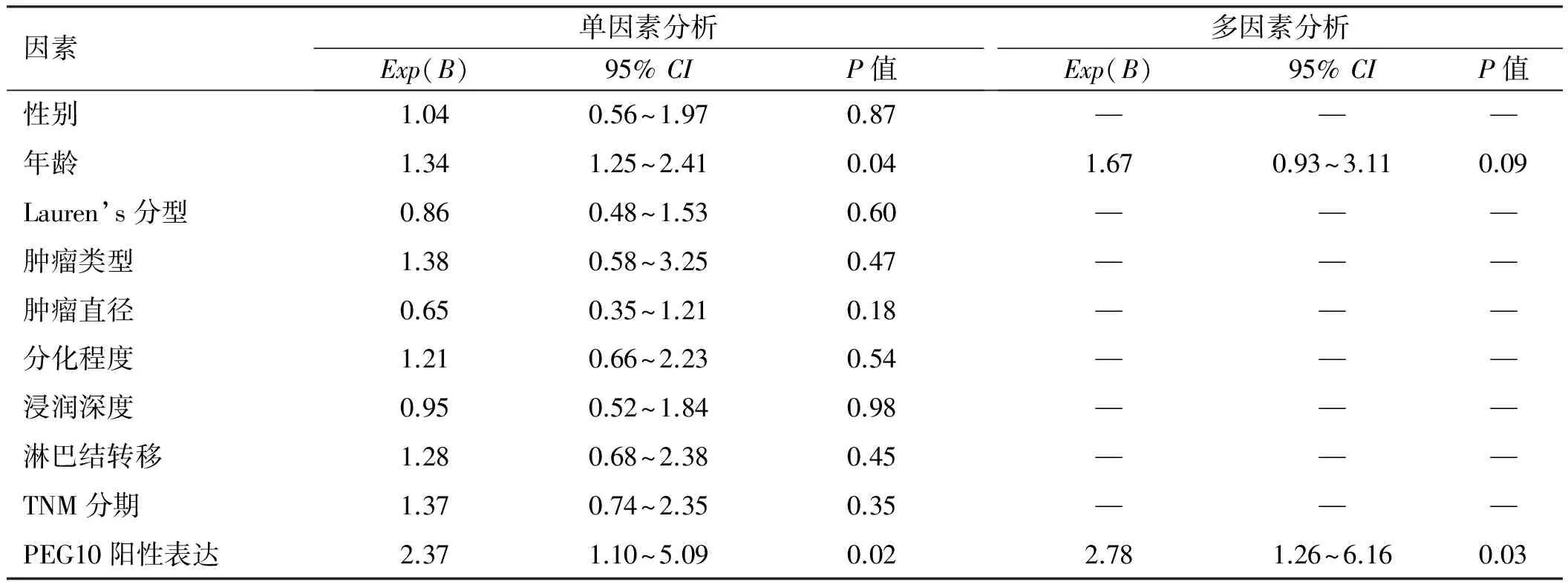
表 2 84例胃癌患者预后因素的Cox回归分析Tab 2 Cox regression analysis of 84 cases of gastric cancer
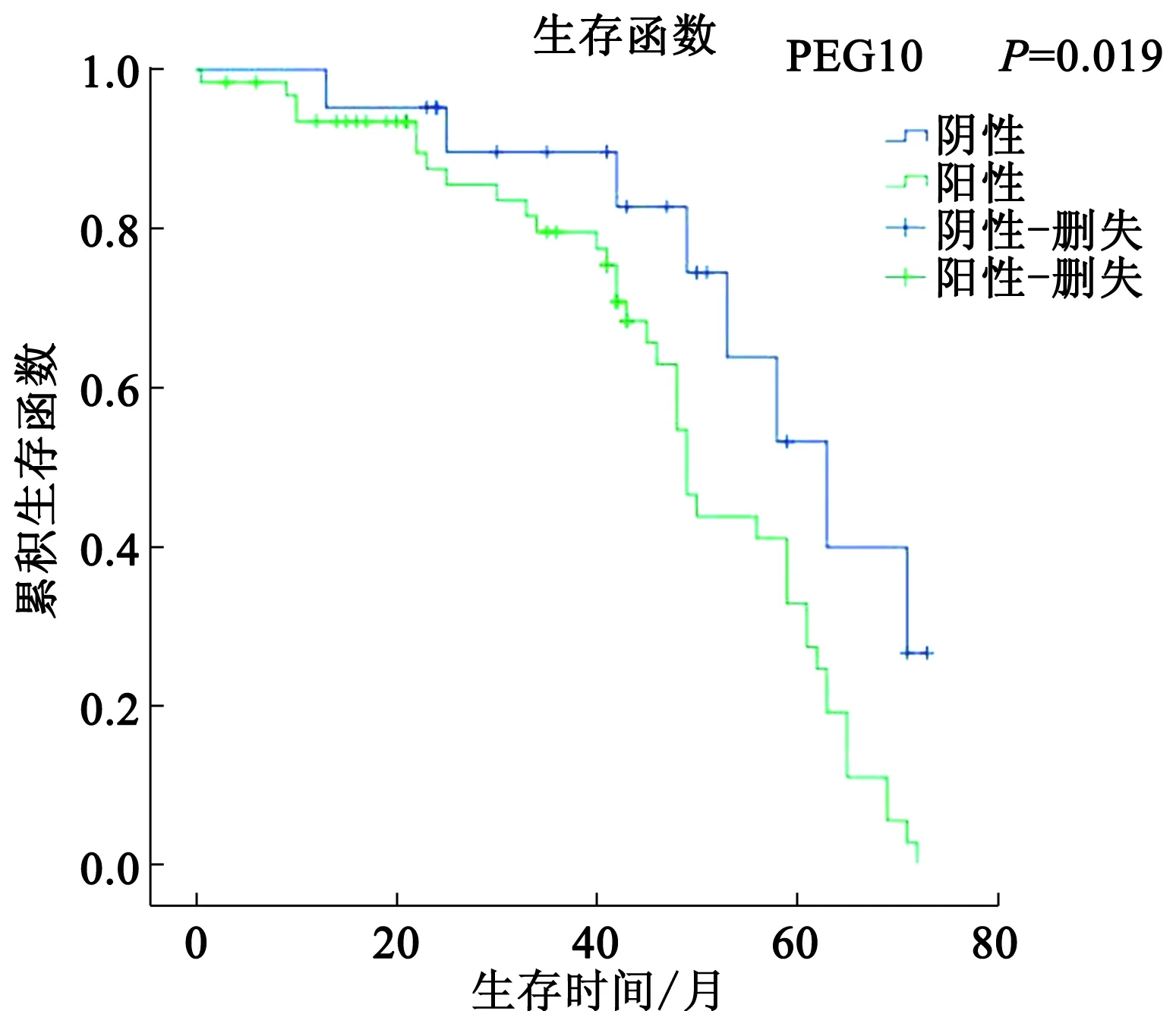
图2 84例胃癌患者Kaplan-Meier生存曲线Fig 2 Kaplan-Meier survival curves in 84 cases of gastric cancer
此次研究还发现,PEG10的表达与胃癌患者淋巴结转移、TNM分期相关。DENG等[11]研究发现,PEG10高表达与肺癌淋巴结转移密切相关。淋巴结转移是影响胃癌患者预后的不良因素,分化程度低、淋巴管浸润和血管浸润均属于淋巴结转移的重要危险因素[21]。淋巴结转移患者PEG10表达的强度明显强于无淋巴结转移者,两者呈正相关,表明PEG10高表达的胃癌更具有恶性的侵袭性,容易发生局部浸润和淋巴结转移,提示PEG10高表达与胃癌的发生、发展和侵袭转移相关。本研究的Kaplan-Meier生存曲线表明,PEG10表达阳性的胃癌患者5年生存率明显低于PEG10阴性患者,且PEG10阳性表达的胃癌患者中位生存期也明显短于阴性表达者,提示PEG10的高表达促进胃癌的侵袭转移,降低胃癌患者的生存率。因此,PEG10阳性表达有可能成为胃癌癌变早期的分子生物学标志物之一,并可作为预测胃癌患者预后的指标之一。
研究[17]发现,PEG10通过抑制肿瘤细胞凋亡而促进肝癌的发生与转移,其表达受促癌因子c-MYC、转录因子E2F及雄激素的调控[11,22-23]。SHYU等[24]研究发现,miR-122通过与PEG10基因的非转录区结合而下调PEG10表达,因而得出PEG10并非诊断肝癌的理想指标,但对肝癌患者预后判断仍具有一定价值这一结论。LIU等[12]认为,PEG10和TSG101阳性表达与胆囊癌的临床病理特征、肿瘤生物学行为及预后不良密切相关。DENG等[11]认为,PEG10通过上调β-catenin、MMP-2及MMP-9表达,抑制E-cadherin表达而促进肺癌的发生、浸润与转移。PENG等[18]发现,PEG10通过ERK/MMP7通路促进胰腺癌的浸润与转移。此外,AKAMATSU等[25]研究发现,PEG10通过促进TGF-β信号通路Snail蛋白的表达而促进前列腺癌的发生。CHEN等[26]研究表明,PEG10可促进滋养层细胞增生,且通过TIMP-1增加滋养层细胞的侵袭性。可见PEG10通过多种途径参与多种肿瘤的发生与发展。由于目前关于PEG10与胃癌相关性的研究甚少,PEG10参与胃癌发生、发展及转移的具体机制尚不明确,仍需进一步的研究加以探讨。
综上所述,PEG10表达上调可能是胃癌早期病变的分子生物学改变,而高表达与胃癌侵袭及转移等恶性行为相关,是胃癌患者预后不良的一个重要因素。
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2012 [J]. CA Cancer J Clin, 2012, 62(1): 10-29. DOI: 10.3322/caac.20138.
[2] 常敏, 张久聪, 周琴, 等. 胃癌流行病学研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(9): 966-969. DOI: 10.3969/j.issn.1006-5709.2017.09.002.
CHANG M, ZHANG J C, ZHOU Q, et al. Research progress of clinical epidemiology of gastric cancer [J]. Chin J Gastroenterol Hepatol, 2017, 26(9): 966-969. DOI: 10.3969/j.issn.1006-5709.2017.09.002.
[3] KAMANGAR F, DORES G M, ANDERSON W F. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world [J]. J Clin Oncol, 2006, 24(14): 2137-2150. DOI: 10.1200/JCO.2005.05.2308.
[4] SHAH M A, AJANI J A. Gastric cancer--an enigmatic and heterogeneous disease [J]. JAMA, 2010, 303(17): 1753-1754. DOI: 10.1001/jama.2010.553.
[5] 黄倩倩, 陈晶. 胃癌复发、转移的研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(3): 241-244. DOI: 10.3969/j.issn.1006-5709.2017.03.001.
HUANG Q Q, CHEN J. Progress of recurrence and metastasis of gastric cancer [J]. Chin J Gastroenterol Hepatol, 2017, 26(3): 241-244. DOI: 10.3969/j.issn.1006-5709.2017.03.001.
[6] 张天瑾, 陈兆峰, 王玉平, 等. 肿瘤标志物在胃癌预后判断应用中的研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(12): 1321-1326. DOI: 103969./j.issn.1006.5709.2017.12.001.
ZHANG T J, CHEN Z F, WANG Y P, et al. Research progress of tumor markers in the prognosis of gastric cancer [J]. Chin J Gastroenterol Hepatol, 2017, 26(12): 1321-1326. DOI: 10.3969/j.issn.1006.5709.2017.12.001.
[7] DONG H, ZHANG H, LIANG J, et al. Digital karyotyping reveals probable target genes at 7q21.3 locus in hepatocellular carcinoma [J]. BMC Med Genomics, 2011, 4: 60. DOI: 10.1186/1755-8794-4-60.
[8] TSUJI K, YASUI K, GEN Y, et al. PEG10 is a probable target for the amplification at 7q21 detected in hepatocellular carcinoma [J]. Cancer Genet Cytogenet, 2010, 198(2): 118-125. DOI: 10.1016/j.cancergencyto.2010.01.004.
[9] BANG H, HA S Y, HWANG S H, et al. Expression of PEG10 is associated with poor survival and tumor recurrence in hepatocellular carcinoma [J]. Cancer Res Treat, 2015, 47(4): 844-852. DOI: 10.4143/crt.2014.124.
[10] LI C M, MARGOLIN A A, SALAS M, et al. PEG10 is a c-MYC target gene in cancer cells [J]. Cancer Res, 2006, 66(2): 665-672. DOI: 10.1158/0008-5472.CAN-05-1553.
[11] DENG X, HU Y, DING Q, et al. PEG10 plays a crucial role in human lung cancer proliferation, progression, prognosis and metastasis [J]. Oncol Rep, 2014, 32(5): 2159-2167. DOI: 10.3892/or.2014.3469.
[12] LIU Z, YANG Z, LIU D, et al. TSG101 and PEG10 are prognostic markers in squamous cell/adenosquamous carcinomas and adenocarcinoma of the gallbladder [J]. Oncol Lett, 2014, 7(4): 1128-1138. DOI: 10.3892/ol.2014.1886.
[13] 李增山, 李青. 2010年版消化系统肿瘤WHO分类解读[J]. 中华病理学杂志, 2011, 40(5): 351-354. DOI: 10.3760/cma.j.jssn.0529-5807.2011.05.019.
[14] 白玲, 陈乃玲, 张昶, 等. 结肠癌患者细胞凋亡与预后意义的初步研究[J]. 胃肠病学和肝病学杂志, 2006, 15(4): 376-378. DOI: 10.3969/j.issn.1006-5709.2006.04.013.
BAI L, CHEN N L, ZHANG C, et al. An initial study of apotosis in colorectal cancer patients and its prognostic significance [J]. Chin J Gastroenterol Hepatol, 2006, 15(4): 376-378. DOI: 10.3969/j.issn.1006-5709.2006.04.013.
[15] HANNULA-JOUPPI K, MUURINEN M, LIPSANEN-NYMAN M, et al. Differentially methylated regions in maternal and paternal uniparental disomy for chromosome 7 [J]. Epigenetics, 2014, 9(3): 351-365. DOI: 10.4161/epi.27160.
[16] O’DOHERTY A M, MAGEE D A, O’SHEA L C, et al. DNA methylation dynamics at imprinted genes during bovine pre-implantation embryo development [J]. BMC Dev Biol, 2015, 15: 13. DOI: 10.1186/s12861-015-0060-2.
[17] BANG H, HA S Y, HWANG S H, et al. Expression of PEG10 is associated with poor survival and tumor recurrence in hepatocellular carcinoma [J]. Cancer Res Treat, 2015, 47(4): 844-852. DOI: 10.4143/crt.2014.124.
[18] PENG Y P, ZHU Y, YIN L D, et al. PEG10 overexpression induced by E2F-1 promotes cell proliferation, migration, and invasion in pancreatic cancer [J]. J Exp Clin Cancer Res, 2017, 36(1): 30. DOI: 10.1186/s13046-017-0500-x.
[19] 王凯. 印迹基因PEG10在胃癌中的表达及其对胃癌细胞生长影响的研究[D]. 长春: 吉林大学, 2008.
[20] 王凯, 朴云峰, 丁大勇, 等. 印迹基因PEG10在胃腺癌组织中的表达及意义[J]. 吉林大学学报(医学版), 2008, 34(2): 309-312. DOI: 10.13481/j.1671-587x.2008.02.053.
WANG K, PIAO Y F, DING D Y, et al. Expression of imprinted gene PEG10 in human gastric adenocarcinoma tissues and significance [J]. Journal of Jilin University (Medicine Edition), 2008, 34(2): 309-312. DOI: 10.13481/j.1671-587x.2008.02.053.
[21] 李宇, 李培准, 王东升, 等. 淋巴结微转移对胃癌患者术后预后影响的Meta分析[J]. 中华普通外科杂志, 2014, 29(10): 791-793. DOI: 10.3760/cma.j.issn.1007-631X.2014.10.015.
[22] WANG C, XIAO Y, HU Z, et al. PEG10 directly regulated by E2Fs might have a role in the development of hepatocellular carcinoma [J]. FEBS Lett, 2008, 582(18): 2793-2798. DOI: 10.1016/j.febslet.2008.07.009.
[23] JIE X, LANG C, JIAN Q, et al. Androgen activates PEG10 to promote carcinogenesis in hepatic cancer cells [J]. Oncogene, 2007, 26(39): 5741-5751. DOI: 10.1038/sj.onc.1210362.
[24] SHYU Y C, LEE T L, LU M J, et al. miR-122-mediated translational repression of PEG10 and its suppression in human hepatocellular carcinoma [J]. J Transl Med, 2016, 14(1): 200. DOI: 10.1186/s12967-016-0956-z.
[25] AKAMATSU S, WYATT A W, LIN D, et al. The placental gene PEG10 promotes progression of neuroendocrine prostate cancer [J]. Cell Rep, 2015, 12(6): 922-936. DOI: 10.1016/j.celrep.2015.07.012.
[26] CHEN H, SUN M, LIU J, et al. Silencing of paternally expressed gene 10 inhibits trophoblast proliferation and invasion [J]. PLoS One, 2015, 10(12): e0144845. DOI: 10.1371/journal.pone.0144845.

