Bcl-9基因敲除对乳腺癌细胞株侵袭及迁移能力作用研究
刘 爽,邵 茜,牛群丽,安 杰,张 文,刘明亮
乳腺癌随发病率及病死率的逐渐升高,成为威胁全球女性健康的最常见恶性肿瘤之一[1-3]。B细胞淋巴因子9(B-cell-CLL/lymphoma 9, Bcl-9)基因定位于人染色体1q21,易发生染色体(1;14)、(q21;q23)转位[4],并发现Bcl-9是Wnt信号通路中新发现的一个癌基因,其异常表达是促使Wnt信号通路异常激活导致肿瘤发生的新机制。Wnt信号通路异常与肿瘤发生的关系一直是近年来肿瘤研究的热点,这条通路包含多种信号成员蛋白,众多生命活动均受其调节控制。该信号通路主要参与了细胞的增殖、分化、凋亡与抗凋亡等生命过程,其异常激活与细胞单克隆性无限制恶性生长及癌变密切相关。Bcl-9在急性淋巴细胞白血病、多发性骨髓瘤、结直肠癌、胃癌、肝细胞癌、前列腺癌及非吸烟患者肺腺癌等多种肿瘤组织中均存在异常表达[4-7]。但是Bcl-9在乳腺癌中的表达情况、参与发病进程及其与临床预后的关系,目前尚不清楚。因此本研究以3种不同表型的人乳腺癌细胞株为研究对象,通过检测Bcl-9基因在人不同乳腺癌细胞株中的表达水平,筛选出高表达Bcl-9的细胞株,并对其进行基因敲除实验,通过对基因敲除目的细胞株的生物学行为侵袭、迁移能力的研究,进一步探讨Bcl-9在乳腺癌发生、发展过程中的作用机制。
1 材料与方法
1.1材料
1.1.1细胞系来源:人乳腺癌MDA-MB-231细胞株、MCF-7细胞株和MDA-MB-453细胞株均由白求恩国际和平医院肿瘤实验室馈赠,并在河北医科大学第四医院实验动物中心实验室培养、传代。
1.1.2实验仪器及试剂:蛋白垂直电泳仪及槽式湿式转膜器(伯乐Bio-Rad公司);实时荧光定量聚合酶链反应(RT-PCR)仪(Themo);RPMI 1640(美国Gibco公司);胎牛血清(Serapro公司);RNA提取及反转录试剂盒(Vazyme公司);蛋白提取试剂盒(北京普利莱公司);BCA蛋白定量试剂盒(北京索莱宝公司);兔抗人多克隆抗体Bcl-9抗体(ABclonal公司);慢病毒Bcl-9 shRNA质粒包装(上海吉满生物);Transwell细胞小室(Millipore,USA);Matrigel胶(大鼠ESH肉瘤细胞外基质提取物,BD公司)。
1.2细胞培养 人乳腺癌细胞株MDA-MB-231、MCF-7和MDA-MB-453均用含10% FBS的RPMI 1640培养基,于37℃、5% CO2恒温培养箱中培养。
1.3RT-PCR检测Bcl-9中mRNA的表达 使用RNA提取液提取细胞的总RNA,利用Vazyme试剂盒进行反转录,以适量反转录所得的cDNA为模板,采用荧光染料法进行实时荧光定量PCR检测Bcl-9 mRNA含量。BCL-9:上游引物:5'-ACTCCCGAGCAGATAGCG-3',下游引物:5'-AGGTGCCCAGCCTTCACT-3';GAPDH:上游引物:5'-ACCACAGTCCATGCCATCAC-3',下游引物:5'-TCCACCACCCTGTTGCTGTA-3'。将所得的Ct值转换为2-△△Ct方法计算该目的基因mRNA的相对表达量。△△Ct=目的基因Ct值-内参基因Ct值。
1.4蛋白免疫印迹法(Western blot)检测Bcl-9转录蛋白表达水平 采用普利莱蛋白提取试剂盒提取细胞总蛋白,并用BCA蛋白定量试剂盒进行总蛋白定量,SDS-PAGE电泳,PVDF膜转膜,5%脱脂奶粉摇床封闭1 h。加入兔抗人Bcl-9多克隆抗体(1∶1000)以及鼠抗人β-actin抗体(1∶5000),4℃过夜,二抗室温摇床孵育,化学发光检测。以β-actin作为内参蛋白。Image J软件对目的条带进行灰度分析,将目的蛋白与内参β-actin条带的灰度值比值作为目的蛋白的相对表达量。
1.5慢病毒质粒的构建及Bcl-9基因敲除实验 慢病毒shRNA质粒由上海吉满生物科技公司进行包装;将慢病毒转染MDA-MB-231,实验分为3组:A组为实验组(转染沉默Bcl-9的shRNA)、B组为阴性对照组(转染无义对照组)和C组为空白对照组(无转染试剂);转染前1 d对MDA-MB-231细胞常规消化,制备细胞悬液,进行反复细胞计数,铺24孔培养板,第2天对细胞进行慢病毒转染,每组各设3个复孔,12~24 h换新鲜培养液继续培养,24~48 h后于倒置荧光共聚焦显微镜下观察转染效率及转染前后细胞形态变化情况,并采用RT-PCR及Western blot法检测3组中Bcl-9基因的沉默情况。
1.6Transwell细胞小室实验 常规消化收集转染72 h后的3组细胞,制备细胞悬液(无胎牛血清),用细胞计数板进行反复细胞计数,在Transwell上室提前用Matrigel胶包被后于上室加入无胎牛血清细胞悬液100~200 μl,下室中加入含10% FBS(胎牛血清)1640细胞培养液500~600 μl,在37℃含5% CO2培养箱中培养12~48 h,取出细胞小室在无水甲醇中固定20 min,用含0.1%~0.2%的结晶紫染色15~20 min,在倒置显微镜下观察并拍照,分别取上、下、左、右和中5个高倍镜视野来计数,计算5个视野的平均穿膜细胞数。
1.7细胞划痕损伤实验 常规消化收集转染72 h后的3组细胞,制备细胞悬液(低胎牛血清),细胞计数板反复计数后铺6孔板,第2天使用10 μl无菌枪头垂直于细胞表面划线,无菌PBS小心冲洗划下的细胞2或3次,分别于0、12、24和48 h在倒置显微镜下观察划痕愈合情况并照相,用Image J软件测量划痕区域的像素,并定量分析细胞迁移的速度。采用细胞划痕愈合率来进一步比较细胞的迁移能力:细胞划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。

2 结果
2.1人乳腺癌细胞株中Bcl-9 mRNA及蛋白的表达水平 人乳腺癌细胞株MDA-MB-231、MCF-7和MDA-MB-453细胞中Bcl-9 mRNA表达水平分别为0.016±0.004、0.008±0.002和0.004±0.002,Bcl-9蛋白表达水平分别为0.629±0.101、0.397±0.196和0.204±0.990。MDA-MB-231 Bcl-9 mRNA和蛋白表达水平均高于MCF-7和MDA-MB-453,且MCF-7高于MDA-MB-453(P<0.05)。见图1。
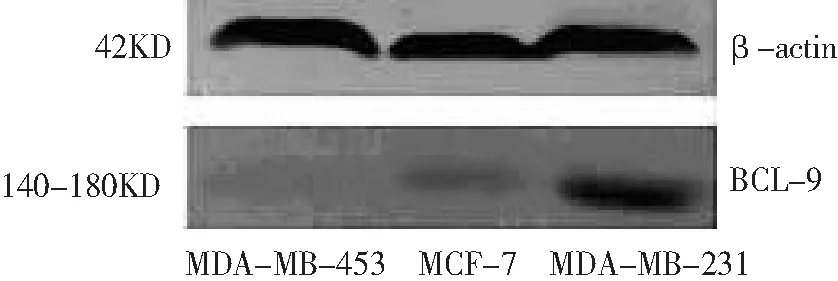
图1 3种乳腺癌细胞株中Bcl-9 mRNA和蛋白的表达情况
2.2慢病毒载体构建及Bcl-9基因敲除实验 空白对照组、阴性对照组、实验组Bcl-9 mRNA表达水平分别为0.022±0.001、0.018±0.000和0.008±0.002,Bcl-9蛋白表达水平分别为0.402±0.032、0.368±0.052和0.002±0.001。空白对照组和阴性对照组Bcl-9 mRNA和蛋白表达水平比较差异无统计学意义(P>0.05),实验组均低于空白对照组和阴性对照组(P<0.05)。见图2。

图2 3组乳腺癌细胞株Bcl-9蛋白表达表达情况
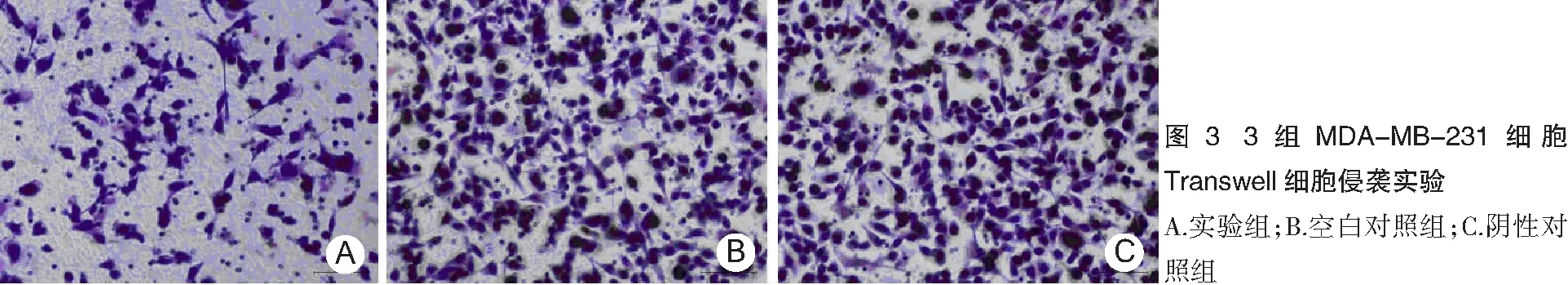
2.3体外细胞侵袭实验 实验组、阴性对照组和空白对照组MDA-MB-231穿膜细胞数分别为(151.50±7.580)、(417.00±5.310)和(420.50±3.704)个。实验组穿膜细胞数低于阴性对照组和空白对照组(P<0.05),阴性对照组和空白对照组比较差异无统计学意义(P>0.05)。见图3。
2.4细胞划痕损伤实验 实验组、空白对照组和阴性对照组细胞划痕损伤24 h后划痕愈合率分别为(0.382±0.012)%、(0.712±0.127)%和(0.709±0.015)%。实验组划痕愈合率低于空白对照组和阴性对照组(P<0.05)。倒置显微镜下细胞0 h与24 h细胞划痕愈合情况,见图4。

图4 3组MDA-MB-231细胞株细胞划痕实验
3 讨论
Wnt信号通路的失调与肿瘤发生的关系一直是近年来肿瘤研究的热点,这条通路包含有多种信号成员蛋白,Bcl-9作为Wnt信号通路中新发现的核内基因,其在多种Wnt信号通路失调中的异常表达表明其与肿瘤的发生、发展有密切关系。经典Wnt/β-catenin信号通路严格控制不同环境下的转录过程,对维持组织细胞内环境的稳态至关重要。该通路的异常激活可导致肿瘤等相关疾病的发生,其中心效应器是β-catenin[8]。经典Wnt/β-catenin信号通路是目前研究较多的Wnt信号通路之一,其在生物进化过程中呈高度保守,并且参与调控众多生命活动过程。Wnt/β-catenin信号通路的异常激活与细胞单克隆无限制恶性生长及癌变关系密切。Wnt信号使β-catenin在胞质中稳定并向核内集聚,与细胞核内TCF/LEF、Bcl-9/Bcl-9L和Py-gopus结合,形成TCF/LEF-β-catenin-Bcl-9-PYGO结构复合物,该复合物是激活Wnt信号通路下游相关靶基因表达的关键,这些靶基因包括CD44、VEGF、c-Myc、CyclinD1、MMP-7、FGF20、DKK1、WISP1、MYC、CCND1、GCC等[5,7,9]。
乳腺癌是一种严重危害女性身心健康甚至危及生命的最常见的恶性肿瘤之一[10-12]。而三阴性乳腺癌(triple-negtive breast cancer, TNBC)是雌激素受体(ER)、孕激素受体(PR)和人类表皮生长因子受体-2(Her-2)均无表达的乳腺癌亚型[13-15],其具有独特的生物学行为,侵袭性高,预后差,且目前尚无标准治疗方案,其发病机制及治疗成为研究的热点及难点[16]。Bcl-9信号蛋白在经典Wnt/β-catenin信号通路中的主要功能是作为衔接蛋白,在细胞核内起连接Aramdillo/β-catenin和Pygo蛋白的作用,Bcl-9同源结构域(HD)与PygoPHD指状结构、β-catenin前4个重复片段结合,形成TCF/LEF-β-catenin-Bcl-9-PYGO四聚体复合物;其次Bcl-9可促使与β-catenin结合的辅因子Pygo的作用并诱使β-catenin向细胞核内聚集并与之结合,从而进一步促进四聚体核复合物的形成,并激活经典Wnt信号通路,这在胚胎发育、干细胞生长及肿瘤形成过程中起着重要作用[8,17-21]。Bcl-9的同原产物Bcl-9-2除了作为β-catenin转录的辅助因子外,还可以影响β-catenin的细胞黏附和转录功能的发挥,这两种功能的正常维持有助于机体的正常发育,否则导致肿瘤生长、浸润及转移[4,22]。曾有文献报道Bcl-9-2可以调节ER的表达,从而改善他莫西芬对乳腺癌的治疗效果,并且Bcl-9高表达会促进乳腺癌的浸润和转移[23]。
本研究初步在人乳腺癌细胞株中探索降低Bcl-9表达水平对乳腺癌细胞的体外迁移和侵袭能力。首先采用RT-PCR及Western blot法分析3种不同表型人乳腺癌细胞株MDA-MB-231(ER-,PR-,Her-2-)、MCF-7(ER+,PR+,Her-2-)和MDA-MB-453(ER-,PR+,Her-2+)中,Bcl-9基因和蛋白表达水平筛选出表达水平较高的人乳腺癌MDA-MB-231细胞株,而MDA-MB-231细胞株也是TNBC体外的典型代表,Bcl-9表达与关系可能更为密切。继而针对Bcl-9基因设计shRNA慢病毒干扰序列,根据该序列合成干扰表达质粒pGPH-shBcl-9。采用RNA干扰的方法下调乳腺癌细胞株MDA-MB-231细胞中Bcl-9表达,利用细胞划痕实验和Transwell细胞侵袭实验进一步分析Bcl-9基因的下调对乳腺癌细胞迁移和侵袭能力的影响。本研究结果显示,MDA-MB-231细胞株Bcl-9 mRNA和蛋白表达水平均高于MCF-7和MDA-MB-453,且MCF-7高于MDA-MB-453,提示3种乳腺癌细胞株中Bcl-9蛋白表达水平与基因表达水平一致,MDA-MB-231细胞株Bcl-9表达最高。本研究中实验组Bcl-9 mRNA和蛋白表达水平均低于空白对照组和阴性对照组,MDA-MB-231穿膜细胞数低于阴性对照组和空白对照组,划痕愈合率低于空白对照组和阴性对照组。提示RNA干扰可使Bcl-9表达下调,而下调Bcl-9表达后可抑制细胞的迁移能力和侵袭能力。
综上所述,Bcl-9对乳腺癌细胞侵袭和迁移能力具有重要的影响,并且具有发展成为新型乳腺癌治疗靶位的潜力,本研究结果为乳腺癌寻找新的治疗靶点提供了有力的证据。
[参考文献]
[1] Tao Z, Shi A, Lu C,etal.Breast Cancer:Epdemiology and etiology[J].Cell Biochem Biophys, 2014,14(6):459-460.
[2] 张国旭,武晓丹,王秋,等.18 F-FDG PET/CT与血清肿瘤标志物在乳腺癌术后随访过程中相关性研究[J].创伤与急危重病医学,2017,5(6):378-381.
[3] 尚峰,阎英,徐莹,等.早期乳腺癌保乳术后应用记忆热塑网膜固定方式在螺旋断层放射治疗中摆位误差分析[J].创伤与急危重病医学,2017,5(5):284-287,291.
[4] El-Hage P, Petitalot A, Monsoro-Burq A H,etal. The Tumor-Suppressor WWOX and HDAC3 Inhibit the Transcriptional Activity of the beta-Catenin Coactivator Bcl-9-2 in Breast Cancer Cells[J].Mol Cancer Res, 2015,13(5):902-912.
[5] Mani M, Carrasco D E, Zhang Y,etal. Bcl-9 promotes tumor progression by conferring enhanced proliferative, metastatic, and angiogenic properties to cancer cells[J].Cancer Res, 2009,69(19):7577-7586.
[6] 何广宁,杨盛邦,陈雁如,等.B细胞淋巴因子9的表达与前列腺癌临床病理参数及患者生存的关系[J].中华医学杂志,2015,95(32):2603-2606.
[7] Mieszczanek J, de la Roche M, Bienz M. A role of pygopus as an anti- repressor in facilitating Wnt-dependent transcription[J].Proc Natl Acad Sci U S A, 2008,105(49):19324-19329.
[8] Katoh M, Katoh M. Wnt signaling pathway and stem cell signaling network[J].Clin Cancer Res, 2007,13(14):4042-4045.
[9] Adamo B, Anders C K. Stratifying triple-negative breast cancer: which definition(s) to use?[J].Breast Cancer Res, 2011,13(2):105.
[10] 郭志军,闫金银,张景华,等.异甘草酸镁防治乳腺癌化疗所致肝损伤的疗效观察[J].中国煤炭工业医学杂志,2016,18(8):1124-1127.
[11] 邹玉峰.局部晚期乳腺癌新辅助化疗的研究[J].中国当代医药,2016,23(32):65-67.
[12] 郑艳瑜,倪进斌,贾兴胜,等.脂肪溶解术在乳腺癌腋窝淋巴结清扫中的临床应用[J].中国综合临床,2016,32 (4):350-352.
[13] Tan G H, Taib N A, Choo W Y,etal. Clinical characteristics of triple-negative breast cancer: experience in an asian developing country[J].Asian Pac J Cancer Prev, 2009,10(3):395-398.
[14] Sampietro J, Dahlberg C L, Cho U S,etal. Crystal structure of a beta-catenin/BCL-9/TCF4 complex[J].Mol Cell, 2006,24(2):293-300.
[15] 孙民献,李梦圈.转移性三阴性乳腺癌的临床、病理特征和治疗方法与无瘤生存率的关系[J].中国综合临床,2016,32(6):541-544.
[16] 雷雨,马钰.雄激素受体在三阴性乳腺癌患者中的表达及其对临床结局的影响[J].中国综合临床,2016,32(5):440-443.
[17] Brembeck F H, Schwarz-Romond T, Bakkers J,etal. Essential role of BCL9-2 in the switch between beta-catenin's adhesive and transcriptional functions[J].Genes Dev, 2004,18(18):2225-2230.
[18] Kessler R, Hausmann G, Basler K. The PHD domain is required to link drosophila pygopus to legless/beta-catenin and not to histone H3[J].Mech Dev, 2009,126(8-9):752-759.
[19] Nakamura Y, Umehara T, Hamana H,etal. Crystal structure analysis of the phd domain of the transcription co-activator pygopus[J].J Mol Biol, 2007,370(1):80-92.
[20] Miller T C, Rutherford T J, Johnson C M,etal. Allosteric remodelling of the histone H3 binding pocket in the Pygo2 PHD finger triggered by its binding to the B9L/Bcl-9 co-factor[J].J Mol Biol, 2010,401(5):969-984.
[21] Harris T J, Peifer M. Decisions, decisions: beta-catenin chooses between adhesion and transcription[J].Trends Cell Biol, 2005,15(5):234-237.
[22] Zatula N, Wiese M, Bunzendahl J,etal. The Bcl-9-2 proto-oncogene governs estrogen receptor alpha expression in breast tumorigenesis[J].Oncotarget, 2014,5(16):6770-6787.
[23] Elsarraj H S, Hong Y, Valdez K E,etal. Expression profiling of in vivo ductal carcinoma in situ progression models identified B cell lymphoma-9 as a molecular driver of breast cancer invasion[J].Breast Cancer Res, 2015,17:128.

