妊娠期糖尿病治疗对其后代儿童期肥胖症的影响
钟成秋,万绪波
四川锦欣妇女儿童医院,四川 成都 610016
妊娠期糖尿病(GDM)是指妊娠期首次发现或发生的糖代谢异常[1],占孕妇总数的14%。随着人民生活水平的提高和产科医生对妊娠期糖尿病的重视,GDM的检出率越来越高,但GDM的发病机制尚不明确,经典观点认为,孕期胎盘生乳素、催乳素、肾上腺糖皮质激素及孕激素等拮抗胰岛素水平的升高及其造成的胰岛素拮抗状态是其发生的主要原因[2-4]。然而,妊娠期糖尿病对其后代究竟有怎样的影响,尤其是妊娠期糖尿病的治疗对其子代是否真正有益[5-7],这方面的证据仍不充分。为了研究妊娠期糖尿病的治疗对其后代尤其是儿童时期肥胖症发病的影响,本研究对妊娠期糖尿病孕妇后代进行了随访,以期为这一研究提供证据。
1 资料与方法
1.1 临床资料
本实验对2013年1月~2015年12月入院生产的所有出现妊娠期糖尿病的孕妇进行了研究并对其子代进行随访。所有列入研究对象的母亲和孩子均知情且整个随访过程已征得同意。
1.2 体质量指数(BMI)的测量
受过培训的护理人员对入院孕妇及随访后代的身高及体质量进行测量,随后计算其BMI。
1.3 血压的测量
被测量者(包括孕妇及儿童)应至少安静休息5 min,取坐位,最好坐靠背椅。被测者裸露上臂,肘部置于与心脏及血压计同一水平,使用大小合适的袖带,袖带气囊应至少包裹80%上臂;将袖带紧贴缚在被测者上臂,袖带下缘应置于肘弯上2.5 cm,将听诊器的探头置于肘窝肱动脉处。测量时快速充气,气囊内压力达到桡动脉搏动消失后再升高30 mmHg,然后以恒定的速率缓慢放气,在放气过程中仔细听取柯氏音,出现第一声柯氏音时记录舒张压的大小,听到最后一声柯氏音时即为收缩压。相隔2 min后重复测量,收缩压和舒张压分别取2次读数的平均值。
1.4 指标测定
取受试者的空腹血液样本,将其送到检验科化验,得出其中的空腹血糖值,空腹胰岛素值,甘油三酯含量和高密度脂蛋白的含量。
1.5 口服葡萄糖耐量试验(OGTT)
口服葡萄糖耐量试验是一种葡萄糖负荷试验,用以了解胰岛B细胞功能和机体对血糖的调节能力。OGTT应在无摄入任何热量8 h后,通常在清晨空腹进行,受试者口服溶于250~300 mL水内的无水葡萄糖粉75 g,且糖水应在5 min内饮完。从服糖第1口开始计时,于服糖后1、2、3 h分别前臂采血测其血糖。
除以上测量项目外,受访者的母亲进行了有关人口统计信息管理相关的问卷调查,包括母乳喂养史,儿童健康状况,饮食情况和运动情况等。对儿童而言,BMI>P95被定义为肥胖,BMI>P85定义为超重;空腹血糖值>126 mg/dL被认为患有糖尿病。对于5~9岁的儿童,其甘油三酯含量>100 mg/dL且HDL值<40 mg/dL被认为患有高血脂症。血压值>P95被认为患有高血压。另外,胰岛素抵抗HOMA-IR值的计算公式为:HOMA-IR=[空腹血糖值(mmol/L)×空腹胰岛素(U/mL)÷22.5]。
1.6 统计学分析
两组间的比较采用独立样本的Student-t检验,多组间的比较则应用单因素方差分析;不符合正态分布或方差不齐的数据则利用秩和检验;数据均运用SPSS 17.0软件进行整理、分析和统计,P<0.05为差异具有统计学意义。
2 结果
2.1 基本情况
本实验选取了两年内入院生产的137名患有妊娠期糖尿病的孕妇,其中72人接受了针对妊娠期糖尿病的治疗,65人未接受治疗。治疗组与未治疗组孕妇的基本情况之间的对比,生育年龄、BMI、空腹血糖值、口服葡萄糖耐量试验差异均无统计学意义(P>0.05,表1)。

表1 妊娠期糖尿病治疗组与未治疗组基本情况(Mean±SD)
2.2 后代追踪调查
本研究追踪调查了于2009年1月~2010年12月所有入院生产的患有妊娠期糖尿病的后代,年龄5~6岁,其中男孩75人,女孩62人。结果显示,治疗组与未治疗组男女出生的比例约为1:1,母乳喂养时间相似,两组后代在饮食和运动方面差异无统计学意义(P>0.05)。
总体而言,列入研究对象的所有儿童中,约有18.2%的儿童患有肥胖症,其中未见糖尿病患者。在主要的测量结果中,治疗组与未治疗组的后代差异没有统计学意义(P>0.05,表2)。子代BMI>P95的例数占总人数的百分比在治疗组与未治疗组之间差异无统计学意义(8.8%vs9.5%,P=0.79);其中,空腹血糖值和log HOMA-IR值在女性后代中的差异有统计学意义(P=0.002,0.02),治疗组女性后代的空腹血糖值和log HOMA-IR值相比于未治疗组更低,差异有统计学意义;治疗组的男女性后代之间脂质及血压水平相似;研究结果显示,在男性后代中,治疗与否并不会影响其空腹血糖水平和log HOMA-IR值(表3)。

表2 妊娠期糖尿病患者后代的追踪结果(Mean±SD)
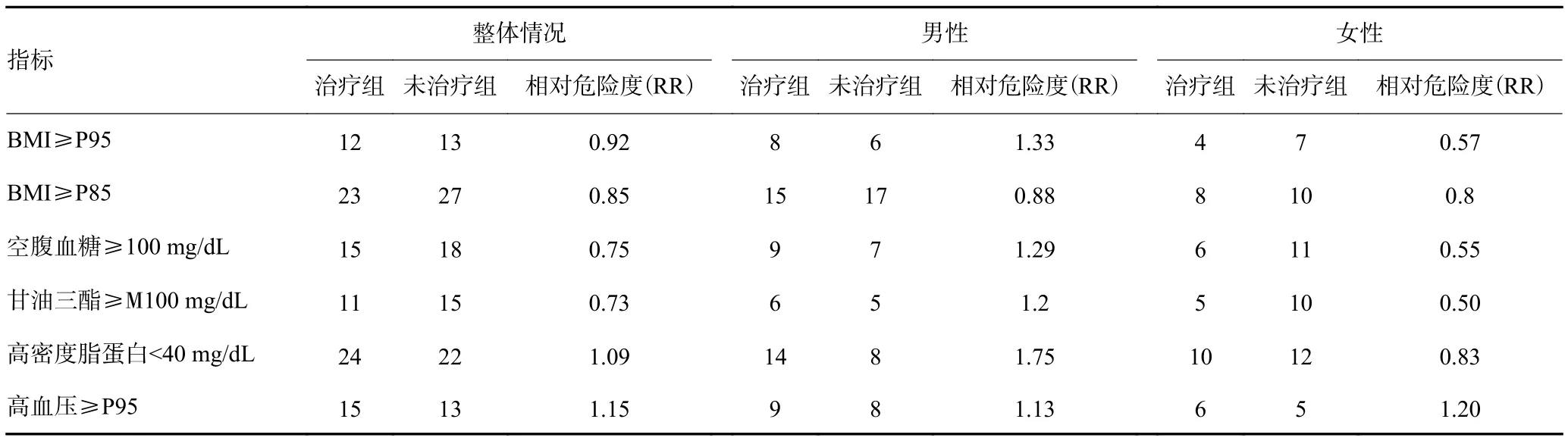
表3 妊娠期糖尿病患者后代的追踪统计结果(n)
3 讨论
GDM的发生一定程度上增加了肥胖人群的发生率[8-10],母体妊娠期的肥胖和糖尿病是导致后代肥胖和糖尿病的宫内独立危险因素[11-12]。以往的研究认为,妊娠期母体BMI、血糖状态和胎儿出生体质量是儿童肥胖的强相关预测因子[13-17],然而,大多集中在观察GDM母体和正常妊娠的母体与其后代肥胖的联系[18-20],本研究集中以GDM母体作为研究对象,观察糖尿病治疗组和未治疗组与其后代肥胖相关参数的联系,结果观察到在GDM治疗组与未治疗组的母亲的后代中,肥胖相关参数,BMI、血糖、血脂、高密度脂蛋白之间差异并无统计学意义。有研究对89个9岁儿童的追踪研究显示[21],治疗组与未治疗组儿童的糖耐量检测情况差异无统计学意义,但是治疗组BMI≥P85的例数相比于未治疗组减少。这与本研究观察结果是基本一致的。本研究结果还发现,GDM的治疗对后代血糖方面的作用与后代的性别相关--GDM的治疗可以降低女性后代的空腹血糖值,可以降低女性后代的log HOMA-IR值(用于评价个体的胰岛素抵抗水平的指标),但在男性后代这一作用并不明显。这提示导致男性与女性新生儿之间差异可能来自不同性别的代谢差异。GDM治疗组的男性后代的出生体质量和出生时体脂肪含量相比于女性后代更低;而女性后代对于母体血糖却相对更加敏感,从而导致女性后代的脂肪含量相比于男性更高[22]。另外,高血糖母亲的女性后代在其儿童时期出现皮褶厚度增加,胰岛素抵抗值增加的情况,这种变化会加剧其在成长过程发展成为肥胖的可能性。GDM治疗与后代肥胖在性别上的差异关联也有可能受到了性腺轴和激素的调节影响,从而导致了差异的出现。而这在以往的研究中尚未见报道,相关联系还需要进一步研究。
近期,有研究者认为对于妊娠期糖尿病的妇女与其后代健康之间的研究还应将一些其他的重要因素如遗传因素、社会因素、环境因素和母亲产前肥胖等因素考虑进去[23]。例如:母乳喂养可能会降低后代发生肥胖的可能性,同样的,运动和营养状况也会对其后代产生一定影响,但这种影响是不显著的[24]。本研究对治疗组和未治疗组后代相对危险度的统计结果显示,治疗组后代出现肥胖、超重、高血糖情况的发病率相比于未治疗组后代低。这一作用在女性后代中更明显,提示了临床上GDM血糖控制的重要性。
总之,本研究发现,在其后代中肥胖相关参数与性别密切相关这一点是十分有说服力的,GDM的治疗确实降低女性后代的空腹血糖值。然而,妊娠期糖尿病的治疗与其子代儿童期肥胖症的发病有关这一议题仍有待深入探讨,大样本的随机实验仍需开展,以期能够为GDM的治疗能够降低子代儿童其肥胖症的发生这一问题提供更多更有力的证据。
参考文献:
[1]张 娅,徐先明.妊娠期糖尿病病因学研究进展[J].中国实用妇科与产科杂志,2013,29(4): 299-302.
[2]Hillier TA,Pedula KL,Schmidt MM,et al.Childhood obesity and metabolic imprinting: the ongoing effects of maternal hyperglycemia[J].Diabetes Care,2007,30(9): 2287-92.
[3]Brawerman GM,Dolinsky VW.Therapies for gestational diabetes and their implications for maternal and offspring health:Evidence from human and animal studies[J].Pharmacol Res,2018,5(2): 11-6.
[4]Shepherd E,Gomersall JC,Tieu J,et al.Combined diet and exercise interventions for preventing gestational diabetes mellitus[J].Cochrane Database Syst Rev,2017,11(4): 443-7.
[5]Wisnieski L,Kerver J,Holzman C,et al.Breastfeeding and risk of metabolic syndrome in children and adolescents:a systematic review[J].J Hum Lact,2017,19(8): 38-47.
[6]Chu SY,Callaghan WM,Kim SY,et al.Maternal obesity and risk of gestational diabetes mellitus[J].Diabetes Care,2007,30(8):2070-6.
[7]Catalano PM,Farrell K,Thomas A,et al.Perinatal risk factors for childhood obesity and metabolic dysregulation[J].Am J Clin Nutr,2009,90(5): 1303-13.
[8]Sewell MF,Huston-Presley L,Super DM,et al.Increased neonatal fat mass,and not lean body mass is associated with maternal obesity[J].Am J Obstet Gynecol,2006,(195): 1100-3.
[9]Al-Hamad D,Raman V.Metabolic syndrome in children and adolescents[J].Transl Pediatr,2017,6(4): 397-407.
[10]Cunningham SA,Kramer MR,Narayan K.Incidence of childhood obesity in the United States[J].N Engl J Med,2014,370(5): 403-11.
[11]Pham MT,Brubaker K,Pruett K,et al.Risk of childhood obesity in the toddler offspring of mothers with gestational diabetes[J].Obstet Gynecol,2013,121(5): 976-82.
[12]Baptiste-Roberts K,Nicholson WK,Wang NY,et al.Gestational diabetes and subsequent growth patterns of offspring: the National Collaborative Perinatal Project[J].Matern Child Health J,2012,16(1): 125-32.
[13]Boney CM,Verma A,Tucker R,et al.Metabolic syndrome in childhood: association with birth weight,maternal obesity,and gestational diabetes mellitus[J].Pediatrics,2005,115(3): e290-6.
[14]Maryns AS,G.Maternal and neonatal outcomes in a treated versus non-treated cohort of women with gestational diabetes mellitus according to the HAPO 5 and 4 criteria[J].Facts Views Vis Obgyn,2017,9(3): 133-40.
[15]Mitanchez D,Jacqueminet S,Nizard J,et al.Effect of maternal obesity on birthweight and neonatal fat mass:A prospective clinical trial[J].PLoS One,2017,12(7): e0181307-12.
[16]Mitanchez D,Chavatte-Palmer P.Review shows that maternal obesity induces serious adverse neonatal effects and is associated with childhood obesity in their offspring[J].Acta Paediatr,2018,29(8): 142-9.
[17]Dugas C,Perron J,Kearney M,et al.Postnatal prevention of childhood obesity in offspring prenatally exposed to gestational diabetes mellitus: where are we now[J].Obes Facts,2017,10(4):396-406.
[18]Fraser A,Tilling K,Macdonald-Wallis C,et al.Association of maternal weight gain in pregnancy with offspring obesity and metabolic and vascular traits in childhood[J].Circulation,2010,121(23): 2557-64.
[19]Keely EJ,Malcolm JC,Hadjiyannakis S,et al.Prevalence of metabolic markers of insulin resistance in offspring of gestational diabetes pregnancies[J].Pediatr Diabetes,2008,9(1): 53-9.
[20]Thangaratinam S, Rogozinska E, Jolly K, et al. Effects of interventions in pregnancy on maternal weight and obstetric outcomes: meta-analysis of randomised evidence[J].BMJ,2012,344(11): e2088-95.
[21]Gillman MW,Oakey H,Baghurst PA,et al.Effect of treatment of gestational diabetes mellitus on obesity in the next Generation[J].Diabetes Care,2010,33(5): 964-8.
[22]Lingwood BE,Henry AM.Determinants of body fat in infants of women with gestational diabetes mellitus differ with fetal sex[J].Diabetes Care,2011,19(34): 2581-5.
[23]Kim SY,England JL,Sharma JA,et al.Gestational diabetes mellitus and risk of childhood overweight and obesity in offspring:a systematic review[J].Exp Diabetes Res,2011,21(10):541308-13.
[24]Crume TL,Ogden L,West NA,et al.Association of exposure to diabetes in utero with adiposity and fat distribution in a multiethnic population of youth: the Exploring Perinatal Outcomes among Children (EPOCH) Study[J].Diabetologia,2011,54(1): 87-92.