萝卜籽粕中黄酮的提取及纯化工艺研究
朱海霞 - 张小芳 - 高 洋 丁娅娜 -
(漯河食品职业学院,河南 漯河 462000)
萝卜籽又称莱菔子,是十字花科植物萝卜成熟种子的称法[1]。萝卜籽粕是生产萝卜籽油后所余的副产物。近些年的研究表明,萝卜籽中含有大量的硫苷、黄酮、甾醇等活性物质[2],这些物质的存在与萝卜籽具有很好的抗菌活性、解毒、降压、预防心血管疾病的作用有很大关系[3-5]。目前关于萝卜籽的研究多集中在油脂、多糖、蛋白等[6-8],关于其黄酮的研究尚无相关报道。
关于黄酮的提取方法有很多[9-11],热水提取法工艺成本低、对环境及人类无毒害,可应用于工业化大规模生产[12-13],而超声波辅助在分离提取黄酮类成分中已得到广泛应用[14-15]。本试验拟采用超声波辅助热水提取法对萝卜籽粕中的黄酮类化合物进行提取,在单因素试验的基础上,通过正交试验优化提取工艺,并对所提取的产物进行脱蛋白、脱多糖纯化,以期为萝卜籽中黄酮的提取及萝卜籽粕的利用提供理论依据。
1 材料与方法
1.1 材料及试剂
萝卜籽粕:武汉市蔬菜科学研究所生产萝卜籽油后所剩余的萝卜籽饼粕,经粉碎后备用;
98%芦丁标准品:博美生物科技有限责任公司;
氢氧化钠、无水乙醇:分析纯,西陇化工股份有限公司;
盐酸、九水硝酸铝、亚硝酸钠:分析纯,上海国药集团化学试剂有限公司;
无水三氯化铁:分析纯,上海展云化工有限公司;
氯仿:分析纯,鲁西化工集团股份有限公司;
蒽酮:分析纯,郑州冠辉化工产品有限公司;
浓硫酸:分析纯,山东淄博华赞化工有限公司;
无水葡萄糖:分析纯,河南云创化工产品有限公司。
1.2 主要仪器
台式高速冷冻离心机:TGL-20bR型,上海安亭科学仪器厂;
紫外分光光度计:752N型,上海精科仪电器厂;
旋转蒸发仪:RE5203型,上海沪析实业有限公司;
真空干燥箱:DF-6020型,上海一恒科学仪器有限公司;
多功能超声波提取仪:Biosafer-4000Q型,赛飞(中国)有限公司;
电子天平:FA1604型,上海天平仪器厂;
数显电热恒温水浴锅:HH600型,力辰科技有限公司。
1.3 试验方法
1.3.1 黄酮的测定
(1) 芦丁标准曲线的绘制:参照文献[9],芦丁曲线浓度梯度分别为:0.06,0.12,0.18,0.24,0.30,0.36,0.42,0.48,0.54,0.60 mg/mL。
(2) 提取液中黄酮含量的测定:按照亚硝酸钠-硝酸铝显色法提取完成后,取200 μL的提取液在510 nm下测定吸光度值,得回归方程y=3.875 3x+0.273 9,R2=0.999 6。
1.3.2 多糖的测定 按照硫酸-蒽酮法进行测定,以多糖浓度为横坐标,吸光度值为纵坐标做标准曲线。得回归方程y=10.079x+0.009 5,R2=0.999 0。
1.3.3 蛋白质的测定 采用考马斯亮蓝G-250染色法[16]。以蛋白质浓度为横坐标,吸光度值为纵坐标做标准曲线,得回归方程y=10.086x+0.007,R2=0.999 2。
1.3.4 超声波辅助提取萝卜籽粕中黄酮
(1) 超声功率:固定超声时间10 min、料液比1∶20 (g/mL),考察超声功率(100,200,300,500,700 W)对萝卜籽粕中黄酮提取效果的影响。
(2) 超声时间:固定超声功率500 W、料液比1∶20 (g/mL),考察超声时间(5,10,15,20,25 min)对萝卜籽粕中黄酮提取效果的影响。
(3) 料液比:固定超声功率500 W、超声时间10 min,考察料液比[1∶10,1∶20,1∶30,1∶40,1∶50 (g/mL)]对萝卜籽粕中黄酮提取效果的影响。
(4) 正交试验:以超声功率、超声时间、料液比为因素,通过正交试验筛选出最佳的提取工艺。
1.3.5 萝卜籽粕中黄酮脱多糖试验
(1) 乙醇溶液浓度:固定脱除时间4 h、黄酮和乙醇溶液的体积比1∶3,考察乙醇溶液浓度(50%,60%,70%,80%,90%)对萝卜籽黄酮中多糖脱除效果的影响。
(2) 脱除时间:固定乙醇溶液浓度80%、黄酮和乙醇溶液的体积比1∶3,考察脱除时间(0.5,1,2,3,4,5 h)对萝卜籽黄酮中多糖脱除效果的影响。
(3) 黄酮和乙醇溶液的体积比:固定乙醇溶液浓度80%、脱除时间4 h,考察黄酮和乙醇溶液的体积比(1∶1,1∶2,1∶3,1∶4,1∶5)对萝卜籽黄酮中多糖脱除效果的影响。
(4)正交试验:以乙醇浓度、黄酮-乙醇体积比、脱糖时间为因素,通过正交试验筛选出最佳的多糖去除工艺。所得的试验结果按照式(1)进行计算。
(1)
式中:
t——总得分;
p——多糖脱除率,%;
h——黄酮损失率,%。
1.3.6 萝卜籽粕中黄酮脱蛋白试验
(1) 脱除时间:固定氯仿-正丁醇体积比2∶1、Sevage溶液与黄酮体积比4∶1,考察脱除时间(10,20,30,40 min)对萝卜籽粕中黄酮脱蛋白效果的影响;
(2) 氯仿-正丁醇体积比:固定脱除时间30 min、Sevage溶液与黄酮体积比4∶1,考察氯仿-正丁醇体积比(2∶1,3∶1,4∶1,5∶1)对萝卜籽粕中黄酮脱蛋白效果的影响;
(3) Sevage溶液与黄酮体积比:固定脱除时间30 min、氯仿-正丁醇体积比2∶1,考察Sevage溶液与黄酮体积比(2∶1,3∶1,4∶1,5∶1)对萝卜籽粕中黄酮脱蛋白效果的影响。
(4)正交试验:以脱除时间、氯仿-正丁醇体积比、Sevage溶液与黄酮体积比为因素,通过正交试验筛选出脱除蛋白效果最佳的工艺条件。
2 结果与分析
2.1 萝卜籽粕中总黄酮含量
用精密电子天平称取萝卜籽粕1 g,用亚硝酸钠-硝酸铝显色法测得黄酮含量分别为:2.02%,2.11%,2.04%,黄酮总含量的平均值为2.06%。
2.2 超声波浸提对萝卜籽粕中黄酮提取的影响
2.2.1 超声波功率 由图1可知,随超声波功率的增加,萝卜籽粕中黄酮浸出率先增加后减少,在超声波功率500 W时浸出率较高。可能是由于超声波功率越高,固液传波速度越好,物料升温也越好,且对物料细胞破坏效果越好,有助于黄酮提出,当超声波功率增加到一定程度时,高超声波功率可能分解了萝卜籽粕中黄酮,使浸出率减少。综合分析,选择超声波功率为500 W。
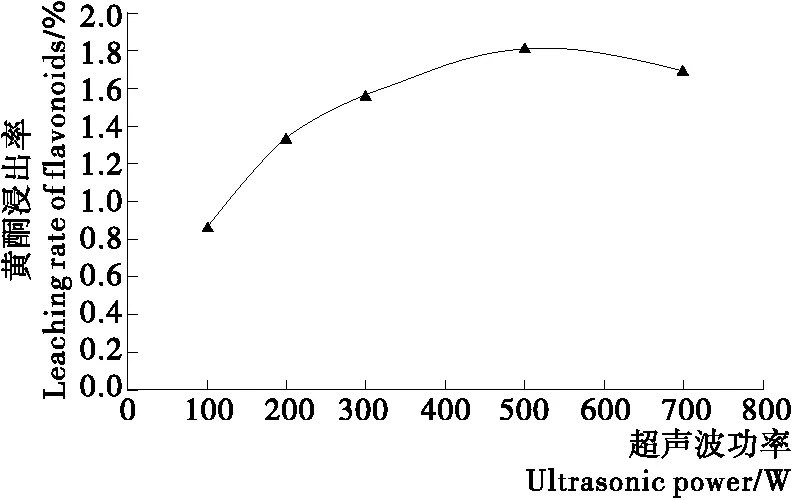
图1 超声波功率对黄酮浸出率的影响Figure 1 Effect of ultrasonic power on extraction rate of flavonoids
2.2.2 超声波浸提时间 由图2可知,随超声波处理时间的延长,萝卜籽粕中黄酮浸出比例逐渐升高,10 min后,浸出率降低。可能是超声波处理过久,温度过高,黄酮结构遭到破坏,所以黄酮的浸出率降低。综合分析,选择超声波浸提时间为10 min。
2.2.3 浸提料液比 由图3可知,随溶剂的增加,萝卜籽粕中黄酮浸出率先升后降,当料液比为1∶20 (g/mL)时,黄酮浸出率最高。因此,选择料液比为1∶20 (g/mL)。
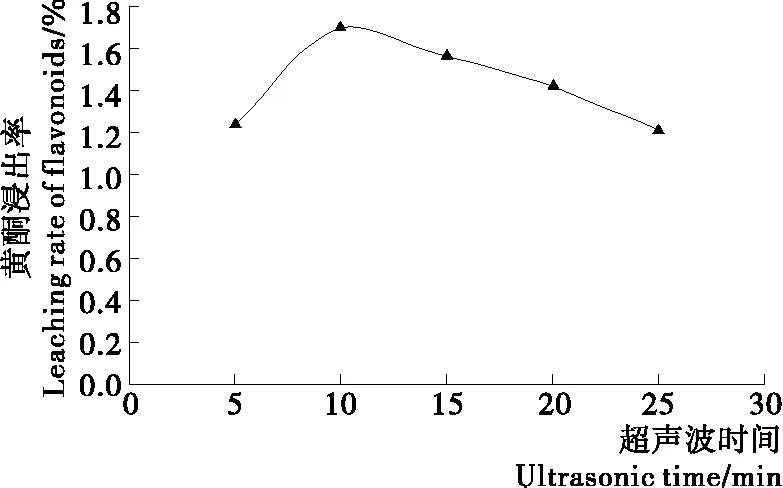
图2 超声波时间对黄酮浸出率的影响Figure 2 Effect of ultrasonic time on extraction rate of flavonoids
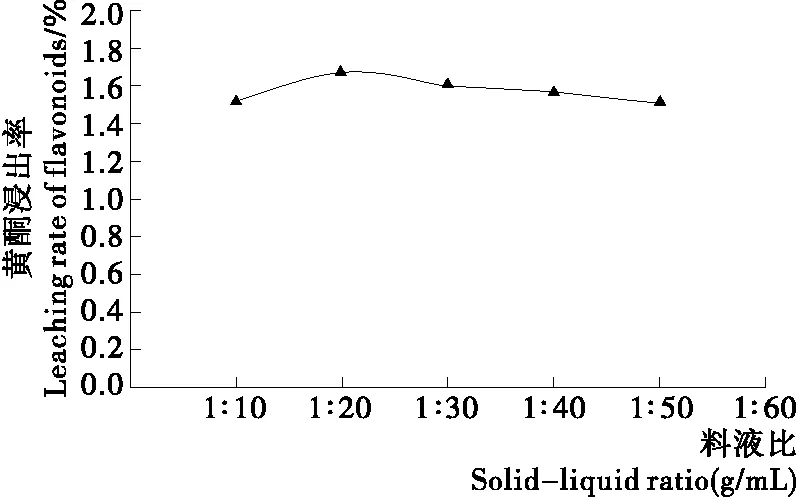
图3 料液比对黄酮浸出率的影响Figure 3 Effect of feed liquid ratio on the extraction rate of flavonoids
2.2.4 正交试验 以超声功率、超声时间、料液比为因素,采用三因素三水平L9(33)的正交试验。正交试验因素水平及结果见表1、2。
由表2可知,各因素对萝卜籽黄酮的浸出率影响顺序为超声功率>超声时间>料液比,最佳参数组合为A2B2C1,即超声波功率500 W,超声波时间10 min,料液比1∶15 (g/mL),该条件下测得萝卜籽黄酮的浸出率为1.90%,优于正交组合中的试验结果,说明此结果可作为优化后的提取条件。
通过上述试验进行比较,发现在温度,料液比相似的状况下,超声波辅助提纯速度要远远快于常规热水提纯,因此选用超声波辅助提纯能够极好地提高提纯效果。
2.3 萝卜籽粕中黄酮溶液脱多糖结果分析
通过单因素试验,得出用醇沉法除多糖最佳工艺参数为:乙醇浓度为85%,黄酮提取液-乙醇体积比为1∶3.5,提取时间为4 h,根据此三因素试验结果进行三因素三水平正交试验,因素水平及结果见表3、4。

表1 超声波提取萝卜籽粕中黄酮试验因素水平表Table 1 Ultrasonic extraction of flavonoids of semen Raphani orthogonal table
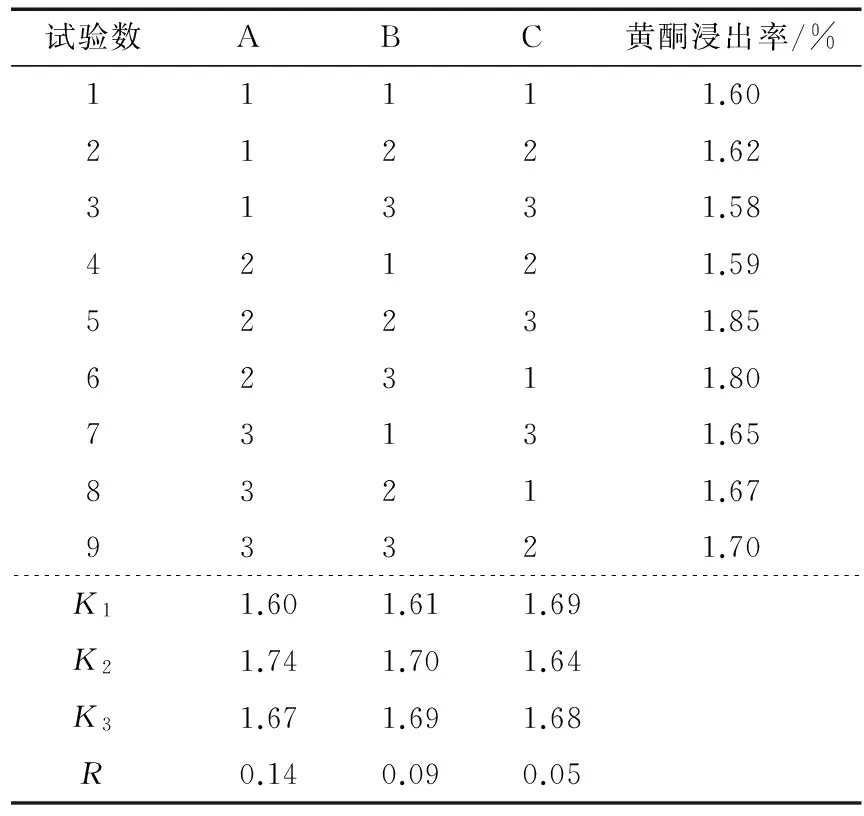
表2 超声波提取萝卜籽粕中黄酮正交试验结果Table 2 Ultrasonic extraction of flavonoids of semen Raphani orthogonal table
由表4可知,脱除时间对黄酮提取液脱多糖影响最大,其次是乙醇浓度,黄酮提取液-乙醇体积影响较小。萝卜籽黄酮提取液最佳的脱多糖条件是A3B3C2,即乙醇浓度85%,黄酮提取液-乙醇体积比1∶3.5,提取时间4 h,能脱去73.2% 的多糖,此时的黄酮损失率在34.86%。在正交试验表中脱除率较高,而黄酮的损失率较低,说明此条件是脱除萝卜籽粕中黄酮中多糖的适宜条件。
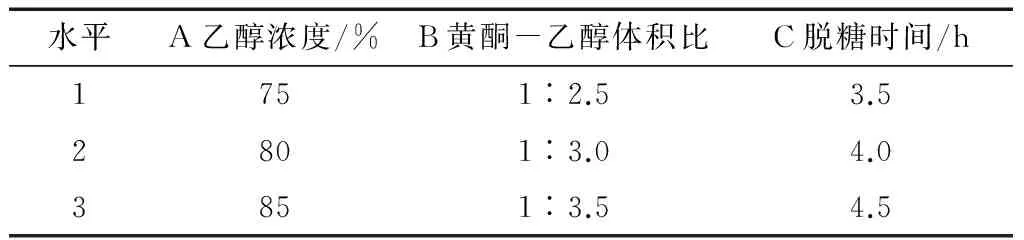
表3 萝卜籽粕中黄酮多糖脱除试验因素水平表Table 3 Flavonoids polysaccharides in semen Raphani removal orthogonal table
表4萝卜籽粕中黄酮中多糖脱除正交试验结果
Table 5 The removal of polysaccharides in semen Raphani flavone orthogonal experimental results
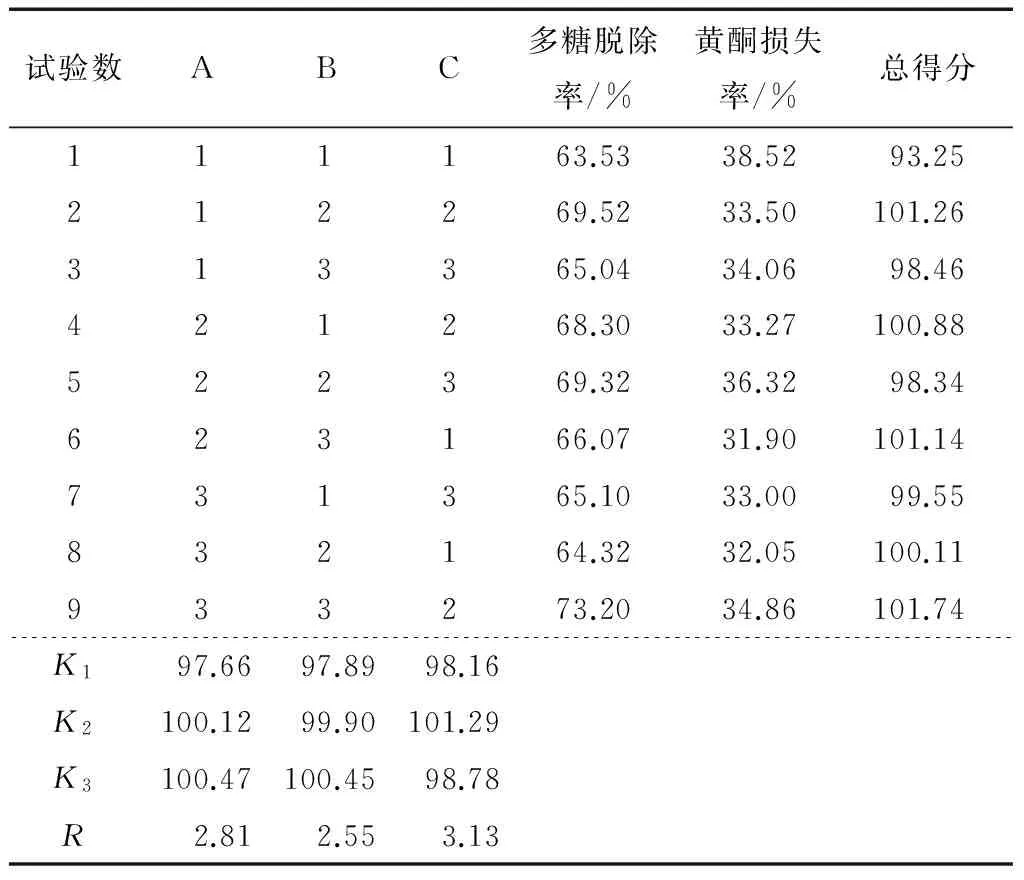
试验数ABC多糖脱除率/%黄酮损失率/%总得分111163.5338.5293.25212269.5233.50101.26313365.0434.0698.46421268.3033.27100.88522369.3236.3298.34623166.0731.90101.14731365.1033.0099.55832164.3232.05100.11933273.2034.86101.74K197.6697.8998.16K2100.1299.90101.29K3100.47100.4598.78R2.812.553.13
2.4 萝卜籽粕中黄酮脱蛋白结果分析
通过单因素试验,得出Sevage法脱除蛋白各因素最佳参数为:沉淀时间20 min,氯仿-正丁醇体积比为3∶1;Sevage溶液-黄酮体积比3∶1,根据此三因素试验结果进行三因素三水平正交试验。正交表试验因素水平及结果见表5、6。

表5 萝卜籽粕中黄酮蛋白质脱除试验因素水平表Table 5 The orthogonal table of protein removal in flavonoids of semen Raphani
表6萝卜籽粕中黄酮蛋白质脱除正交试验结果
Table 6 The experimental results of orthogonal protein removal in flavonoids of semen Raphani

试验数ABC蛋白质脱除率/%黄酮损失率/%总得分111165.1223.11109.45212268.0524.14109.89313367.0823.86109.68421270.2124.73110.38522371.3224.12111.54623170.0620.06114.97731375.3225.04112.62832169.5328.08106.69933273.2024.67111.93K1109.67110.82110.37K2112.30109.37110.73K3110.41112.19111.28R2.622.820.91
由表6可知,氯仿和正丁醇的体积比对结果影响最大;其次是脱蛋白时间,影响最小的是Sevage-黄酮体积比。萝卜籽粕中黄酮提取液最佳的脱蛋白条件是A2B3C1,即沉淀时间20 min,氯仿-正丁醇体积比3∶1;Sevage-黄酮体积比2.5∶1,此时蛋白质脱除率为70.06%,黄酮损失率为20.06%。在正交试验表中损失率最低,说明此条件为Sevage法脱除蛋白的最佳条件。
3 结论
本试验通过超声波辅助热水法提取萝卜籽粕中黄酮,并研究醇沉法、Sevage法分离纯化效果。结果表明,在超声波功率500 W、超声波时间10 min、料液比1∶15 (g/mL)的条件下提取黄酮,于乙醇浓度85%、黄酮提取液-乙醇体积比1∶3.5、提取时间4 h的条件下脱除多糖,再于沉淀时间20 min、氯仿-正丁醇体积比3∶1、Sevage-黄酮体积比2.5∶1的条件下脱蛋白时,萝卜籽粕黄酮的分离纯化效果最佳。后续可对不同的提取方式及纯化方式进行比较研究,而且有必要深挖黄酮类化合物的药学作用及其结构。
[1] 梁素娇. 莱菔子中总黄酮的提取与含量测定[J]. 世界中西医结合杂志, 2009, 4(7): 485-485.
[2] 宣伟. 黄酮类化合物的研究进展[J]. 中国林副特产, 2017(1): 66-69.
[3] 朱涵彬. 油用萝卜籽的开发研究[D]. 武汉: 武汉工业学院, 2012: 1-5.
[4] 马东. 中药莱菔子的化学成分及药理作用研究进展[J]. 中国社区医师, 2014(20): 5-6.
[5] 李媛. 不同品种莱菔子生药学研究[D]. 济南: 山东中医药大学, 2016: 8-10.
[6] 赵功玲, 梁新红, 郭延成, 等. 萝卜籽粕中蛋白质的提取及抗氧化活性研究[J]. 中国油脂, 2017(6): 102-105.
[7] 高文庚, 赵功玲. 萝卜籽油的提取工艺及其组分分析[J]. 食品科学, 2012(2): 159-163.
[8] 周政子. 萝卜籽中硫代葡萄糖苷的提取纯化及其降解产物的抑菌特性研究[D]. 杭州: 浙江工商大学, 2013: 3-5.
[9] 萨茹丽. 沙葱黄酮提取工艺优化、结构鉴定及其相关生物活性研究[D]. 呼和浩特: 内蒙古农业大学, 2014: 5-22.
[10] 王艳丽, 何煜波, 曹晓宁, 等. 辣椒叶中总黄酮提取工艺的优化[J]. 食品与机械, 2013, 29(3): 138-140.
[11] 白生文, 汤超, 田京, 等. 沙棘果渣总黄酮提取工艺及抗氧化活性分析[J]. 食品科学, 2015(10): 59-64.
[12] 朱文学, 焦昆鹏, 罗磊, 等. 绿豆皮黄酮的超声波辅助水提工艺优化及抗氧化活性[J]. 食品科学, 2015, 36(16): 12-17.
[13] 李小勇, 翟喜东, 杨志勇, 等. 不同方法提取国槐叶黄酮及其抗氧化活性研究[J]. 食品工业科技, 2014(17): 102-106.
[14] 曹清明, 邬靖宇, 钟海雁, 等. 油茶叶中黄酮的超声辅助提取及其抗氧化活性研究[J]. 食品与机械, 2015(3): 162-166.
[15] 吴德智, 郑强, 李安, 等. 缬草总黄酮超声辅助双水相提取工艺优化及抗氧化活性研究[J]. 食品与机械, 2017, 33(5): 162-167.
[16] 王艾平, 周丽明. 考马斯亮蓝法测定茶籽多糖中蛋白质含量条件的优化[J]. 河南农业科学, 2014, 43(3): 150-153.

