预存式自体输血联合同种异体自然杀伤细胞输注对胃癌手术后患者免疫功能的影响
李建武, 李灼非,戴 芳Δ
1.北京大学深圳医院 输血科(深圳 518036);2.北京大学深圳医院 胃肠外科(深圳 518036)
输血是手术患者重要的治疗手段之一,同种异体输血是临床上最常用的方式,但异体输血可能导致溶血、过敏和疾病传播等不良反应,临床报道一直较为谨慎。随着先进医疗技术的发展,自体输血已经发展成为一项重要的血液保护措施,其能避免输错血型导致的溶血和异体输血引起的疾病传播等,具有异体输血无法比拟的优点[1]。自然杀伤细胞(natural killer cell,NK)是淋巴细胞谱系中的一类大颗粒淋巴细胞,其不同于T、B淋巴细胞,无需抗原预先致敏即可发挥杀伤作用,是天然免疫系统的主要效应细胞,其能通过早期分泌多种细胞因子和趋化因子来调节获得性免疫,是机体抵御感染的第一道防线,也是连接天然免疫与获得性免疫的桥梁[2]。本研究以围手术期胃癌患者为研究对象,观察异体NK细胞与预存式自体输血NK细胞杀伤功能的不同,探讨对患者细胞免疫功能的影响,分析两种方法的联合治疗对肿瘤患者免疫功能的调控活性,为肿瘤患者术后采用该治疗方法提供理论依据。
1 资料与方法
1.1 临床资料
选取2013年4月至2015年4月于北京大学深圳医院进行治疗的胃癌患者为研究对象。纳入标准: 1)符合西医诊断[3];2)无内分泌及免疫性疾病,Hb>120 g/L,Hct> 0.35,无放疗、化疗和激素治疗史。排除标准: 1)失血量>600 mL;2)手术时间>4 h;3)应用血管活性药物后持续时间>10 min,术中血压超过基础值40%。共纳入符合标准的患者120例,其中男72例,女48例;年龄18~50岁,体质量46~85 kg。按照随机数字表法将120例患者分为对照组和观察组,各60例。对照组采用异体输血,观察组采用预存式自体输血联合同种异体NK细胞输注。本研究经医院伦理委员会批准,患者在术前均签署知情同意书,
1.2 方法
观察组:经患者同意并签订自体输血同意书后,于手术前1周内釆血400 mL,釆集后在血袋上标记清楚并置血库专用冰箱内保存,在手术中止血完毕后用以回输;同种异体NK细胞,委托深圳市北科生物公司(ISO9001质量管理体系认证;AABB认证)提取、纯化、培养、检测后100 mL(106/mL细胞)输注。对照组:采集亲属(子女、兄弟、姐妹)外周血,手术中止血完毕后回输;手术前配滤白悬浮红细胞400 mL,手术完毕后输入。
1.3 观察指标
1.3.1 体液免疫 检测治疗前后血清免疫球蛋白IgG、IgA、IgM水平采用速率散射比浊法,使用迈瑞生物医疗电子股份有限公司生产的BS-120全自动生化分析仪测定;补体C3、C4水平采用单向免疫扩散法测定,使用北京生物制品研究所生产的标准血清和上海翊圣生物科技有限公司生产的(货号:10208ES60)琼脂糖凝胶。
1.3.2 T细胞亚群(CD3+、CD4+、CD8+及CD4+/CD8+) 治疗前后采用贝克曼库尔特商贸(中国)有限公司CytoFLEX流式细胞仪法检测T细胞亚群,各检测1次。
1.3.3 酶联免疫吸附剂试剂盒测定 酶联免疫吸附剂试剂盒由深圳欣博生物科技有限公司提供,检测治疗前后血清白细胞介素-10(interleukin-10,IL-10)、白细胞介素-2(interleukin-2,IL-2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平。
1.4 统计学方法
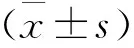
2 结果
2.1 两组治疗前IgG、IgA、IgM、C3及C4检测情况比较
治疗后观察组和对照组IgG、IgA、IgM、C3及C4异常例数较治疗前都有减少趋势,观察组比对照组减少趋势更明显,差异有统计学意义(P<0.05);治疗后两组血清C3和C4水平升高,IgG、IgA、IgM水平下降,差异均有统计学意义(P<0.05)(表1~2)。

表1 两组治疗前后IgG、IgA、IgM、C3及C4检测情况比较(例,n=60)
注:与治疗前比较,*P<0. 05;与对照组比较,#P<0.05
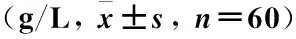
表2 两组治疗前后IgG、IgA、IgM、C3及C4水平比较
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.2 两组治疗前后CD3+、CD4+、CD8+、CD4+/CD8+检测情况比较
观察组治疗后CD3+、CD4+、CD8+及CD4+/CD8+细胞异常例数均较治疗前明显减少,差异有统计学意义(P<0.05);对照组治疗后CD3+、CD4+、CD8+及CD4+/CD8+细胞异常例数较治疗前明显减少,差异有统计学意义(P<0.05)(表3)。治疗后两组CD8+细胞水平均下降,CD3+、CD4+及CD4+/CD8+细胞水平均升高,差异有统计学意义(P<0.05)(表4)。
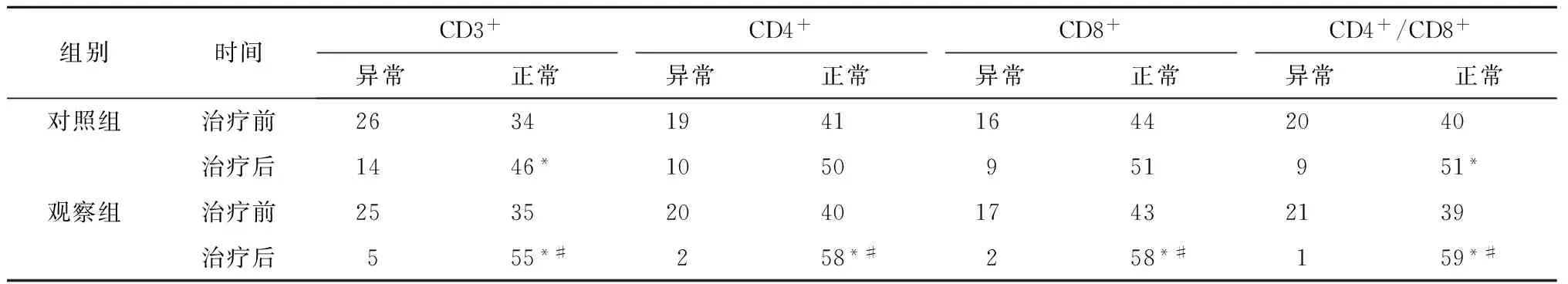
表3 两组治疗前后CD3+、CD4+、CD8+及CD4+/CD8+检测情况比较(例,n=60)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05

表4 两组治疗前后CD3+、CD4+、CD8+及CD4+/CD8+水平比较
注:与治疗前比较,*P<0. 05;与对照组比较,#P<0. 05
2.3 两组治疗前后血清IL-2、IL-10及TNF-α水平比较
两组治疗后血清TNF-α下降,IL-2、IL-10水平升高,差异均有统计学意义(P<0.05);观察组治疗后TNF-α水平低于对照组,IL-2、IL-10水平高于对照组,差异均有统计学意义(P<0.05)(表5)。


组别时间IL-2/(μg/L)IL-10/(pg/mL)TNF-α/(μg/L)对照组治疗前3.37±0.6432.52±7.782.24±0.38治疗后4.23±0.72*64.49±9.81*1.58±0.26*观察组治疗前3.32±0.6733.57±7.862.21±0.40治疗后4.85±0.75*#75.51±10.29*#1.20±0.27*#
注:与治疗前比较,*P<0.05,与对照组比较,#P<0.05
3 讨论
随着社会进入老龄化阶段及血液需求量日益增加,自体输血已成为一项重要的血液保护措施,预存式自体输血是在术前几天或几周前釆集自身的全血或者有效的血液,将成分保存到适当的环境下,当患者需要输血时再将保存的自体血进行回输以发挥治疗作用[4-5]。
NK细胞无需抗原预先致敏,是天然免疫系统的主要效应细胞,可发挥杀伤作用,是机体抵御感染的第一道防线,在机体免疫调节、造血调控、抗肿瘤和抗感染等方面发挥着重要作用,其又能分泌多种细胞因子和趋化因子来调节获得性免疫[6-7]。机体抗肿瘤免疫中细胞免疫是关键,细胞的数量及质量是宿主对肿瘤细胞免疫监控异常重要的指标[8]。本研究在前期研究基础上,观察预存式自体输血和增强其对同种异体NK细胞杀伤“自亡和它杀”相结合的方法。通过对患者治疗前后细胞免疫功能检测发现,两种方法联合治疗对肿瘤免疫功能具有调控活性,为肿瘤患者术后采用该方法治疗提供了理论依据,对肿瘤患者术后免疫调控具有重要意义。
免疫细胞的数量及质量是宿主对肿瘤细胞免疫监控异常重要的指标,在机体抗肿瘤免疫中细胞免疫是关键,手术抑制了机体免疫功能,肿瘤患者免疫状态低下,加之可能导致术后感染和肿瘤扩散,易造成多器官功能衰竭[9-11]。在免疫调节方面本研究结果显示,两组血清C3和C4水平升高,IgG、IgA、IgM水平下降;观察组IgG、IgA、IgM、C3及C4异常例数少于对照组;观察组C3和C4高于对照组,IgG水平低于对照组;观察组CD8+低于对照组,CD3+,CD4+及CD4+/CD8+水平高于对照组;两组TNF-α下降,观察组低于对照组;观察组CD3+、CD4+、CD8+及CD4+/CD8+异常例数均少于对照组;治疗后两组血清IL-2、IL-10水平升高,观察组高于对照组,差异有统计学意义(P<0.05)。
血液中血红细胞的ATP及2.3-DPG含量均高于库血,有较好的携氧功能,自体输血已经发展成为一项重要的血液保护措施,其能避免异体输血引起的艾滋病、肝炎的传播;输错血型导致的溶血危险[12-14];避免操作过程中配型及疾病检验出现的失误,同时可避免异体输血所致高钾、低钾血症及代谢性酸中毒[15-16]。NK细胞是天然免疫系统的主要效应细胞,即可发挥杀伤作用,无需抗原预先致敏,能通过早期分泌多种细胞因子和趋化因子来调节获得性免疫,是机体抵御感染的第一道防线,同时也是连接天然免疫与获得性免疫的桥梁,在机体造血调控、免疫调节、抗肿瘤和抗感染等方面发挥着重要作用。在自体输血的同时联合输注NK细胞可增强患者的免疫力,利于疾病的康复,抵抗术中、术后可能出现的感染风险[17]。
综上所述,预存式自体输血联合同种异体NK细胞输注能调节肿瘤手术患者体液免疫,还能调节炎性细胞因子水平,促进其平衡,调节T细胞亚群,有利于疾病的康复。
[1]石艳芬, 陈梅英, 苏文芳. 肿瘤患者外周血T淋巴细胞亚群和自然杀伤细胞数目的变化及其临床意义[J]. 检验医学与临床, 2012, 9(22): 2888-2889.
[2]耿长辉, 王锡山. 围手术期输血对恶性肿瘤患者的影响[J]. 国际外科学杂志, 2010, 37(10): 703-705.
[3]Elkord E, Alcantar-Orozco E M, Dovedi S J,etal. T regulatory cells in cancer: recent advances and therapeutic potential[J]. Expert Opin Biol Ther, 2010, 10(11): 1573-1586.
[4]Kalinski P, Edington H, Zeh H J,etal. Dendritic cells in cancer immunotherapy: vaccines or autologous transplants[J]. Immunol Res, 2011, 50(2/3): 235-247.
[5]冯利得. 外周血T细胞亚群检测在恶性肿瘤中的价值[J]. 当代医学, 2012, 18(3): 111-113.
[6]Bamett C C Jr, Beck A W, Holloway S E,etal. Intravenous delivery of the plasma fraction of stored packederythrocytes promotes pancreatic cancer growth in immunocompetent mice[J]. Cancer, 2010, 116(16): 3862-3874.
[7]屈常伟,骆喜宝,刘志贵, 等.预存式自体输血对结直肠癌患者围术期细胞免疫功能的影响[J].实用医学杂志,2013,29(18):2986-2988.
[8]Singbartl G. Preoperative autologous blood donation-part I. Only two clinical parameters determine efficacy of the autologous predeposit.[J]. Minerva Anestesiologica, 2007(3): 143-151.
[9]Frietsch T, Fessler H, Kirschfink M,etal. Immune response to autologous transfusion in healthy volunteers: WB versus packed RBCs and FFP[J]. Transfusion, 2001, 41(4): 470-476.
[10] 骆喜宝, 屈常伟, 刘志贵, 等. 控制性降压联合血液稀释及回收式自体输血在神经外科手术中的应用[J]. 广东医学, 2013, 34(17): 2672-2674.
[11] Samborska-Sablik A, Sablik Z, Gaszyński W,etal. Inflammatory cytokines and long-term prognosis after cardiac arrest[J]. Anestezjol Intens Ter, 2010, 42(2): 75-79.
[12] Damgaard S, Nielsen C H, Andersen L W,etal. Cell saver for on-pump coronary operations reduces systemic inflammatory markers: a randomized trial[J]. Ann Thorac Surg, 2010, 89(5): 1511-1517.
[13] Yanaba K, Yoshizaki A, Asano Y,etal. IL-10-Producing Regulatory B10 Cells Inhibit Intestinal Injury in a Mouse Model[J]. Am J Pathol,2011, 178(2): 735-743.
[14] 曹铭辉, 何慧燕, 纪凤涛. 术中自体血回输对脊柱手术炎性因子的影响[J]. 中华医院感染学, 2011, 12(17): 3571-3572.
[15] Bryceson Y T, Ljunggren H G. Natural killer cells: biology, physiology and medicine--part 1[J]. J Innate Immun, 2011, 3(3): 213-215.
[16] Campbell K S, Hasegawa J. Natural killer cell biology: an update and future directions[J]. J Allergy Clin Immunol, 2013, 132(3): 536-544.
[17] Moretta L, Locatelli F, Pende D,etal. Killer Ig-like receptor-mediated control of natural killer cell alloreactivity in haploidentical hematopoietic stem cell transplantation[J]. Blood, 2011, 117(3): 764-771.