木贼醇提物不同萃取部位总酚酸、黄酮含量测定及抗氧化活性研究
董 蕊,孙昌霞
(吉林农业大学中药材学院,吉林长春 130118)
传统中药木贼为木贼科植物木贼(EquisetumhiemaleL.)干燥地上部分,是现今唯一被载入《中国药典》[1]的木贼属植物。主产于东北、华北、内蒙古等地区[2]。迄今,木贼科植物有30多种,中国有9种,长白山地区产6种,分别为木贼(E.hiemaleL.)、问荆(E.arvense)、犬问荆(E.palustr)、草问荆(E.pratense)、节节草(E.ramosissimum)等[3]。主治风热目赤、目生云翳、月经过多、脱肛及肠风下血等症,是历史悠久的传统中药。
国内外学者对木贼属植物化学成分及药理作用已开展研究,现已分离出30余种黄酮类成分[4],检测出酚酸类、生物碱、酯类及无机物等[5]。杨波等[6]发现中药木贼(E.hiemaleL.)对中枢神经系统有治疗作用,可改善动脉粥样硬化[7],抗氧化[8]、抗衰老[9]、抗血拴、降血脂、降血糖[10]、利尿、抗菌抗病毒[11]等,该药还能有效抑制人宫颈癌Hela细胞[12],减少食饵性脂肪肝的发生[13-14]。付影超[15]探讨了同属植物节节草中总黄酮的抗氧化活性,发现其清除DPPH·能力随总黄酮含量增高而增强;刘胜利[16]研究木贼水煎液对老龄小鼠的抗氧化作用,发现该提取液具有清除小鼠体内自由基作用,能延缓衰老,但对其治病机理并没有深入追踪。
目前,《中国药典》记载的木贼的化学成分和药理作用研究得还不够深入,本文通过对木贼醇提取物采用有机溶剂萃取得到的不同萃取物进行自由基清除能力测试,探究其抗氧化活性,旨在深度开发木贼资源提供参考数据。
1 材料与方法
1.1 材料与仪器
木贼 于2016年10月采自吉林省长白山地区,经吉林农业大学郑毅男教授鉴定为木贼科植物木贼(EquisetumhyemaleL.)。自然阴干后粉碎,过80目筛,备用;无水乙醇、石油醚、乙酸乙酯、正丁醇、盐酸、硫酸亚铁、磷酸二氢钠、磷酸氢二钠、铁氰化钾、三氯乙酸、三氯化铁、双氧水、水杨酸、硫酸亚铁等 均为北京化工厂分析纯;芦丁、阿魏酸、抗坏血酸 上海金穗生物科技有限公司,纯度≥98%;2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS+·)、1,1-二苯基-2-三硝基苯肼(DPPH·)南京奥多福尼生物科技有限公司,纯度>98%;福林酚 上海金穗生物科技有限公司。
R1001旋转蒸发器 上海申生科技有限公司;HH-4 数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;T6紫外分光光度计 北京普析通用仪器有限公司;SPECTROstar Nano BMG LRBTECH;96孔板 Corning Incorporated;DHG-9140A 型电热恒温鼓风干燥箱 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 样品处理 取10 kg干粉,以料液比(1∶12)70%乙醇在400 W功率下超声40 min,提取温度40 ℃,提取3次[8,12],减压回收乙醇,冷冻干燥得总提物1.26 kg。取1 kg总提物,蒸馏水5 L溶解,以等体积石油醚萃取3次,取上层石油醚溶液共15 L,减压回收石油醚,得石油醚相(241 g);剩余下层水溶液水浴挥尽石油醚,以等体积乙酸乙酯萃取3次,取上层萃取液(15 L)减压回收乙酸乙酯,得乙酸乙酯相(31 g),相同操作得正丁醇相(200 g),剩余水层冷冻干燥得水相(517 g),干燥至恒重,备用。
1.2.2 总酚酸、总黄酮含量测定
1.2.2.1 总黄酮含量的测定 采用亚硝酸钠-硝酸铝显色法[17]测木贼不同萃取部位总黄酮含量。
芦丁标准曲线的绘制:精密称取干燥至恒重的芦丁标准品2.5 mg,95%乙醇配成0、0.02、0.04、0.06、0.08、0.10 mg/mL的标准溶液。分别取不同浓度标准品溶液1 mL于10 mL容量瓶中,加入质量分数5%亚硝酸钠溶液0.3 mL,混匀,室温下放置6 min,加入质量分数10%硝酸铝溶液0.3 mL,混匀,室温放置6 min,加4%氢氧化钠4 mL,加95%乙醇至刻度,混匀,室温静置15 min,以95% 乙醇作空白対照液,于510 nm 波长下测吸光度。以芦丁质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线,建立回归方程。
样品测定:取10.0 mg 木贼醇提物不同萃取部位样品,配置为1 mg/mL供试液,方法同1.2.2.1利用回归方程计算黄酮含量。
1.2.2.2 总酚酸含量测定 各萃取物中总酚酸含量的测定采用Folin-Ciocalteu法[18-21]并加以改进。
阿魏酸标准曲线的绘制:精密称取2.5 mg 阿魏酸标准品,配成0.02、0.04、0.06、0.08、0.10 mg/mL的标准品溶液。取3 mL标准品溶液,加入1 mL Folin-Ciocalteu 显色剂,混匀,加入0.5 mol/mL碳酸钠水溶液5 mL。蒸馏水定容至10 mL,混匀,室温避光1 h,于760 nm 波长处测吸光度。以阿魏酸质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线,建立回归方程。
取1.2.2.1项下供试液,按上述方法测木贼醇提物不同萃取部位样品吸光度值,通过回归方程得各样品总酚酸含量。
1.2.3 抗氧化活性测定
1.2.3.1 还原能力的测定 精密量取质量浓度为0、0.2、0.4、0.6、0.8、1.0 mg/mL抗坏血酸与不同萃取部位供试液各1 mL,依次加入pH6.6磷酸盐缓冲溶液2.5 mL,1%铁氰化钾2.5 mL,摇匀,50 ℃水浴20 min,加入10%三氯乙酸2.5 mL,混匀后4500 r/min离心10 min,取上清液5 mL,加入5 mL 蒸馏水,最后加入0.1%三氯化铁1 mL,静置10 min后于700 nm波长处测吸光度值。每个试样重复3次[22]。
1.2.3.2 对羟自由基(·OH)清除能力 精密量取1.2.3.1项下不同浓度抗坏血酸与不同萃取物供试液1 mL。通过Fenten反应[23]按下述步骤测定各供试液对羟自由基的清除能力:取6 mmol/L硫酸亚铁1 mL,6 mmol/L水杨酸1 mL,不同浓度的供试液1 mL,最后加8.8 mmol/L H2O21 mL启动反应,37 ℃反应30 min,以蒸馏水为参比,510 nm处测各浓度的吸光度。通过公式计算木贼醇提取物不同萃取部位·OH清除率:
清除率(%)=[A0-(Ai-Ai0)]/A0×100
式中:A0:以蒸馏水代替供试品的吸光度;Ai:加入供试品溶液后的吸光度;Ai0:不加显色剂(H2O2)供试品溶液的本底吸光度。
1.2.3.3 对DPPH自由基清除能力 精密量取1.2.3.1项下不同浓度抗坏血酸与木贼醇提物不同萃取部位供试液100 μL于96孔板中,加入100 μL DPPH·(浓度0.2 mmol/L)甲醇溶液,避光静置30 min,在517 nm处测其吸光度[24-25]。根据公式计算DPPH·自由基的清除率:
清除率(%)=[A0-(Ai-Ai0)]/A0×100
其中,A0:不加供试品DPPH·甲醇吸光度值;Ai:加入供试品与DPPH·甲醇吸光度值;Ai0:供试品的本底吸光度值。
1.2.3.4 对ABTS+自由基清除能力 按照参考文献[26-27]配置A液:精密称取0.0384 g ABTS蒸馏水定容于10 mL容量瓶中;B液:精密称取0.0134 g过硫酸钾蒸馏水定容到10 mL容量瓶中。将A液与B液1∶1混合,避光12~16 h得ABTS+·储备液,使用前加pH7.4 的PBS 液稀释至吸光度值0.7~0.8,备用。
精密量取1.2.3.1项下不同浓度抗坏血酸与木贼醇提物不同萃取部位供试液40 μL于96孔板中,加入稀释后的ABTS+·储备液160 μL,在734 nm波长处测定其吸光度值。取供试液溶剂40 μL与96孔板中,加入160 μL稀释后的ABTS+·储备液,测吸光度值,做空白对照。ABTS+自由基的清除率为:
清除率(%)=(1-A样品/A空白)×100
其中,A样品:供试品溶液与ABTS+·的吸光值度;A空白:供试品溶剂与ABTS+·的吸光度值。
1.3 统计分析
实验数据均平行测定3次,数据用平均值±标准差表示,采用SPSS软件里Duncan’s multiple range test 进行样本间差异显著性分析(p<0.05)。
2 结果与分析
2.1 芦丁、阿魏酸标准曲线的建立
图1所示,以浓度为横坐标,吸光度值为纵坐标绘制标准曲线,得芦丁回归方程:y=12.91x+0.0124,R2=0.9994。式中:y为芦丁吸光度,x为芦丁质量浓度(mg/mL);阿魏酸回归方程:y=23.876x+0.0087,R2=0.9991。式中:y为阿魏酸吸光度,x为阿魏酸质量浓度(mg/mL)。
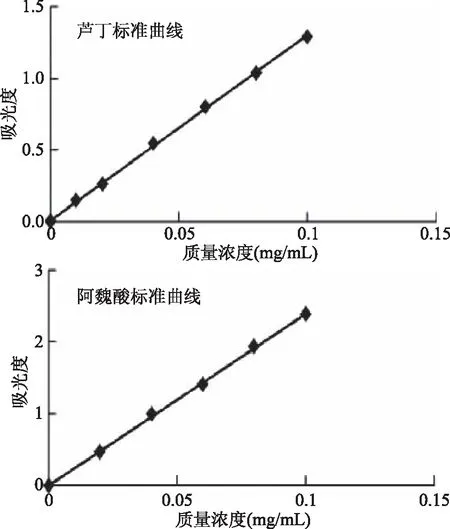
图1 芦丁、阿魏酸标准曲线图Fig.1 Rutin,ferulic acid standard curve
2.2 木贼乙醇提取物不同萃取部位总酚酸、总黄酮相对含量
木贼70%乙醇总提物及各部位萃取物中总黄酮及总酚酸相对含量差异很大(见图2),乙酸乙酯萃取部位总黄酮与总酚酸相对含量最高,分别为(61.55±0.11)、(19.10±0.23) mg/g;石油醚相总黄酮相对含量最小,仅为(5.70±0.19) mg/g,水相中总酚酸相对含量最小,为(4.07±0.94) mg/g,实验表明,乙酸乙酯从木贼乙醇提取物中富集的酚酸类和黄酮类成分含量最高,说明通过分步萃取,木贼醇提物中酚酸类和黄酮类成分得到初步分离纯化。
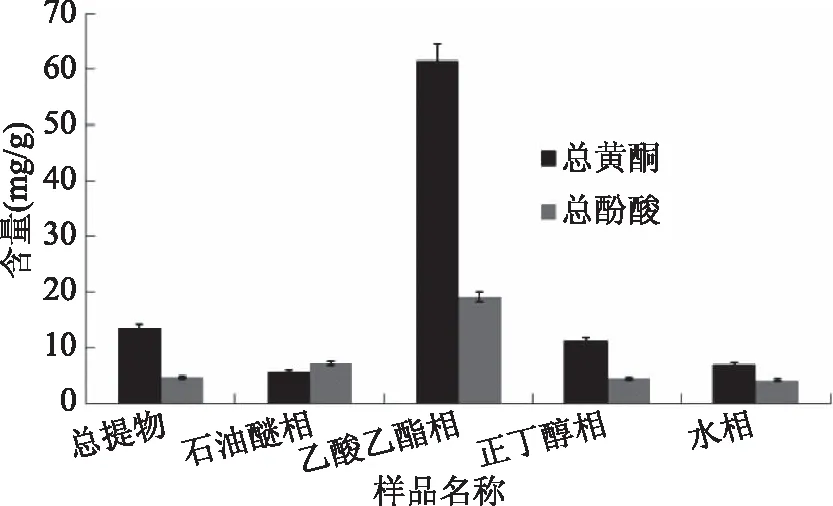
图2 木贼乙醇提取物不同萃取部位总黄酮、酚酸含量比较Fig.2 The total phenolic acid and flavonoid contents of the parts partitioned from the ethanol extraction from Equisetum hiemale L.
2.3 还原能力测定
由图3 可知,以抗坏血酸为阳性对照,木贼70%乙醇提取物及各部位萃取物均有不同程度的还原能力,且在实验浓度范围内呈量效关系,随着浓度的增加,还原能力呈上升趋势。各部位还原能力由强到弱依次为:乙酸乙酯相>总提物>石油醚相>正丁醇相>水相。由此可见,还原能力与总黄酮和酚酸有关,总提物的还原能力可能与较高含量的黄酮类成分有关,石油醚相还原能力可能是该部位含有较强还原能力的某种化学成分,可能与酚酸类成分有关。相同浓度下,乙酸乙酯相还原能力明显强于木贼醇提物中其他各相,当浓度达到1.0 mg/mL时,清除率最高,为0.8065。可以看出,还原能力强的活性成分集中分布在乙酸乙酯相,通过分段萃取可以获得还原能力强于总提物的有效部位。

图3 木贼乙醇提取物不同萃取部位还原能力(n=3)Fig.3 Reduction ability of different parts partitioned from the ethanol extraction from Equisetum hiemale L.(n=3)
2.4 对羟自由基(·OH)清除能力
由图4和表1可知,以抗坏血酸为阳性对照,木贼醇提物及各部位萃取物对羟自由基(·OH)均表现出不同程度的清除作用,且呈一定的量效关系,随样品浓度的增加,清除能力增强。在实验浓度范围内,不同萃取部位对羟自由基(·OH)的清除能力随浓度的变化存在差异,乙酸乙酯萃取部位对羟自由基(·OH)清除能力最强,IC50为(0.321±0.0026) mg/mL,总提物和正丁醇相对羟自由基(·OH)清除能力相当,IC50分别为(1.020±0.0134) mg/mL和(0.954±0.0067) mg/mL,石油醚相IC50为(1.704±0.0015) mg/mL,清除作用最弱。结合图2推测,羟自由基(·OH)清除能力可能与各部位总黄酮含量相关,乙酸乙酯相总黄酮远高于其他各相。质量浓度为1.0 mg/mL时,木贼乙酸乙酯相对羟自由基(·OH)的清除率为66.89%。高于总提物的54.37%,正丁醇相的50.92%,远高于水相的47.75%和石油醚相的37.04%。进一步表明木贼清除羟自由基(·OH)活性成分集中分布在乙酸乙酯相。通过萃取可获得活性较高抗氧化成分。
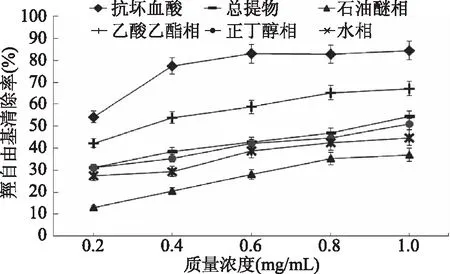
图4 木贼乙醇提取物不同萃取部位对羟自由基清除能力(n=3)Fig.4 The removing ratio to hydroxyl radical of different parts partitioned from the ethanol extraction from Equisetum hiemale L.(n=3)
2.5 对ABTS+·的清除能力
由图5和表1可知,在实验浓度范围内,木贼醇提物及各部位萃取物均有清除ABTS+·能力,且呈量效关系,清除能力随样品浓度增加而增大。木贼乙酸乙酯相对ABTS+·清除能力明显高于其它各相,IC50为(0.213±0.0010) mg/mL,其次为总提物,水相清除能力最弱,IC50为(4.171±0.1099) mg/mL。结合图2推测清除能力可能与各部位黄酮含量相关,分析石油醚相与水相对ABTS+·清除率变化发现,水相清除率变化较石油醚相缓慢,推测可能是石油醚相中含有对ABTS+·有清除能力的某种成分,可能由于此相中酚酸类成分有关。乙酸乙酯相对ABTS+·的清除率在浓度1.0 mg/mL时达到88.54%,表明通过分段萃取,可得到活性明显高于总提物的有效部位。
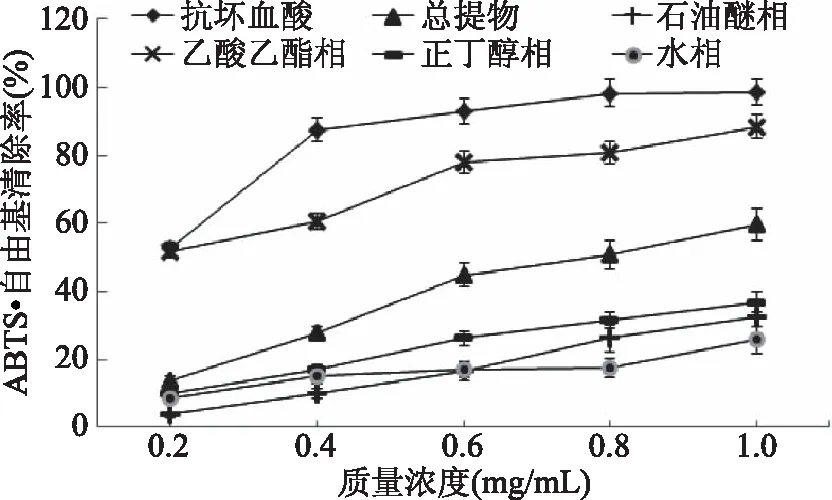
图5 木贼乙醇提取物不同萃取部位对ABTS+·清除能力(n=3)Fig.5 The removing ratio to ABTS of different parts partitioned from the ethanol extraction from Equisetum hiemale L.(n=3)
2.6 对DPPH·的清除能力
如图6及表1所示,以抗坏血酸为阳性对照,木贼醇提物及各部位萃取物对DPPH·均有清除作用,在实验浓度范围内清除能力随样品浓度增加而增大,呈一定的量效关系,不同极性部位对DPPH·的清除能力在相同浓度下存在差异。木贼乙酸乙酯相清除能力高于其余相,IC50为(0.169±0.0014) mg/mL,总提物与正丁醇相清除能力相对较弱,IC50分别为(0.352±0.0007) mg/mL和(0.460±0.0021) mg/mL,石油醚相清除能力最弱,IC50为(1.296±0.0064) mg/mL。结合图2推测木贼醇提物及各部位萃取物对DPPH·的清除能力与黄酮类成分含量相关。当浓度为1.0 mg/mL时,木贼乙酸乙酯相的清除率为91.52%,石油醚相为47.40%。

图6 木贼乙醇提取物不同萃取部位对DPPH·清除能力(n=3)Fig.6 The removing ratio to DPPH of different parts partitioned from the ethanol extraction from Equisetum hiemale L.(n=3)

表1 木贼乙醇提取物不同萃取部位对·OH自由基、 ABTS+·、DPPH·清除能力的比较Table 1 Comparison of the scavenging ability of ·OH radicals, ABTS+· and DPPH·of different parts partitioned from the ethanol extraction from Equisetum hiemale L.
2.7 木贼乙醇提取物不同萃取部位对·OH自由基、ABTS+·、DPPH·的半数清除率IC50
由表1中木贼乙醇提取物不同萃取部位对·OH自由基、ABTS+·、DPPH·的半数清除率IC50可知,抗氧化成分集中分布在了乙酸乙酯相。结合图2各萃取相中黄酮与酚酸相对含量可以看出,黄酮是木贼抗氧化主要有效成分,通过系统萃取法萃取,木贼有效成分得到了富集,实现初步的分离。
3 结论
对木贼70%乙醇提取物及各部位萃取物中总黄酮及酚酸相对含量进行测定及体外抗氧化活性分析,结果表明木贼各部位总黄酮相对含量在5.70~61.55 mg/g之间,总酚酸相对含量在4.07~19.10 mg/g之间,并且对·OH自由基、ABTS+·及DPPH·均有一定的清除能力。其中,以乙酸乙酯相的总黄酮及总酚酸相对含量最高,对·OH自由基、ABTS+·及DPPH·的抗氧化活性也最强,而在ABTS+·的清除实验中,石油醚相较水相有更强的清除能力,可能是该部位含有某种化学成分,对ABTS+·有一定的清除能力,以上结果提示黄酮可能是木贼主要抗氧化活性成分。酚酸可能有清除自由基作用,但抗氧化效果较黄酮差。
通过分段萃取,总提物中黄酮相对含量由13.45 mg/g提高到乙酸乙酯相萃取物中总黄酮的61.55 mg/g,总酚酸相对含量从总提物的4.67 mg/g提高到乙酸乙酯相的19.10 mg/g,实现了有效成分的富集。体外清除·OH自由基、ABTS+·及DPPH·的活性也由总提物的IC50分别为1.020、0.753、0.352 mg/mL降低到乙酸乙酯相的IC50分别为0.321、0.213、0.169 mg/mL。由此表明木贼抗氧化活性成分主要集中在乙酸乙酯相这种中等极性部位,因此,木贼乙酸乙酯萃取物可作为分离木贼抗氧化成分的重点研究部位,为进一步追踪木贼的药效物质基础及木贼资源的开发提供可参考数据。
[1]国家药典委员会.中华人民共和国药典版(一部)[M]. 北京:中国医药科技出版社,2015.
[2]朴惠顺,金光洙.木贼的化学成分和药理作用研究进展[J]. 时珍国医国药,2006(6):1077-1078.
[3]严仲恺,李万林.中国长白山药用植物彩色图志[M]. 北京:人民卫生出版社,1997.
[4]李淑惠,靳丹虹,李德坤,等.木贼科植物研究概况Ⅰ.化学成分研究[J]. 中草药,2000(7):92-94.
[5]周荣汉,于荣敏.木贼科植物化学成分研究概况[J]. 中药通报,1985(3):5-9.
[6]杨波,苑艳光,张良.木贼中镇痛成分的分离鉴定[J]. 佳木斯医学院学报,1997,20(6):82.
[7]甄艳军,牛丽颖,赵兰英,等.木贼提取物对早期AS大鼠血管平滑肌凋亡及Fas、FasL表达的干预[J]. 北京中医药大学学报,2007(1):45-47.
[8]易飞.木贼总黄酮的提取及活性研究[D]. 长春:吉林大学,2014.
[9]刘胜利,黄少花,潘喜英,等.木贼提取液对老龄小鼠抗氧化作用的影响[J]. 中国老年学杂志,2011,31(23):4620-4621.
[10]Revilla M C,Andrade Cetto A,Islas S,et al.Hypoglycemic effect of Equisetum myriochaetum aerial parts on type 2 diabetic patients[J]. J Ethnopharmacol,2002,81(1):117-20.
[11]Dos Santos Alves C F,Bonez P C,de Souza M E,et al.Antimicrobial,antitrypanosomal and antibiofilm activity ofEquisetumhyemale[J]. Microb Pathog,2016,101:119-125.
[12]张春梅.木贼乙酸乙酯提取物抗肿瘤活性成分研究[D]. 长春:延边大学,2012.
[13]姜秀娟,王旭辉,李奕,等.木贼正丁醇萃取物对高脂血症大鼠血管内皮黏附分子表达的影响[J]. 中国老年学杂志,2012,32(1):93-94.
[14]张凤梅.木贼提取物对大鼠AS早期损伤的影响[D]. 石家庄:河北医科大学,2006.
[15]付影超,严铭铭,黄耀玲,等.节节草总黄酮提取工艺优化及抗氧化活性研究[J]. 中华中医药杂志,2010,25(10):1580-1583.
[16]刘胜利,黄少花,潘喜英,等.木贼提取液对老龄小鼠抗氧化作用的影响[J]. 中国老年学杂志,2011,31(23):4620-4621.
[17]Sen S,Devanna N,Chakraborty R,et al.Total phenolic,total flavonoid content,and antioxidant capacity of the leaves ofMeynaspinosaRoxb.,an Indian medicinal plant[J]. Chin J Nat Med,2013,11(2):149-157.
[18]Vasquez C V,Rojas M G,Ramírez C A,et al.Total phenolic compounds in milk from different species. Design of an extraction technique for quantification using the Folin-Ciocalteu method[J].Food Chem,2015,176:480-486.
[19]Medina-Remón A,Barrionuevo-González A,Zamora-Ros R,et al.Rapid Folin-Ciocalteu method using microtiter 96-well plate cartridges for solid phase extraction to assess urinary total phenolic compounds,as a biomarker of total polyphenols intake[J]. Anal Chim Acta,2009,634(1):54-60.
[20]Karadirek,Kanmaz N,Balta Z,et al.Determination of total antioxidant capacity of humic acids using CUPRAC,Folin-Ciocalteu,noble metal nanoparticle-and solid-liquid extraction-based methods[J]. Talanta,2016,153:120-129.
[21]Hinojosa-Nogueira D,Muros J,Rufián-Henares JA,et al.New method to estimate total polyphenol excretion:Comparison of fast blue BB versus Folin-Ciocalteu performance in urine[J]. J Agric Food Chem,2017,65(20):4216-4222.
[22]Chen L Y,Cheng C W,Liang J Y.Effect of esterification condensation on the Folin-Ciocalteu method for the quantitative measurement of total phenols[J]. Food Chem,2015,170:10-15.
[23]Eom S J,Hwang J E,Jung J,et al.Short communication:Antioxidative and antibacterial activities on Staphylococcus aureus and Escherichia coli O157∶H4 in milk with added ginseng marc extract fermented by Lactobacillus plantarum KCCM 11613P[J]. J Dairy Sci,2017,100(10):7788-7792.
[25]Ullah F,Iqbal N,Ayaz M,et al.DPPH,ABTS free radical scavenging,antibacterial and phytochemical evaluation of crude methanolic extract and subsequent fractions of Chenopodium botrys aerial parts[1][J]. Pak J Pharm Sci,2017,30(3):761-766.
[26]Valent I,Topolská D,Valachová K,et al.Kinetics of ABTS derived radical cation scavenging by bucillamine,cysteine,and glutathione. Catalytic effect of Cu2+ions[J]. Biophys Chem,2016,212:9-16.
[27]Kalili KM,De Smet S,van Hoeylandt T,et al.Comprehensive two-dimensional liquid to the ABTS radical scavenging assay:a powerful method for the analysis of phenolic antioxidants[J]. Anal Bioanal Chem,2014,406(17):4233-4242.

