西安市耐异烟肼的结核杆菌耐药性及分子特征分析*
周爱萍,张敏,李文侠,张增贤,沙莎,董鸿智,胡群英
(1.西藏民族大学医学院高原环境与疾病相关基因研究高校重点实验室,陕西 咸阳712082;2.陕西省咸阳市肺科医院 检验科,陕西 咸阳 712046;3.陕西省西安市胸科医院 检验科,陕西 西安 710061)
结核病发病率在全球范围内一直居高不下,我国是全球22个结核病高负担国家之一,发病率居世界第2位。异烟肼作为消灭结核分枝杆菌作用最强的全杀菌药物,自1952年首次用于结核病的临床治疗以来一直是抗结核治疗的首选药物。近年来,结核分枝杆菌对异烟肼耐药情况日益严重,给结核病的防治工作带来巨大挑战。2012年一项研究中,中国结核分枝杆菌异烟肼耐药率为20.9%[1],高于全球水平11.5%。异烟肼耐药是结核菌多重耐药的基础,对异烟肼耐药菌株的分子特征与其传播之间的关系研究非常有意义。结核菌耐药性的产生主要是由染色体DNA发生突变引起。目前已发现结核分枝杆菌耐异烟肼的相关基因有katG、inhA、aphC、oxyR、mabA、kasA等基因,其中以katG和inhA基因的突变关系最为密切[2-3]。95%的异烟肼耐药与katG基因突变有关[4],其中最常见是KatG S315T突变,不同地区的异烟肼耐药临床菌株发生突变的相关基因及突变频率有差异[5]。
本研究拟对临床分离结核分枝杆菌进行药敏试验并采用定向缺失多重PCR(deletion-targeted multiplex PCR,DTM-PCR)方法对异烟肼耐药菌株进行的基因分型研究,分别利用多重等位基因特异PCR(multiplex allele-specific PCR,MAS-PCR)和PCR-DNA测序方法对其katG315和inhA-15突变热点进行检测。了解西安市异烟肼耐药临床分离菌株的分子特征。
1 材料与方法
1.1 材料
选取2011年1月-2011年12月西安结核病院住院患者的痰液标本117株,且确诊为结核分枝杆菌异烟肼耐药临床菌株。经BACTAC MGIT960分枝杆菌快速培养系统培养并经过菌种鉴定。标准菌株H37Rv由国家参比实验室提供作为对照株。2×Taq PCR Master Mix、Taq酶(购自北京天根生化科技有限公司),三磷酸脱氧核苷(购自美国Sigma公司),DNA ladder(购自加拿大MBI Fermentas公司),引物合成由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 药敏试验按照全自动快速分枝杆菌培养系统说明书进行操作,分别在MGIT960培养管中加入链霉素、异烟肼、利福平和乙胺丁醇,使其终浓度分别为1.0、0.1、1.0 及 5.0 μg/ml。
1.2.2 分枝杆菌基因组DNA提取收集经BACTAC MGIT 960分枝杆菌快速培养系统培养及鉴定的异烟肼耐药结核分枝杆菌临床菌株,首先对培养管80℃水浴3 h灭活以消除管中结核分枝杆菌的传染性。收集的菌体用水煮法提取结核分枝杆菌基因组DNA,具体步骤如下:200 μl TE缓冲液重悬菌体,100℃煮沸10 min,立即置于冰上5 min,12 000 r/min离心10 min,上清可直接用于PCR扩增。
1.2.3 MAS-PCR及PCR-DNA测序根据文献[6-7]针对katG315和inhA-15合成MAS-PCR引物(katG-F/katG315-R、inhA-15-F/inhA-15-R)及PCR-DNA测序引物(katG-F/katG-R、inhA-F/inhA-R)(见表1)。为确保MAS-PCR结果的准确性,各随机选择10株MAS-PCR结果不同的菌株扩增目的片段并进行测序。katG315位点MAS-PCR反应条件为94℃预变性5 min,95℃变性45 s,60℃退火45 s,72℃延伸30 s,共35个循环,最后72℃延伸7 min。PCR产物经1%琼脂糖凝胶电泳检测后,根据目的片段的有无,判断检测是否存在突变。PCR-DNA测序反应条件为:94℃预变性5 min,95℃变性45 s,58℃退火45 s,72℃延伸30 s,共30个循环,最后72℃延伸7 min。目的片段PCR扩增产物经电泳检测后,送上海美吉生物技术有限公司进行序列测定,并将测序结果与GeneBank进行比对。
1.2.4 DTM-PCR基因分型根据文献[6]合成3条用于DTM-PCR基因分型的引物(Beijng-P1,Beijing-P2,Beijing-P3)。H37Rv基因组DNA作为非北京型对照,PCR反应体系及条件参考文献[7]进行。PCR产物经1%琼脂糖凝胶电泳检测后,根据产物片段大小判断其是否为北京型菌株。

表1 引物序列
2 结果
2.1 药敏实验结果
117株异烟肼耐药菌株中,有73株为多重耐药(62.39%),其中对4种一线抗结核药物全部耐受有35株(29.91%),耐药结果(见表2)。MDR-TB(多耐药结核菌)同时耐受异烟肼和利福平的结核菌;PDRTB(多重耐药结核菌),MDR-TB以外至少耐受2种抗结核药物的结核菌(R:利福平;H:异烟肼;E:乙胺丁醇;S:链霉素)。
2.2 katG315和inhA-15位点突变
部分菌株MAS-PCR结果(见图1)。117株异烟肼耐药菌株中,81株(69.23%)存在katG315位点突变,10株(8.55%)存在inhA-15位点突变(其中3株检测到双位点突变)。在73株MDR-MTB菌株中,有49株存在katG315突变,5株存在inhA-15突变。MDR菌株中katG315突变菌株所占比例高于野生型菌株(67.12% vs 32.88%)。inhA-15突变菌株在MDR-MTB中的比例也高于其他耐药菌株(6.85% vs 4.54%)。
2.3 DTM-PCR基因分型结果
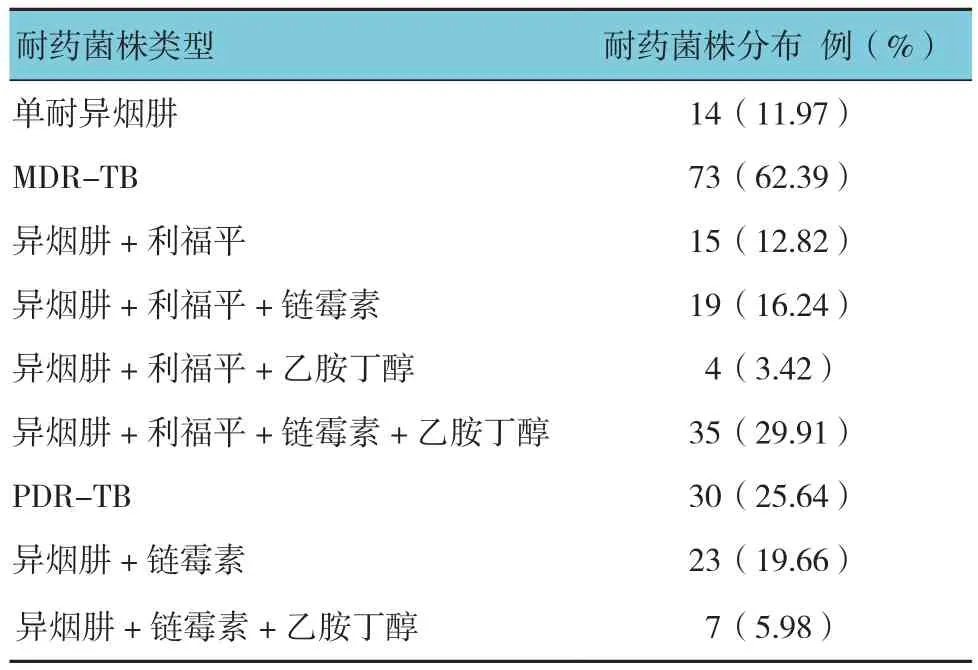
表2 异烟肼耐药菌株的药敏结果 (n =117)

图1 部分结核分枝杆菌katG315位点及inhA-15位点MAS-PCR结果
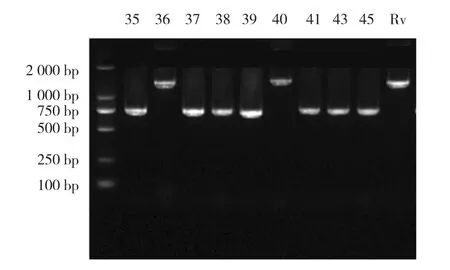
图2 部分结核分枝杆菌DTM-PCR结果
部分菌株DTM-PCR结果(见图2)。如其电泳条带为1 500 bp判断为非北京基因型菌株,电泳条带为786 bp判断为北京基因型菌株。117株异烟肼耐药菌株有104株为北京型(88.89%),13株为非北京型菌株。
3 讨论
作为一个全球公共卫生问题,结核病目前严重威胁着人类的健康。目前抗结核病一线药物有4种(异烟肼、利福平、链霉素及乙胺丁醇)。当前,全球结核病耐药形势异常严峻,多重耐药结核分枝杆菌(MDR-MTB,至少同时耐受异烟肼和利福平的结核杆菌)比例居高不下,结核菌耐药菌株的产生和播散使结核病的防治困难重重。本研究通过对来自西安市结核病院的117株异烟肼耐药临床菌株耐药性分析,发现目前西安市结核杆菌耐药形势的严峻性,应引起有关部门重视。
异烟肼是1912年首次合成的1种酰肼类化学药物,其抗菌作用非常强。但近年来结核分枝杆菌INH耐药性及耐多药性呈上升趋势。2014年世界卫生组织报告INH耐药情况在新发病例中占8.1%,在经治病例中占14.0%。我国INH耐药情况更是严重,根据2010年我国进行第5次全国结核病流行病学抽样调查结果显示,INH初始耐药率为28.2%,获得性耐药率为30.8%[7]。
结核菌耐药性产生主要是由染色体DNA发生突变引起。与异烟肼耐药关系最为密切基因突变位点为katG315位点。katG基因是过氧化氢酶-过氧化物酶的编码基因,315位点是katG与活性密切相关的位点,该位置发生突变可阻碍katG活性位点的甲基化,从而影响INH与katG结合,导致INH不能被活化,失去对结核杆菌的杀伤作用。该类型突变在耐受异烟肼结核杆菌中占50%~90%,并且与高浓度异烟肼耐受相关[8]。
研究表明,世界各地结核分枝杆菌katG315位点突变菌株流行与结核病流行相一致。与结核病低负担地区相比,结核病高负担地区katG315位点突变菌株更为流行。在我国不同地区间,该位点突变在异烟肼耐药菌株中所占比例差别较大。2013年研究发现,合肥地区其比例为42.6%[9],2010年中国东部农村一项研究中,异烟肼耐药菌株中,存在该位点突变的菌株为61.8%[10]。本研究117株异烟肼耐药菌株中,有81株(69.23%)存在katG315位点突变,与南非报道水平相当(64%),高于巴塞罗纳(55%)、新加坡(26%)及芬兰(7%)等地区,而低于俄罗斯西北部地区(93%)。西安地区异烟肼耐药临床菌株以katG315突变为主,提示该地区结核病疫情严重。
活化INH作用于细菌胞壁脂肪酸合成的靶位有多个,inhA蛋白是公认的原始靶位。有文献报道该基因及其启动子区域突变在异烟肼耐受的结核菌株中占21%~24%,并且inhA-15位置突变比inhA编码基因突变更为常见[11]。当inhA-15位点发生单个碱基置换后,其启动子活性增强,使inhA基因过度表达,从而削弱INH杀菌效能。该位点发生突变的菌株通常与低浓度耐药相关。本研究中117株异烟肼耐药菌株中,有10株存在inhA-15位点突变,低于有关文献报道的比例。
流行病学的研究方法能预测疾病暴发流行及其传播模式。以结核分枝杆菌基因型分型技术为基础的分子流行病学可研究结核菌株之间的遗传学关系,有助于探讨多种重要的流行病学问题。北京基因型菌株是结核分枝杆菌地域分布最为广泛的菌株,大约占世界各地菌株13%,东亚50%。也是中国临床MTB的优势菌株。有研究表明,北京型菌株与耐药性有一定相关性[12],并具有更强的毒力和传播性[13]。间隔区寡核苷酸分型法是鉴定北京基因型菌株的金标准,但该方法操作复杂、成本较高。本研究采用DTM-PCR法是高谦等人根据北京基因型菌株的特异分子标志RD105缺失区建立起来一种多重PCR反应,利用3条引物通过对RD105区检测,简单快速地鉴定北京型菌株[6]。本研究对117株异烟肼耐药临床菌株进行DTM-PCR分型,发现104株为北京型菌株。与中国其他地区一样,北京型菌株是目前西安市流行的优势菌株。
综上所述,发现北京型菌株是西安市异烟肼耐药临床菌株的主要基因型,其药敏特性以MDR为主,引起耐药的主要突变为katG315位点突变。鉴于目前西安市结核杆菌耐药形势的严峻性,强烈建议充分调动各方面力量,加大结核病防治工作力度,重视耐药菌株监测,加强用药合理性和全程性,及时遏制耐药菌株的流行和传播。
参 考 文 献:
[1] ZHAO Y, XU S, WANG L, et al. National survey of drug-resistant tuberculosis in China[J]. N Engl J Med, 2012, 366(23): 2161-2170.
[2] ZHANG Y, HEYM B, ALLEN B, et al. The catalase-peroxidase gene and isoniazid resistance of Mycobacterium tuberculosis[J].Nature, 1992, 358(6387): 591-593.
[3] BANERJEE A, DUBNAU E, QUEMARD A, et al. inhA, a gene encoding a target for isoniazid and ethionamide in mycobacterium tuberculosis[J]. Science, 1994, 263(5144): 227-230.
[4] HERRERA-LEON L, MOLINA T, SAIZ P, et al. New multiplex PCR for rapid detection of isoniazid-resistant mycobacterium tuberculosis clinical isolates[J]. Antimicrob Agents Chemother,2005, 49(1): 144-147.
[5] LEUNG E T, HO P L, YUEN K Y, et al. Molecular characterization of isoniazid resistance in mycobacterium tuberculosis:identification of a novel mutation in inhA[J]. Antimicrob Agents Chemother, 2006, 50(3): 1075-1078.
[6] CHEN J, TSOLAKI A G, SHEN X, et al. Deletion-targeted multiplex PCR (DTM-PCR) for identification of Beijing/W genotypes of mycobacterium tuberculosis[J]. Tuberculosis, 2007,87(5): 446-449.
[7] 王黎霞, 成诗明, 陈明亭, 等. 2010年全国第五次结核病流行病学抽样调查报告[J]. 中国防痨杂志, 2012, 34(8): 485-508.
[8] ZHANG M, YUE J, YANG Y P, et al. Detection of mutations associated with isoniazid resistance in Mycobacterium tuberculosis isolates from China[J]. J Clin Microbiol, 2005, 43(11): 5477-5482.
[9] 张文艳, 张洁莹, 柯文鸿, 等. 合肥地区异烟肼耐药结核分枝杆菌KatG基因突变的分子特征[J]. 现代预防医学, 2013, 40(6):1102-1104.
[10] HU Y, HOFFNER S, JIANG W, et al. Extensive transmission of isoniazid resistant M. tuberculosis and its association with increased multidrug-resistant TB in two rural counties of eastern China: A molecular epidemiological study[J]. BMC Infect Dis,2010, 10(1): 43-47.
[11] MUSSER J M, KAPUR V, WILLIAMS D L, et al.Characterization of the catalase-peroxidase gene (katG) and inhA locus in isoniazid-resistant and -susceptible strains of mycobacterium tuberculosis by automated DNA sequencing:restricted array of mutations associated with drug resistance[J]. J Infect Dis, 1996, 173(1): 196-202.
[12] 雷飏, 刘爱平, 侯僖硕, 等. 多重耐药结核临床分离株耐药性和北京基因型相关性分析[J]. 现代预防医学, 2013, 40(3): 528-530.
[13] WANG W, HU Y, MATHEMA B, et al. Recent transmission of W-Beijing family Mycobacterium tuberculosis in rural eastern China[J]. Int J Tuberc Lung Dis, 2012, 16(3): 306-311.

