SetDB1和β-catenin在结直肠癌中的表达及其意义
卢子剑,寇玉伶,郭庆喜,熊小明,孙兴旺
(西南医科大学附属医院病理科,四川泸州 646000)
结直肠癌是常见的发生于结肠部位的消化道恶性肿瘤,近10年来,全球结直肠癌发病率和死亡率水平基本稳定,但占全球恶性肿瘤发病、死亡的比例仍有所增加[1]。结直肠癌的发生、发展是多基因共同作用的结果,其中,组蛋白赖氨酸甲基化在基因的表达调控中发挥着重要的作用。有研究显示,组蛋白赖氨酸甲基化可以介导肿瘤的发生[2]。而大多数组蛋白甲基转移酶在组蛋白的甲基化中扮演了重要的角色,SetDB1(set domain bifurcated 1)是组蛋白甲基转移酶中重要的结构域之一。SetDB1又称为组蛋白H3赖氨酸9甲基转移酶,定位于1q21染色体上,基因长度为50 kbp。SetDB1与HP1(特异性异染色质蛋白)及CAF1(染色质组装因子)相关联形成复合物,HP1-CAF1-SetDB1复合物可以导致K9在H3上发生单甲基化,进而促进H3K9me3的形成,介导肿瘤的发生[3]。国外研究显示,SetDB1在前列腺癌、乳腺癌、黑色素瘤、肝癌、肺癌的发生发展中均扮演重要的角色[4-9]。
另有研究表明[10],结直肠癌细胞的增殖、分化、侵袭、转移等生物学行为依赖多种信号通路转导,如TGF-β、Wnt信号通路等。其中Wnt信号通路备受关注。Wnt信号通路普遍存在于各种动物体内,在胚胎的发育、细胞增殖与分化等过程中有着重要作用,值得注意的是,Wnt/β-catenin通路的激活在结直肠癌的发生发展中也起到了重要的作用[11]。国外研究发现,在非小细胞肺癌中,SetDB1可以通过调控Wnt信号通路中的关键因子APOE、IGFBP4、FZD1、LRP8,从而影响β-catenin在胞浆的聚集和入核,进而加速肿瘤的发生[8]。但是在结直肠癌中SetDB1是否能通过调控β-catenin从而影响肿瘤的发生却鲜有文献报道。因此,本文通过免疫组织化学的方式,检测SetDB1、β-catenin在结直肠癌中的表达并探讨其临床病理特征,以期了解它们在结直肠癌的发生、发展中的可能作用机制。
1 材料与方法
1.1 标本来源
收集西南医科大学附属医院2013年6月至2014年6月期间,接受手术治疗的原发性结直肠癌患者肿瘤组织标本及距肿瘤边缘>5 cm处的正常肠黏膜组织标本各70例,其中男性32例,女性38例,年龄39~76岁,平均年龄60.6岁。其中淋巴结转移阳性31例,阴性39例;本次标本肿瘤组织类型为腺癌,分化程度按高、中、低分组,分别为23、39、8例;肿瘤组织最长径<5 cm有39例,最长径≥5 cm有31例。所有的结直肠癌患者术前均未做过术前放化疗及其他抗肿瘤治疗等。患者均知情同意,符合医学伦理学相关规定。
1.2 主要试剂
SetDB1鼠抗人抗体及β-catenin兔抗人抗体分别购自Abcam及Cell Signaling公司;EDTA抗原修复液、DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 免疫组化染色
所有标本做常规脱水、透明、石蜡包埋,6 μm厚连续切片,采用EnVision免疫组化染色方法进行SetDB1、β-catenin染色:将石蜡组织切片后置于60℃恒温烤箱烤片3 h,浸于二甲苯脱蜡、酒精浓度梯度脱水,PBS缓冲液洗涤3次,每次5 min;于枸椽酸盐缓冲液(pH 6.0)中高压修复3 min,冷却至室温后,用蒸馏水冲洗2 min;滴加3%的过氧化物酶阻断剂,消除内源性过氧化物酶的活性,避光孵育15 min;蒸馏水冲洗,PBS洗涤3次,各5 min;滴加一抗SetDB1(1∶300)、β-catenin(1∶500),27 ℃孵育60 min;PBS冲洗切片3次,每次3 min;滴加二抗,27℃孵育30 min;用PBS冲洗切片3次,每次3 min;滴加预先准备好的显色剂DAB工作液,显微镜下控制显色,显色完全后,用自来水冲洗,终止显色;流水冲洗5 min;苏木精复染2 min、0.1%稀盐酸分化、饱和碳酸锂反蓝、脱水、透明、封片。
1.4 结果判读
由两位本院主治级别以上病理科医生各自独立进行盲审,采用半定量方法来评定染色情况。Set⁃DB1表达阳性的结果根据阳性细胞比例及着色深度计分,着色深度评分标准按细胞着色评分:无着色0分;淡棕黄色1分;棕黄色2分;棕褐色3分。阳性细胞比例评分标准:无着色为0分;同一显微镜视野下计算阳性细胞数,按其占肿瘤细胞的比例<30%为1分,30%~70%为2分,>70%为3分。根据上述两项指标的分数相加分为4个等级:0分,阴性(-);1~2分,弱阳性(+);3~ 4分,阳性(++);5 ~ 6分,强阳性(+++)。我们将“-/+”定义为蛋白低表达,“++/+++”,定义为蛋白高表达。
β-catenin染色结果判读标准按照Maruyama等[12]的方法:细胞膜阳性表达细胞率>70%为正常表达,胞浆或胞核阳性表达细胞率>10%为阳性表达。
1.5 统计学处理
使用SPSS 17.0统计学的软件进行分析。计数资料用χ2检验,相关分析采用Pearson相关,P<0.05为差异有统计学意义。
2 结果
2.1 SetDB1蛋白在结直肠癌中的表达
SetDB1蛋白阳性信号为棕黄色颗粒,主要定位于细胞核(图1),成颗粒或者团状分布,偶可见细胞膜和细胞质也有染色。结果显示,结直肠癌组织中SetDB1蛋白阳性表达率97.14%,明显高于癌旁正常组织SetDB1蛋白阳性表达率30%(χ2=68.13,P <0.05),见表1。
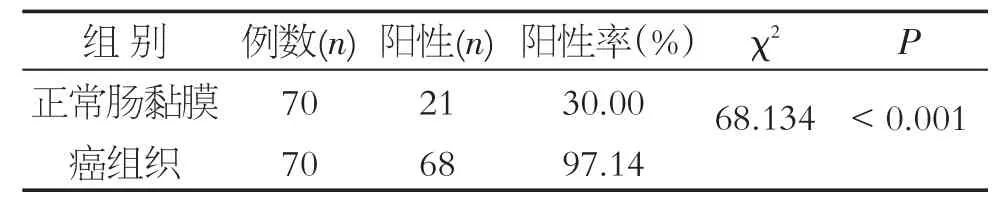
表1 结直肠癌组织及癌旁正常黏膜中SetDB1的表达情况
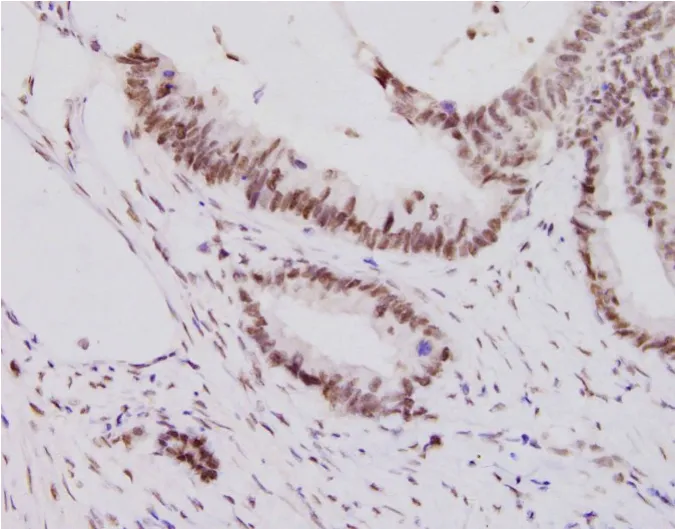
图1 SetDB1蛋白阳性表达(EnVision法染色,×400)
2.2 癌组织中SetDB1蛋白表达与临床病理特性的关系
2.2.1 癌组织分化程度
癌组织全为腺癌,分化程度按照高、中、低分化三个等级进行分组,SetDB1蛋白在癌组织高分化组的表达率为65.21%,中分化组为89.74%,低分化组为50.00%,其中高、中分化组之间及中、低分化组之间的差异有统计学意义(χ2=8.710,P < 0.05),见表2。结果提示SetDB1可能参与肿瘤组织的分化类型。

表2 癌组织中SetDB1的表达与分化程度的关系
2.2.2 淋巴结转移
所有手术切除癌组织标本肠周淋巴结均仔细清理、寻找,淋巴结总数不少于15枚。结果显示,在31例发生淋巴结转移的患者中,SetDB1高表达率为80.64%,而在39例未发生淋巴结转移的患者中,Set⁃DB1的高表达率为74.36%,差异无统计学意义(χ2=0.387,P>0.05)。这表明SetDB1的表达可能与淋巴结转移无关。
2.2.3 其他临床病理特征
SetDB1的表达与肿瘤组织的浸润深度、肿瘤大小、患者年龄和性别均无关(P>0.05),见表3。
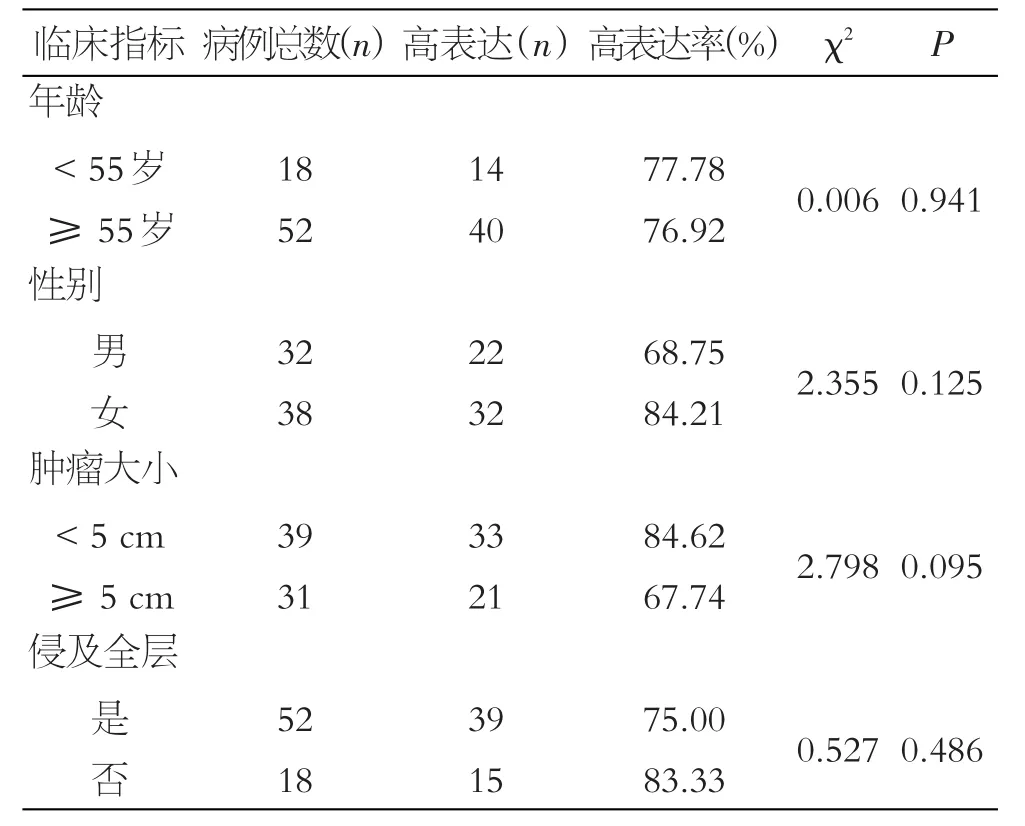
表3 癌组织中SetDB1的表达与临床指标的关系
2.3 β-catenin在结直肠癌中的表达情况
β-catenin蛋白阳性信号仍为棕黄色颗粒,在正常情况下,β-catenin定位于细胞膜;如果Wnt通路被激活从而导致β-catenin发生阳性表达,则β-catenin蛋白信号将阳性表达于细胞浆和细胞核(图2)。β-catenin在结直肠癌组织和正常肠黏膜组织中的浆核阳性表达率分别为84.28%、47.14%,结直肠癌组织的β-catenin阳性表达率明显高于癌旁组织,差异具有统计学意义(χ2=21.431,P < 0.001),见表4。
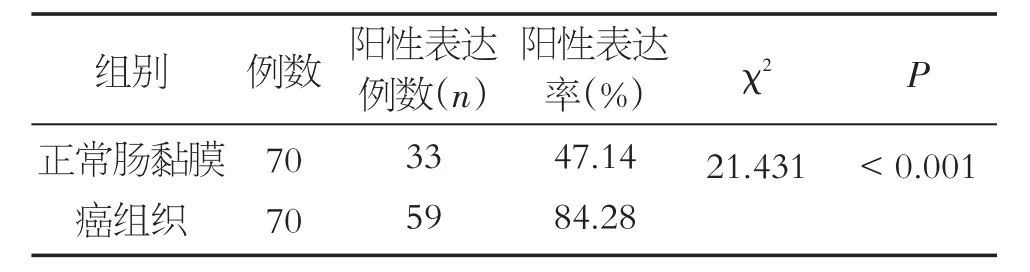
表4 结直肠癌组织及癌旁正常黏膜中β-catenin的表达情况
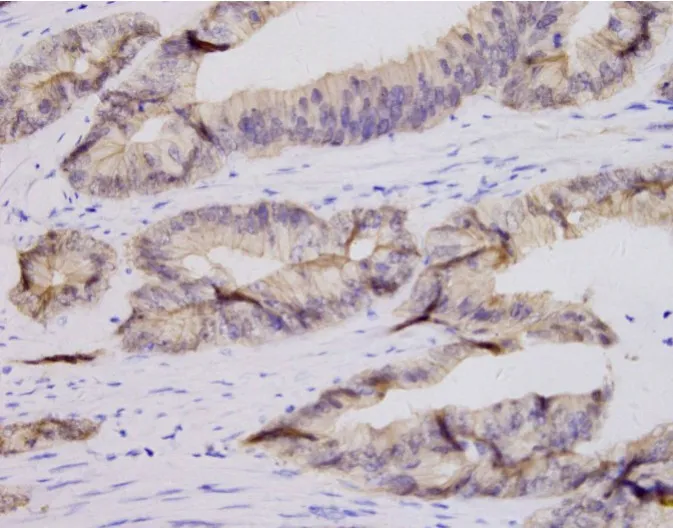
图2 β-catenin蛋白阳性表达(EnVision法,× 400)
2.4 癌组织中β-catenin蛋白表达与临床病理特性的关系
2.4.1 癌组织分化程度
癌组织中高、中、低分化组别β-catenin蛋白阳性表达率分别为52.17%、66.67%、50.00%,其中各组间差异无统计学意义(χ2=1.643,P > 0.05),见表5。

表5 癌组织中β-catenin的表达与分化程度的关系
2.4.2 淋巴结转移
在42例β-catenin阳性表达癌组织中,其中有淋巴结转移24例。淋巴结转移组中β-catenin蛋白的阳性表达率为77.42%,显著高于无淋巴结转移组中的β-catenin蛋白阳性表达率46.15%,差异具有统计学意义(χ2=8.159,P < 0.05)。提示β-catenin的阳性表达可能参与肿瘤的侵袭、转移等生物学行为。
2.4.3 其他临床病理特征
β-catenin的阳性表达与肿瘤组织的分化程度、浸润深度、肿瘤大小、患者年龄和性别均无关(P>0.05),见表6。
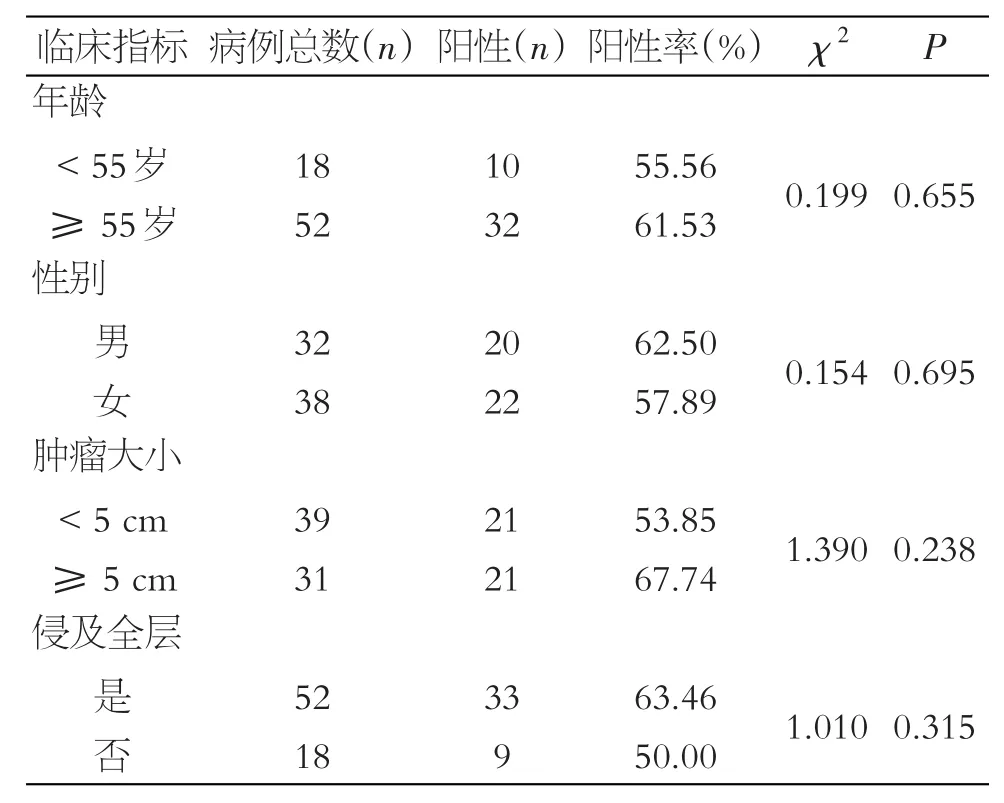
表6 结直肠癌β-catenin表达与临床病理因素的关系
2.5 SetDB1与β-catenin相关性分析
癌组织中SetDB1与β-catenin均呈高表达(图3),且 SetDB1与β-catenin表达存在相关性(r=0.397,P=0.001),见表7 。
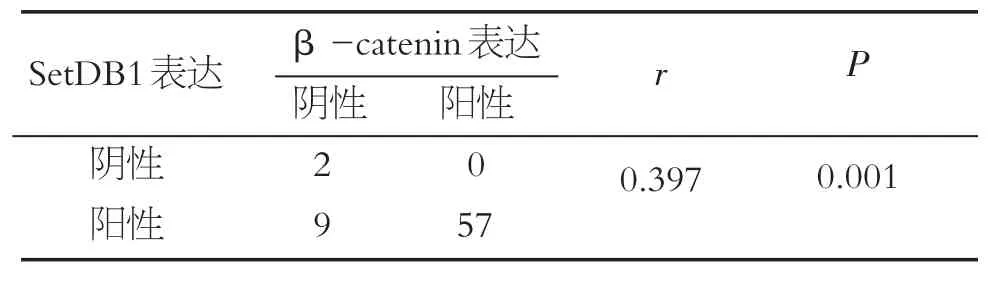
表7 SetDB1与β-catenin相关性分析
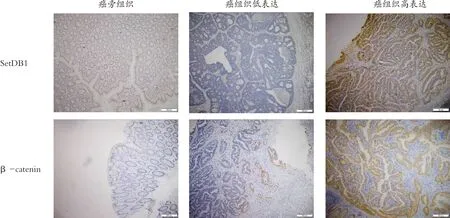
图3 免疫组化检测SetDB1和β-catenin在结直肠癌组织及癌旁组织中的表达(EnVision法,×40)
3 讨 论
正常人体组织、细胞的生长受到癌基因和抑癌基因的精确调控。国内外大量研究表明,肿瘤细胞的无限增殖是由于细胞凋亡受到抑制(癌基因被激活或抑癌基因被抑制)的结果[13]。近几年研究表明,-CpG岛发生甲基化是导致抑癌基因低表达的关键因素之一[14]。甲基化是蛋白质和核酸的一种重要修饰,甲基化功能的本质是甲基化机制的建立、维持和去除甲基[15],早在1975年,Holliday R等[16]就发现胞嘧啶在CpG位点的甲基化可以通过体细胞的分裂进行遗传。甲基化主要包括DNA的甲基化和蛋白质(主要是精氨酸和赖氨酸)的甲基化。组蛋白尾部通过发生甲基化、乙酰化、磷酸化、泛素化等共价修饰来组成组蛋白密码,调节着许多生物学事件[17]。
赖氨酸甲基转移酶四大家族中的许多成员与肿瘤的形成有关,赖氨酸甲基转移酶活性缺失或失调可能是导致肿瘤发生的原因[18]。而甲基化是通过甲基转移酶进行催化、维持,因此,组蛋白赖氨酸甲基转移酶在组蛋白的甲基化中扮演着重要的角色[19],大多数的组蛋白甲基转移酶都含有Set结构域,构成了Set-domain组蛋白甲基化转移酶家族(SET-do⁃main protein methyltransferase family),组蛋白赖氨酸的甲基化几乎全部由Set-domain家族催化执行[19]。
Set-domain分支型1(即SET domain bifurcated 1,SetDB1)是组蛋白赖氨酸N端甲基转移酶家族中的一员,其编码基因位于人类染色体1q21上[20]。Set⁃DB1与特异性异染色质蛋白HP1及染色质组装因子CAF1相关联形成复合物,这种HP1-CAF1-SetDB1复合物可以导致K9在非核小体组蛋白H3上发生单甲基化,从而促进H3K9me3的形成,介导肿瘤的发生[3]。Set结构域蛋白的主要功能是调节细胞相关增殖基因的活性,但是具体机制还不甚明确。有学者发现SetDB1在多种肿瘤细胞株,比如乳腺癌细胞株和肾脏癌细胞株[21]中的表达均有上调。祝顺琴[22]研究表明沉默SetDB1基因后导致神经母细胞瘤生长、增殖受到抑制,下调SetDB1会抑制嘌呤核苷酸的从头合成从而影响肿瘤的增殖和分化,这表明SetDB1对神经母细胞的增殖和分化具有重要的作用。国内外大量研究也证实SetDB1在前列腺癌、肝细胞癌、肾癌、乳腺癌、脑胶质瘤、黑色素瘤等多种肿瘤细胞中呈现高表达,并且可以通过下调SetDB1的表达来影响肿瘤的生长能力。癌症基因组图谱(TCGA)数据库亦显示SetDB1在肿瘤高表达基因的排名中属于最靠前基因之一[23]。因此,目前已经有部分学者将SetDB1基因作为癌基因看待。本研究显示在70例结直肠癌中,SetDB1在癌组中的阳性率(97.14%)较癌旁组(30%)明显增高,说明SetDB1可能对结直肠癌发生发展起到一定的促进作用;本研究另一结果显示,SetDB1的高表达与肿瘤组织的分化程度有关,中、高分化程度的结直肠癌SetDB1阳性率达到了71.42%,提示SetDB1可能还参与肿瘤的组织分化调控。
Wnt信号传导通路作为与胚胎发育及肿瘤发生密切相关的信号通路之一,目前成为近年来的研究热点。Wnt/β-catenin通路包含3部分:细胞外因子Wnt蛋白、胞膜上的卷曲蛋白及受体及胞质内β-catenin蛋白受体、细胞核内转录因子TCF4/Lef[11]。各种原因导致胞外因子Wnt被激活,通过一系列的作用激活胞内的β-catenin蛋白受体,致β-catenin无法被磷酸化从而在胞质内累积,大量游离的β-catenin在胞浆内聚集,入核与TCF4结合形成复合物,启动下游靶基因的异常转录,进而诱发细胞异常增殖、促进肿瘤发生[24-25]。如上所述,Wnt通路中的关键因子β-catenin如果发生突变或失调都有可能诱导癌症的发生[26]。邹慧娟等[27]在结直肠癌患者血清中发现某些因子可以活化Wnt信号通路,活化后的Wnt信号通路可能会通过β-catenin上调细胞增殖相关因子(c-myc和cyclin D1),从而促进结直肠癌细胞的增殖。还有学者通过对结肠癌组织的基因表达谱进行检测,发现在癌组织里Wnt信号通路中调控细胞周期、基因转录的关键因子均呈上调表达,说明Wnt信号通路的激活可能是结直肠癌发生的重要原因之一,也说明Wnt通路可能是结直肠癌演变过程中的重要信号通路之一[28]。本研究结果显示,β-catenin蛋白在癌组中的表达显著高于癌旁组,说明在结直肠癌患者中Wnt/β-catenin可能被激活,笔者推测Wnt/β-catenin通路的激活可能参与结直肠癌的发生发展,并且本研究的另一结果表明,在淋巴结转移组中β-catenin蛋白的高表达率为77.42%,显著高于无淋巴结转移组,因此笔者推测在结直肠癌中,淋巴结是否转移可能与Wnt/β-catenin通路是否激活有关,这与目前木尔扯尔等人的研究相符[29]。
SetDB1和β-catenin的相关性分析结果表明,相关系数r=0.397,小于0.8,提示在结直肠癌的发生发展过程中,SetDB1和β-catenin两者之间可能还有其他因子的作用。
4 结 论
本研究结果表明,SetDB1和β-catenin在结直肠癌组织中呈现高表达,SetDB1和β-catenin的关联性分析表明两者呈中度相关,结合相关文献及关联性分析结果推测SetDB1和β-catenin的高表达可能会促进结直肠癌的发生和发展,但由于SetDB1和β-catenin的关联性分析表明两者呈中度相关,Set⁃DB1在结直肠癌中是否能够通过某种方式上调β-catenin的表达进而激活Wnt/β-catenin通路还有待进一步研究。
1. 李道娟,李倩,贺宇彤,等.结直肠癌流行病学趋势[J].肿瘤防治研,2015,42(3):305-310.
2. John McGrath,Patrick Trojer.Targeting histone lysine methylation in cancer[J].Pharmacol Ther,2015,150:1-22.
3. Loyola A,Tagami H,Bonaldi T,et al.The HP1al⁃pha-CAF1-SetDB1-containing complex provides H3K9me1 for Suv39-mediated K9me3 in pericentric het⁃erochromatin[J].EMBO Rep,2009,10(7):769-775.
4. Rodriguez-Paredes M,Martinez de Paz A,Simó-Riu⁃dalbas L,et al.Gene amplification of the histone methyl⁃transferase SETDB1 contributes to human lung tumori⁃genesis[J].Oncogene,2014,33(21):2 807-2 813.
5. Liu L,Kimball S,Liu H,et al.Genetic alterations of his⁃tone lysine methyltransferases and their significance in breast cancer[J].Oncotarget,2015,6(4):2 466-2 482.
6. Sun Y,Wei M,Ren SC,et al.Histone methyltransfer⁃ase SETDB1 is required for prostate cancer cell prolifera⁃tion,migration and invasion[J].Asian J Androl,2014,16(2):319-324.
7. Fei Q,Shang K,Zhang J,et al.Histone methyltransfer⁃ase SETDB1 regulates liver cancer cell growth through methylation of p53[J].Nat Commun,2015,6:8 651.
8. Sun QY,Ding LW,Xiao JF,et al.SETDB1 accelerates tumourigenesis by regulating the WNT signalling path⁃way[J].J Pathol,2015,235(4):559-570.
9. Wong CM,Wei L,Law CT,et al.Up-regulation of histone methyltransferase SETDB1 by multiple mecha⁃nisms in hepatocellular carcinoma promotes cancer metas⁃tasis[J].Hepatology,2016,63(2):474-487.
10. Shadfan A,Hellebust A,Richards-Kortum R,et al.Confocal foveated endomicroscope for the detection of esophageal carcinoma[J].Biomed Opt Express,2015,6(7):2 311-2 324.
11. 王国强,卢震海,方淯靖,等.Wnt/β-catenin信号通路相关因子与结肠癌患者预后的关系[J].广东医学,2012,33(9):1 245-1 248.
12. Maruyama K,Ochiai A,Akimoto S,et al.Cytoplasmic beta-catenin accumulation as a predictor of hematoge⁃nous metastasis in human colorectal cancer[J].Oncology,2000,59(4):302-309.
13. 李娜,高俊岩,刘敏.细胞凋亡和肿瘤的关系研究进展[J].当代医学,2009,15(16):13-14.
14. 元云飞,李锦清,杨祖立,等.肿瘤相关基因过甲基化的研究进展[J].癌症,2002,21(11):1 267-1 277.
15. 王瑞娴,徐建红.基因组DNA甲基化及组蛋白甲基化[J].遗传,2014,3(36):191-199.
16. Holliday R,Pugh JE.DNA modification mechanisms and gene activity during development[J].Science,1975,187(4173):226-232.
17. 曹仁贤,文格波.组蛋白赖氨酸甲基化研究进展[J].国际病理科学与临床杂志,2006,26(6):519-523.
18. 潘建华,徐克前.组蛋白赖氨酸甲基转移酶与肿瘤[J].生命的化学,2005,25(2):132-134.
19. Zhang L,Deng L,Chen F,et al.Inhibition of histone H3K79 methylation selectively inhibitsproliferation,self-renewal and metastatic potential of breast cancer[J].Oncotarget,2014.5(21):10 665-10 677.
20. Rea S,Eisenhaber F,O'Carroll D,et al.Regulation of chromatin structure by site-specific histone H3 methyl⁃transferases[J].Nature,2000,406(6796):593-599.
21. 周颖,陈萱.沉默SETDB1对肾癌细胞生长的影响及分子机制研究[J].中国临床研究,2016,7(29):896-899,903.
22. 祝顺琴.组蛋白H3K9甲基化转移酶SETDB1对神经母细胞瘤增殖与分化的调控研究[D].重庆:重庆大学,2014.
23. Chen Y,McGee J,Chen X,et al.Identification of drug⁃gable cancer driver genes amplified across TCGA datasets[J].PLoS One,2014,9(5):98 293.
24.Ghahhari NM,Babashah S.Interplay between microR⁃NAs and WNT/β-catenin signalling pathway regulates epithelial-mesenchymal transition in cancer[J].Eur J Can⁃cer,2015,51(12):1 638-1 649.
25. Thomson S,Petti F,Sujka-Kwok I,et al.A systems view of epithelial-mesenchymal transition signaling states[J].Clin Exp Metastasis,2011,28(2):137-155.
26. Klaus A,Birchmeier W.Wnt signalling and its impact on development and Cancer[J].Nat Rev Cancer,2008,8(5):387-398.
27. 邹慧娟,郑航,李明君,等.Wnt信号通路在结肠癌中的表达及其作用机制[J].中国老年学杂志,2016,14(36):3 373-3 374.
28. 陈伙辉,汪森明,陈燕武,等.结肠癌患者Wnt信号通路的变化和作用[J].中国实用医药,2009,4(7):11-12.
29. 木尔扯尔,文彬,黄一凡,等.β-catenin与wisp-1在结肠癌中的表达及意义[J].现代肿瘤医学,2014,2(22):366-370.

