miR-301b在调节脂肪细胞分化中的作用
徐晓薇,李芝佳,王宝利△
间充质干细胞(mesenchymal stem cells,MSCs)是一种具有多向分化潜能的细胞,最早从骨髓中获得并作为造血干细胞的滋养层细胞,后被发现其在不同的诱导条件下可分化为成骨细胞、软骨细胞、脂肪细胞及肌细胞等[1]。microRNAs(miRNAs)是一类在真核细胞中调控基因表达的小分子非编码RNA,通过阻碍翻译或降低mRNA的稳定性,在转录后可对靶基因发挥抑制作用[2]。miRNAs参与了脂肪细胞生成和代谢过程调控,如miR125b-5p在脂肪生成过程中表达量会上升[3];miR-130可通过抑制特定脂肪生成因子的mRNA表达,从而抑制脂肪生成过程[4];miR-146a在人类脂肪细胞中可调节炎症反应[5]等。但目前关于miR-301b对脂肪细胞分化的调控研究尚少见。本实验通过将miR-301b mimics转染至骨髓基质细胞ST2,旨在探讨miR-301b对MSCs向脂肪细胞分化的影响。
1 材料与方法
1.1 实验材料 骨髓基质细胞系ST2细胞为本实验室保存;胎牛血清及细胞培养基均购自Gibco公司;转染试剂Lipofectamine RNA iMAX购自美国Invitrogen公司;miR-301b mimics及其阴性对照片段(NC)由上海吉玛生物科技公司合成;miRNA提取试剂盒及总RNA提取试剂盒购自OMEGA公司;miRNA cDNA第一链合成试剂盒及miRNA特异性引物购自Gene Copoeia公司,高效逆转录试剂盒购自Thermo公司;SYBR Green qPCR Kit购自生工生物工程(上海)股份有限公司;鼠源β-actin单克隆抗体、兔源过氧化物酶体增殖物激活受体γ(PPARγ)多克隆抗体和兔源脂肪型脂肪酸结合蛋白(aP2)单克隆抗体均购自proteintech公司;兔源C/EBPα单克隆抗体购自ABGENT公司;辣根过氧化物酶标记山羊抗小鼠IgG和山羊抗兔IgG购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 ST2细胞的培养、分组与诱导分化 间充质干细胞系ST2于37℃、5%CO2的条件下培养,其培养基使用含10%胎牛血清(FBS)和1%青霉素、链霉素的α-MEM完全培养基。当细胞汇合度达到100%时,将细胞分为成脂分化诱导组和对照组,成脂分化诱导组的细胞换用含有0.05 mmol/L 3-异丁基-1-甲基黄嘌呤、5 mg/L胰岛素、0.05 mmol/L吲哚美辛、0.05µmol/L地塞米松和10%FBS的α-MEM成脂诱导培养基,促使ST2细胞向成脂方向分化。
1.2.2 ST2细胞成脂诱导后miR-301b表达量的检测 ST2细胞成脂诱导24 h后收集细胞,使用OMEGA miRNA kit提取细胞miRNA,cDNA的逆转录使用miRNA cDNA第一链合成试剂盒进行。用SYBR Green qPCR试剂分别进行miR-301b和U6(内参)的qRT-PCR扩增。miR-301b上游引物5′-TGCAATGGTATTGTCAAAGC-3′,U6 上游引物 5′-TTCGTGAAGCGTTCCATATT-3′;下游均使用试剂盒自带通用引物5′-CAGTGCGTGTCGTGGAGT-3′。PCR反应体系:cDNA 3µL,上、下游引物(10µmol/L)各 0.75µL,2×SYBR Green PCR Master Mix 7.5µL,去离子水补充至15µL。反应条件:95℃预变性2 min;95℃变性30 s,57℃退火15 s,72℃延伸15 s,40个循环。目的基因在成脂分化诱导组中相对于对照组的表达量变化采用2-ΔΔCt法计算,其中ΔCt=目的基因Ct值–U6 Ct值,ΔΔCt=成脂分化诱导组ΔCt值–对照组ΔCt值,表达量变化倍数=2-ΔΔCt。
1.2.3 ST2细胞的转染与分组 实验前将ST2细胞接种于12孔板中,待细胞汇合度达到 40%~50%时,按照Lipofectamine RNA iMAX转染试剂说明书,将细胞分为miR-301b mimics转染组和NC转染组,分别转染miR-301b mimics和NC,其中miR-301b mimics和NC的终浓度均为30 nmol/L。转染20 h后更换细胞培养基,并在细胞汇合度达到100%时按方法1.2.1诱导细胞成脂分化。
1.2.4 qRT-PCR检测脂肪细胞特异性转录因子和标志基因的表达 收取分组转染并经成脂诱导48 h的ST2细胞,利用OMEGA总RNA提取试剂盒提取细胞总RNA,并取1µg RNA逆转录合成为cDNA,逆转录过程使用Thermo逆转录试剂盒。PPARγ、C/EBPα和aP2的引物设计使用primer 5软件,引物序列见表1。qRT-PCR反应体系及反应条件同
1.2.2 。各实验组目的基因的表达量相对于对照组的表达量变化倍数用2-ΔΔCt法计算,其中各实验组ΔCt=目的基因Ct值-β-actin Ct值,ΔΔCt=miR-301b mimics转染组 ΔCt值–NC 转染组 ΔCt值,表达量变化倍数=2-ΔΔCt。
1.2.5 Western blot检测细胞成脂特异性蛋白的表达 收取miR-301b mimics转染组和NC转染组的经成脂诱导分化72 h后的ST2细胞,加入适量蛋白裂解液置于冰上裂解10 min,经12 000×g离心10 min,弃去细胞碎片沉淀,含蛋白上清使用BCA方法测定蛋白浓度。取各组蛋白各20µg,加入5×SDS Loading Buffer并煮沸充分变性,进行10%SDS-PAGE电泳。凝胶中的蛋白经250 mA恒流转膜110 min后转移到NC膜上,使用脱脂奶粉封闭2 h,后加入一抗(稀释比:鼠抗β-actin 单克隆抗体为 1∶5 000,兔抗 PPARγ 为 1∶1 500、C/EBPα 为 1∶500,aP2为 1∶1 500)孵育过夜。次日 NC 膜使用1×PBST洗涤3次,每次10 min,再加入辣根过氧化物酶标记的二抗(稀释比:山羊抗鼠 IgG 1∶5 000,山羊抗兔 IgG 1∶2 000)孵育2 h,再经1×PBST洗涤5次,每次8 min,最后采用ECL化学发光试剂检测蛋白印迹结果。
1.3 统计学方法 采用SPSS 18.0软件进行统计处理。符合正态分布的计量资料以均数±标准差(x±s)表示。2 组间均数进行比较使用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-301b在小鼠ST2细胞成脂诱导分化过程中的表达变化 成脂分化诱导组miR-301b相对表达水平(0.219±0.021)较对照组(1.000±0.425)减少(t=3.177,n=3,P<0.05)。
2.2 miR-301b对细胞成脂特异性基因表达的影响 miR-301b mimics转染组的PPARγ、C/EBPα和aP2相对表达量均较NC转染组降低(P<0.05),见表2。
2.3 miR-301b对细胞成脂特异性蛋白表达的影响 miR-310b mimics转染组与NC转染组相比,标志基因aP2和转录因子PPARγ和C/EBPα蛋白的表达量均减少(P<0.05),见图 1、表 3。
Tab.2 TherelativeexpressionlevelsofPPARγ,C/EBPαand aP2 mRNA after transfection of miR-301b mimics表2 转染miR-301b mimics后细胞中PPARγ、C/EBPα、aP2 mRNA相对表达量 (n=3,±s)
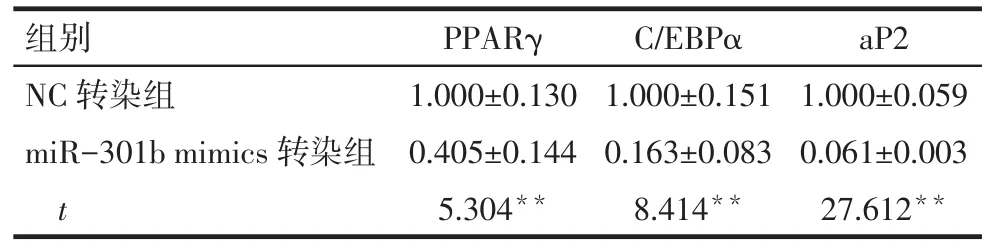
Tab.2 TherelativeexpressionlevelsofPPARγ,C/EBPαand aP2 mRNA after transfection of miR-301b mimics表2 转染miR-301b mimics后细胞中PPARγ、C/EBPα、aP2 mRNA相对表达量 (n=3,±s)
**P<0.01
组别NC转染组miR-301b mimics转染组t PPARγ 1.000±0.130 0.405±0.144 5.304**C/EBPα 1.000±0.151 0.163±0.083 8.414**aP2 1.000±0.059 0.061±0.003 27.612**
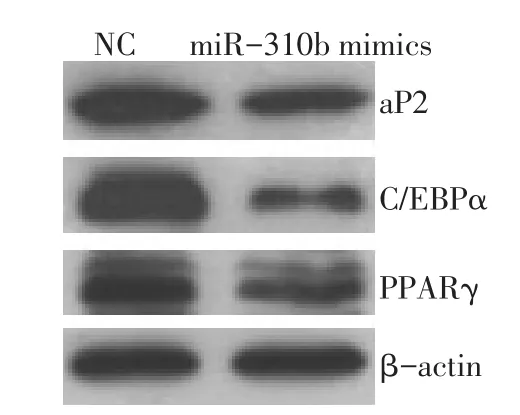
Fig.1 Effects of miR-301b on aP2,C/EBPα and PPARγ protein expression in ST2图1 miR-301b对ST2中aP2、C/EBPα和PPARγ蛋白表达的影响
Tab.3 TherelativeexpressionlevelsofPPARγ,C/EBPαand aP2 protein after transfection of miR-301b mimics表3 转染miR-301b mimics后细胞中PPARγ、C/EBPα、aP2蛋白相对表达量 (n=3,±s)
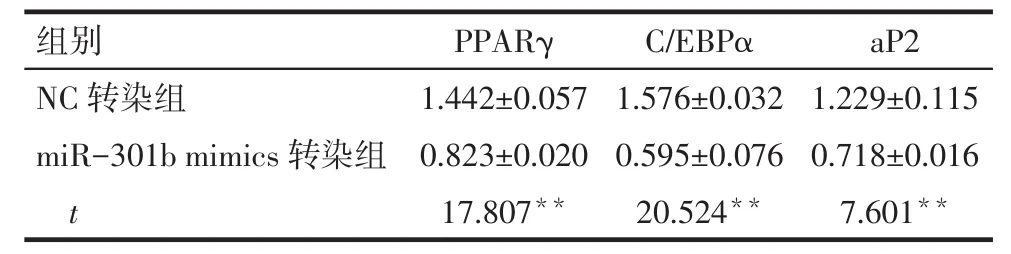
Tab.3 TherelativeexpressionlevelsofPPARγ,C/EBPαand aP2 protein after transfection of miR-301b mimics表3 转染miR-301b mimics后细胞中PPARγ、C/EBPα、aP2蛋白相对表达量 (n=3,±s)
**P<0.01
组别PPARγC/EBPαaP2 NC转染组miR-301b mimics转染组t 1.442±0.057 0.823±0.020 17.807**1.576±0.032 0.595±0.076 20.524**1.229±0.115 0.718±0.016 7.601**
3 讨论
MSCs在历经前脂肪细胞向成熟脂肪细胞分化的过程中,受到若干特异性转录因子的调控,如PPARγ及C/EBPα等[6]。此后在这些促进脂肪细胞分化的关键转录因子作用下,更多下游脂肪细胞靶基因开始表达,如aP2等。因此,检测这些相应基因的表达可更好地反映MSCs的成脂分化状态。本研究探讨了miR-301b与MSCs分化间的关系。结果显示,与对照组比较,成脂分化诱导组miR-301b的表达量降低,提示miR-301b可能参与了脂肪细胞分化。进一步研究发现,miR-310b mimics转染组与NC 转染组相比,细胞中 PPARγ、C/EBPα、aP2的mRNA和蛋白相对表达量均下降,表明提高ST2细胞内miR-301b水平能够阻断细胞成脂特异性转录因子和基因的mRNA和蛋白的表达,抑制MSCs分化为成熟脂肪细胞,证实了miR-301b能抑制脂肪细胞的分化。
目前,就miR-301b的生理功能研究主要集中在其与肿瘤和免疫应答之间的关系上。如miR-301b参与调控核受体亚家族C组成员2(nuclear receptor subfamily group c member 2,NR3C2)的表达,可削弱NR3C2的抑癌细胞转移入侵作用,降低胰腺癌患者生存率[7]。Li等[8]研究显示,miR-301b 能通过减少c-Myb转录,正调节抗炎细胞因子白细胞介素 4(interleukin 4,IL-4)和转化生长因子-β1(transforming growth factor-β1,TGF-β1),负调节促炎细胞因子巨噬细胞炎症蛋白(MIP-1α)和白细胞介素 17(interleukin 17,IL-17A)的生成,起到免疫活化作用。另有研究显示,miR-301b可能通过直接作用于病毒RNA的方式阻碍猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的复制,这为利用miRNAs进行抗病毒治疗提供了新思路[9]。然而,目前miR-301b对MSCs向脂肪细胞分化的影响研究较少,且miR-301b是通过何种机制来对脂肪细胞分化进行调控尚不明确。
Li等[10]研究表明,与 miR-301b 同家族的 miR-301a存在于3T3-L1细胞中,直接以PPARγ基因为靶点减少其表达量,可抑制细胞向脂肪细胞分化。Wang等[11]研究显示,miR-301a和 miR-301b 可与N-myc下游调控基因 2(N-myc downstreamregulated gene 2,NDRG2)的 3′-UTR 结合并下调NDRG2的表达,从而提高前列腺癌细胞的抗辐射性。另外,NDRG2也被证实参与了MSCs的分化调节,下调NDRG2的表达能够抑制MSCs成脂分化[12]。本研究中miR-301b下调了一些成脂特异性基因的表达水平,这种调控可能是直接的,如miR-301b可能以C/EBPα、aP2的基因为靶基因;也有可能是间接的,如miR-301b可能通过靶向减少NDRG2的表达,从而干扰了NDRG2的MSCs分化调节功能,最终抑制了脂肪细胞的分化形成。目前,因miRNAs与其作用基因之间存在一对多的关系,结合生物信息学预测技术寻找miR-301b的多个潜在靶基因并加以验证,进一步发现其调控脂肪细胞分化的详细信号网络,还需更多实验研究加以阐述。
综上所述,寻找到影响某个生命过程的miRNAs,定位其靶基因并揭示其作用机制,对认识miRNAs这种生物小分子的功能有一定意义。越来越多的miRNA基因功能的揭示将使更完整地勾画生物活性功能过程的调控网络成为可能,从而加深对生命现象的理解。
[1]Pino AM,Rosen CJ,Rodríguez JP.In osteoporosis,differentiation ofmesenchymalstem cells(MSCs)improvesbone marrow adipogenesis[J].Biol Res,2012,45(3):279-287.doi:10.4067/S0716-97602012000300009.
[2]Bartel DP.MicroRNA target recognition and regulatory functions[J].Cell,2009,136(2):215-233.doi:10.1016/j.cell.2009.01.002.
[3]Rockstroh D,Löffler D,Kiess W,et al.Regulation of human adipogenesis by miR125b-5p[J].Adipocyte,2016,5(3):283-297.doi:10.1080/21623945.
[4]Lee EK,Mi JL,Abdelmohsen K,et al.miR-130 suppresses adipogenesis by inhibiting peroxisome proliferator-activated receptor γ expression[J].Mol Cell Biol,2011,31(4):626-638.doi:10.1128/MCB.00894-10.
[5]Roos J,Enlund E,Funcke JB,et al.miR-146a-mediated suppression of the inflammatory response in human adipocytes[J].Sci Rep,2016,6:38339.doi:10.1038/srep38339.
[6]Spiegelman BM,Flier JS.Adipogenesis and obesity:rounding out the big picture[J].Cell,1996,87(3):377-389.
[7]Yang S,He P,Wang J,et al.A Novel MIF signaling pathway drives the malignant character of pancreatic cancer by targeting NR3C2[J].Cancer Res,2016,76(13):3838.doi:10.1158/0008-5472.CAN-15-2841.
[8]Li X,He S,Li R,et al.Pseudomonas aeruginosa infection augments inflammation through miR-301b repression of c-Myb-mediated immune activation and infiltration[J].Nat Microbiol,2016,1(10):16132.doi:10.1038/nmicrobiol.2016.132.
[9]Li L,Gao F,Jiang Y,et al.Cellular miR-130b inhibits replication of porcine reproductive and respiratory syndrome virus in vitro and in vivo[J].Sci Rep,2015,5:17010.doi:10.1038/srep17010.
[10]Li H,Xue M,Xu J,et al.MiR-301a is involved in adipocyte dysfunction during obesity-related inflammation via suppression of PPARγ[J].Pharmazie,2016,71(2):84.doi:10.1691/ph.2016.5724.
[11]Wang W,Liu M,Guan Y,et al.Hypoxia-responsive mir-301a and mir-301b promote radioresistance of prostate cancer cells via downregulating NDRG2[J].Med Sci Monit,2016,22:2126-2132.doi:10.12659/MSM.896832.
[12]杲丽.NDRG2调节骨髓间充质干细胞成骨成脂分化机制的研究[D].西安:第四军医大学,2013:26-33.Gao L.NDRG2 regulates osteogenic and adipogen differeiffere of mice bone marrow-derived mesenchymal stem cells in osteoporosis[D].Xi’an:Fourth Military Medical University,2013:26-33.

