慢病毒载体介导的bFGF基因转染兔BMSCs的实验研究
张槐,彭吾训,刘钢,张健,张飞,王健波,赵胤,李青
骨髓基质干细胞(BMSCs)是骨组织工程研究中首选的种子细胞,该细胞易向成骨方向诱导和分化,近年来由于其强增殖力和具有多向分化潜能,在干细胞研究中引起广泛关注[1]。但BMSCs定向分化需要合适的细胞因子调控,而且在体内移植过程中,细胞存活率低下[2]。碱性成纤维细胞生长因子(bFGF)是成纤维细胞生长因子家族的基本成员,能促进BMSCs迁移、增殖和分化[3],也是一种强大的毛细血管增殖刺激剂,能为BMSCs生长提供充足的血供和营养,但局部使用时存在诸多问题,如半衰期短、使用剂量大和价格昂贵等[4]。目前,随着转基因技术的不断发展,通过转基因改造干细胞已成为干细胞移植领域的研究热点[5]。本研究利用慢病毒载体将bFGF基因转染到BMSCs中,探讨bFGF基因转染对BMSCs生物学特性的影响,并获得持久过表达bFGF的BMSCs,可能为上述问题的解决提供新的思路和方法。
1 材料与方法
1.1 材料 (1)实验动物。4~6周龄清洁级新西兰大白兔4只,由贵州医科大学动物中心提供,体质量1.0~1.5 kg。(2)主要材料与试剂。3%戊巴比妥钠(MERCK公司,德国),Percoll分离液、碱性磷酸酶(ALP)染色试剂盒、嘌呤霉素、CCK-8溶液(北京索莱宝生物科技有限公司),ALP分析试剂盒(BioAssay Systems,美国),茜素红染色试剂盒、成骨诱导培养基(广州赛业生物科技有限公司),细胞周期检测试剂盒(江苏凯基生物科技有限公司),bFGF基因过表达慢病毒和慢病毒阴性对照(上海吉凯基因科技有限公司),bFGF、ACTB(内参)引物、cDNA合成试剂盒[生工生物工程(上海)股份有限公司],Anti-CD44/FITC、兔抗兔Anti-bFGF、兔抗兔Antiβ-actin、山羊抗兔辣根过氧化物酶标记的二抗(北京博奥森生物技术有限公司)。
1.2 方法
1.2.1 兔BMSCs分离培养及鉴定 以3%戊巴比妥钠静脉麻醉后,常规消毒铺巾,在兔股骨远端及胫骨近端穿刺,以预存肝素的注射器抽取骨髓液1~2 mL,再用PBS制成单细胞悬液。采用密度梯度离心法分离细胞后,完全培养基重悬,以细胞密度为1×105/mL接种3 mL于25 cm2培养瓶中,置于37℃、5%CO2培养箱中培养。每天倒置显微镜下观察细胞形态及贴壁情况,当细胞接近80%~90%融合时,加入胰酶按1∶3消化传代。细胞传至第3代时,应用流式细胞仪检测BMSCs细胞表面标志物(CD44)的表达;采用成骨诱导培养基诱导BMSCs成骨分化,于诱导培养第14天,应用ALP染色和茜素红染色鉴定其成骨分化潜能。
1.2.2 过表达bFGF基因慢病毒载体构建 过表达bFGF基因慢病毒载体由上海吉凯基因科技有限公司构建,载体中包含嘌呤霉素抗药基因,见图1。
1.2.3 载有bFGF基因的慢病毒转染BMSCs及筛选 (1)取第3代BMSCs,调整细胞密度为1×105/mL,取2 mL接种于25 cm2培养瓶中,待细胞汇合约30%时,以预实验中最佳转染复数(50)进行转染,根据转染条件分为bFGF转染组、空病毒组及未转染组。10 h后更换新鲜培养基,每天镜下观察细胞生长情况,转染3 d后于倒置荧光显微镜下观察增强型绿色荧光蛋白(EGFP)表达情况。(2)当细胞汇合度约80%~90%时,将细胞1∶3传代。次日加入含嘌呤霉素(2 mg/L)的培养基筛选,每2 d更换1次,待未转染组细胞全部死亡时,将嘌呤霉素减至1 mg/L,维持筛选。
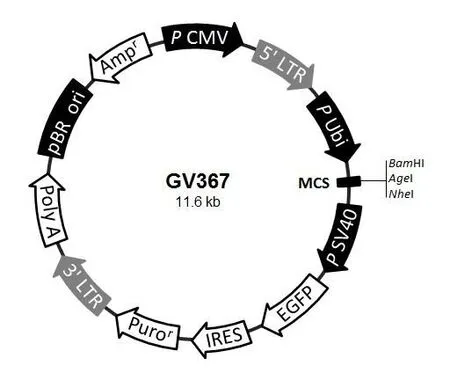
Fig.1 The lentiviral vector(GV367)and clone site icon图1 慢病毒载体(GV367)及克隆位点图谱(MCS为多克隆位点)
1.2.4 RT-PCR和Western blot分别检测bFGF表达 Trizol法提取细胞总RNA,经逆转录扩增后进行RT-PCR反应:95℃预变性3 min;95℃变性 3 s,60℃退火/延伸30 s,共40个循环,引物序列见表1。依据检测所得各组Ct值结果,计算2-ΔΔCt值来表示各组bFGF mRNA相对表达水平。细胞裂解提取各组细胞总蛋白,BCA法测定各组蛋白浓度,并调整蛋白浓度一致后,煮沸变性,然后依次进行电泳、转膜、封闭。封闭完成后,分别加入目的一抗Anti-bFGF(1∶300稀释)、内参一抗 Anti-β-actin(1∶7 500稀释),4℃孵育过夜。加入辣根过氧化物酶标记的二抗(1∶7 500稀释)室温孵育1 h,最后进行化学显影,所得条带采用凝胶图像处理系统分析图像。β-actin作为内参蛋白,以bFGF蛋白条带灰度值/β-actin蛋白条带灰度值计算目的蛋白相对表达量。
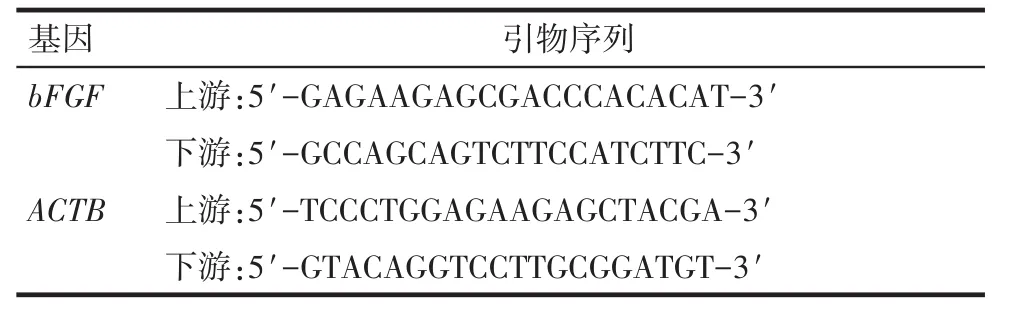
Tab.1 The RT-PCR primer sequences of bFGF/ACTB表1bFGF、ACTB RT-PCR引物序列
1.2.5 CCK-8法检测转染细胞的增殖特性 取bFGF转染组、空病毒组第3代细胞及未转染组细胞,以2×104/mL(100µL/孔)接种于7块96孔板中,各组设3个复孔,置于培养箱中培养。于每天同一时间取一板检测,检测前更换新培养基后,每孔加入10µL CCK-8溶液,置于培养箱内孵育3 h,在450 nm测定光密度(OD)值,根据结果描绘细胞增殖曲线。
1.2.6 细胞增殖周期的测定 取bFGF转染组、空病毒组及未转染组对数生长期的细胞,PBS液洗涤2次,调整细胞密度为1×106/mL,取1 mL加入流式管中,离心后加入500µL 70%冷乙醇重悬,4℃过夜。PBS洗涤2次,加入100µL RNase A重悬,37℃温育30 min,加入400µL PI染液混匀,4℃避光30 min,流式细胞仪检测。
1.2.7 ALP活性检测 取bFGF转染组、空病毒组及未转染组细胞,调整细胞密度为2×104/mL,以1 mL/孔接种于24孔板中,加入成骨诱导培养基后置于培养箱中培养。于培养第7、14、28天,应用ALP分析试剂盒检测各组ALP的活性。
1.3 统计学方法 使用SPSS 22.0统计学软件分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,多重比较应用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs的培养与基因转染情况 采用密度梯度离心法联合贴壁培养法,获得大量形态均一的BMSCs(图2A),细胞呈旋涡状生长,形状呈长梭形、多角形。细胞表面抗原CD44阳性率达99%以上(图3);成骨诱导培养第14天,茜素红、ALP染色均呈阳性(图2B、C)。基因转染后,发现bFGF转染组、空病毒组、未转染组在形态学上无明显差异(图2D~F)。于转染后第4天,在荧光显微镜下观察到绿色荧光蛋白表达率达90%以上(图2G、H)。传代后以2 mg/L嘌呤霉素筛选,筛选第3天出现细胞克隆,筛选第6天时未转染组细胞全部死亡,此时转染组细胞克隆汇合达80%~90%,挑取细胞克隆扩大培养。
2.2 各组细胞bFGF基因、蛋白表达比较 RTPCR检测结果显示,bFGF转染组mRNA表达明显高于其他2组,差异均有统计学意义(均P<0.05),空病毒组与未转染组比较差异无统计学意义,见图4A。Western blot检测结果显示bFGF转染组、空病毒组与未转染组均在17 ku处出现特异性条带(图5),其中bFGF转染组bFGF表达较其他2组显著增强,差异有统计学意义(均P<0.05),见图4B。
2.3 基因转染后细胞增殖能力和细胞周期的变化情况 bFGF基因转染后,细胞增殖曲线明显变陡,除1 d时,各组间OD值差异无统计学意义外,之后各时间点bFGF转染组OD值均高于其他2组,差异有统计学意义(P<0.05),见图6。流式细胞仪检测各细胞增殖周期结果,bFGF转染组G0/G1期的细胞比例较其他2组降低,而在S期与G2/M期,bFGF转染组细胞比例均较其他2组增高,并且bFGF转染组细胞周期指数(PrI)在3组中最高(均P<0.05)。各期中,未转染组与空病毒组比较,差异无统计学意义,见图7。
2.4 各组细胞ALP活性的比较 各组细胞中ALP活性在第14天时达到高峰,随后下降,其中bFGF转染组ALP活性在各时间点均高于空病毒组与未转染组(均P<0.05),见图 8。

Fig.2 BMSCs culture and gene transfection图2 BMSCs的培养与基因转染情况
3 讨论
本研究采用BMSCs作为靶细胞,BMSCs是一种多能干细胞,易在体外分离和培养[6],并具有成骨分化潜力和较强的增殖能力[7],在众多研究中已证实其在骨形成中起重要作用[8],因此被认为是用于骨组织工程的良好种子细胞[9]。获取BMSCs的方法主要包括流式细胞术分离法、全骨髓培养法和密度梯度离心结合贴壁培养法。王雪等[10]应用Percoll密度梯度离心法结合贴壁培养法获得大量形态均一的 BMSCs,流式细胞仪检测 CD44阳性率达99.96%,与本研究一致,证实采用密度梯度离心法结合贴壁筛选法获取高纯度的BMSCs是可行的。
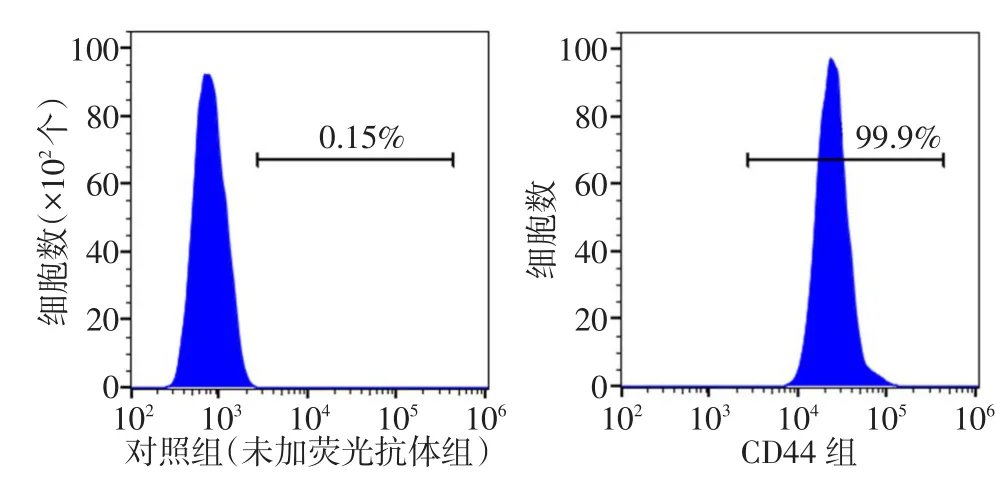
Tab.3 Results of BMSCs surface antigen CD44图3 BMSCs表面抗原CD44检测结果
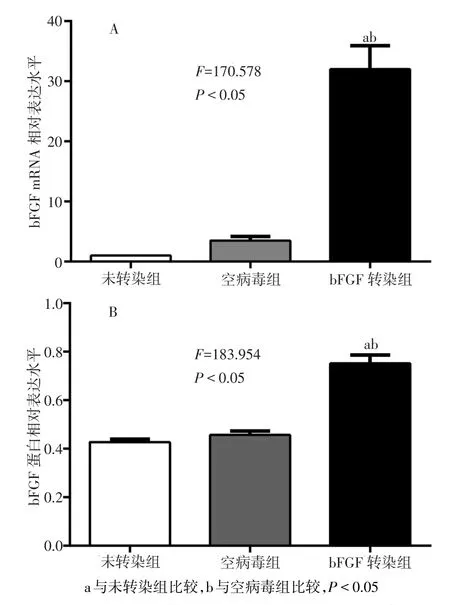
Fig.4 Comparison of bFGF mRNA and protein expression levels between three groups(n=3)图4 3组细胞的bFGF mRNA、蛋白表达水平比较(n=3)
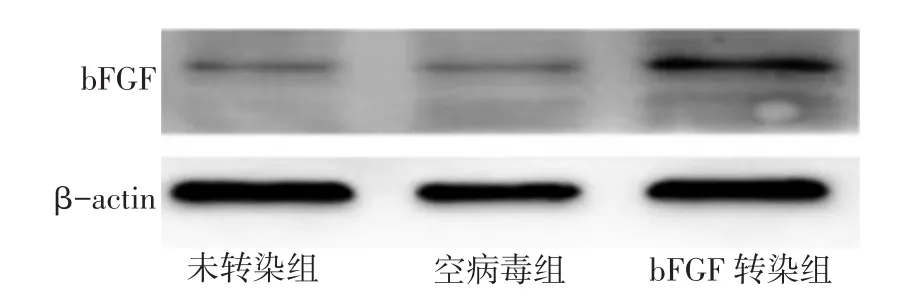
Fig.5 The protein expressions of bFGF in three groups图5 3组细胞bFGF蛋白表达
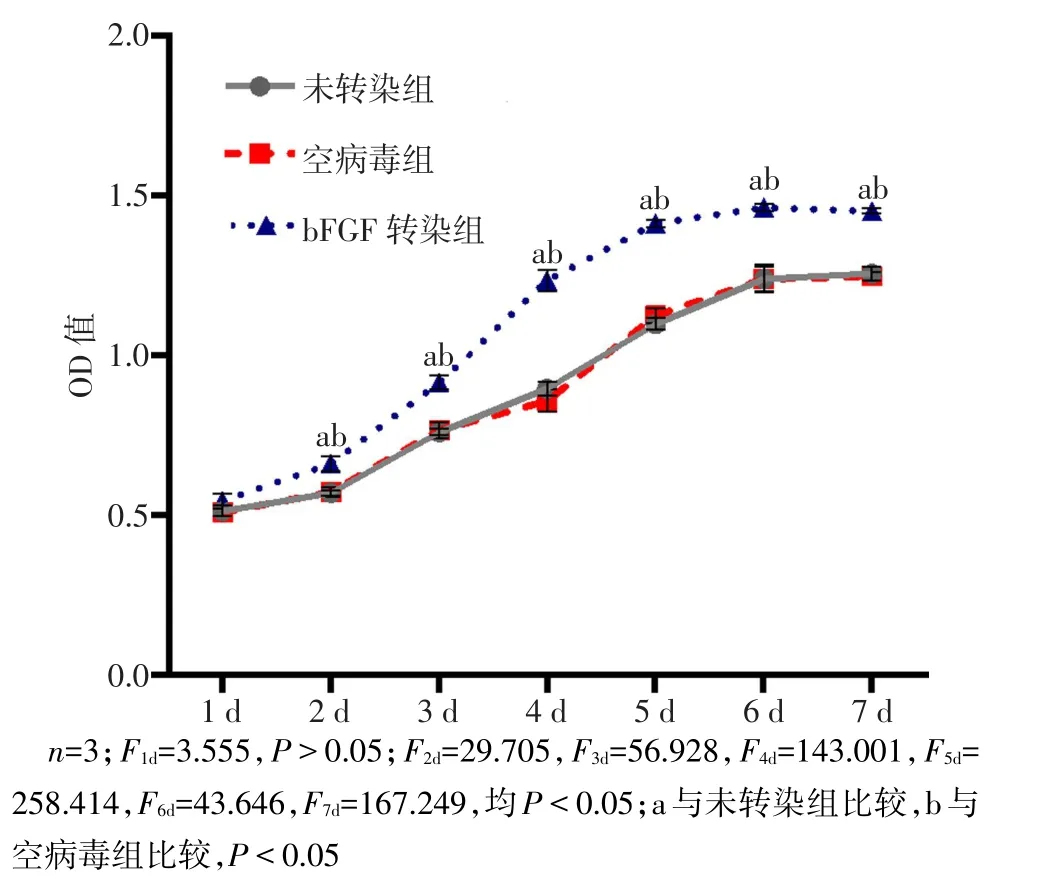
Fig.6 Changes of cell proliferation after bFGF gene transfection in three groups图6 bFGF基因转染后3组细胞增殖能力的变化
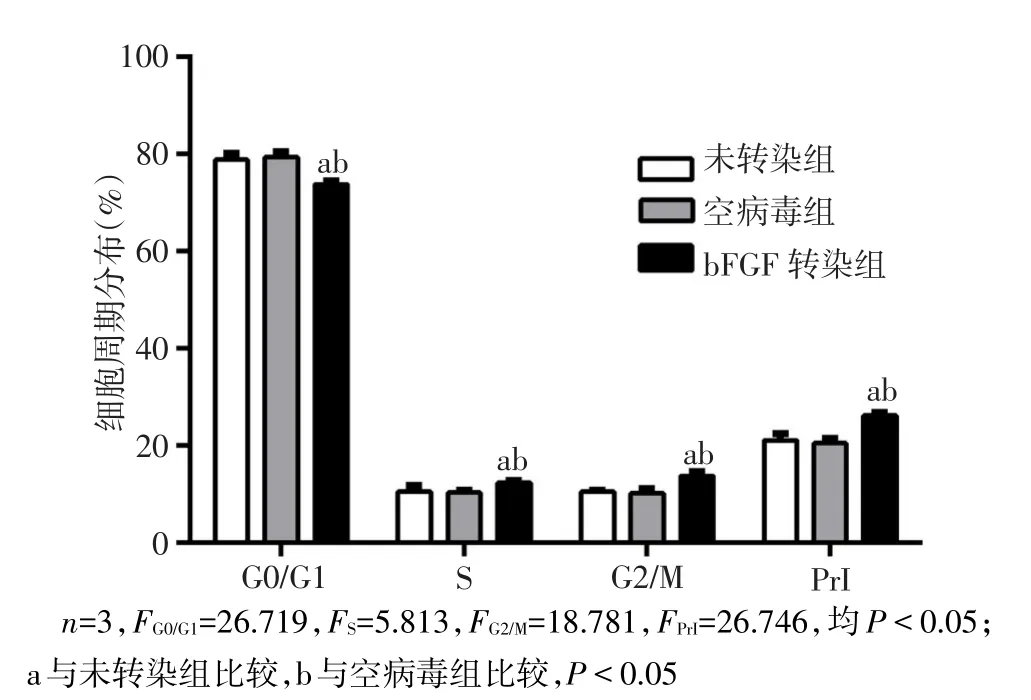
Fig.7 Changes of cell proliferation cycles after bFGF gene transfection in three groups图7 bFGF基因转染后3组细胞增殖周期的变化
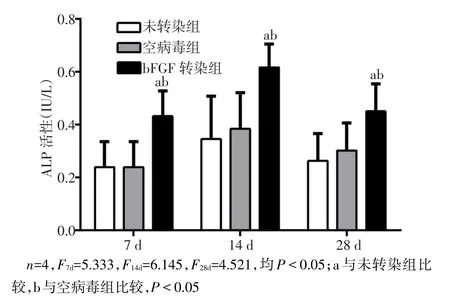
Fig.8 Comparison of ALP activities between three groups图8 各组细胞ALP活性比较
bFGF是成纤维细胞生长因子家族的成员之一,在细胞增殖和分化中起重要作用[11]。Du 等[12]研究表明bFGF有明显增强BMSCs增殖的能力,具有保持成骨的能力,能刺激血管再生,促进干细胞在体内的存活[13]。在本实验中,将bFGF基因成功导入BMSCs,通过RT-PCR和Western blot检测到bFGF转染组mRNA及蛋白表达量均高于空病毒组、未转染组,证明bFGF基因成功过表达。崔利德等[14]研究中利用腺病毒载体将bFGF基因导入BMSCs中,目的基因成功表达,与本研究结果一致。
本研究应用慢病毒载体将bFGF基因转入BMSCs,相对质粒、腺病毒等载体而言,慢病毒具有目的基因表达时间长、低细胞毒性、低免疫原性、转染效率高等优点,因此成为组织工程基因改造最具潜力的载体之一[15-16]。将含有bFGF基因的慢病毒转染BMSCs后,通过细胞形态学观察、细胞增殖曲线、细胞周期及ALP检测来观察其对BMSCs生物学特性的影响,结果发现在形态学上3组比较无明显差异,表明慢病毒转染对BMSCs本身无明显影响,这与Kraus等[17]的研究一致。在bFGF转染组中,细胞增殖分裂能力明显强于空病毒组与未转染组,可能是bFGF促进了BMSCs的增殖。目前bFGF促进细胞增殖的机制尚不明确,Zhang等[18]研究认为可能与bFGF促进pAKT和pGSK3β的升高有关。ALP能够直接反映成骨细胞早期分化的程度,是骨形成的特异性指标[19],因此众多学者通过检测ALP活性来观察BMSCs的成骨效应[20]。本研究中,bFGF转染组ALP活性明显增强,表明bFGF促进了BMSCs的成骨分化。
综上所述,本实验通过慢病毒载体将bFGF基因成功导入BMSCs,目的基因得到表达,转染后细胞增殖能力与成骨分化能力明显增强,并证实慢病毒转染对BMSCs本身无明显影响。在Zhang等[21]的研究中,成功将bFGF基因导入BMSCs中,并证实其能促进骨折愈合,这表明bFGF基因转染的BMSCs有望成为一种新的方法应用于骨折、骨缺损的治疗。本研究仅在体外培养条件下探讨了bFGF基因转染对BMSCs生物学特性的影响,其在体内成血管效应及对骨折、骨缺损修复效果如何,仍需进一步探索。
[1]Wang JJ,Liu YL,Sun YC,et al.Basic fibroblast growth factor stimulates the proliferation of bone marrow mesenchymal stem cells in giant panda(Ailuropoda melanoleuca)[J].PLoS One,2015,10(9):e0137712.doi:10.1371/journal.pone.0137712.
[2]Khan I,Ali A,Akhter MA,et al.Preconditioning of mesenchymal stem cells with 2,4-dinitrophenol improves cardiac function in infarcted rats[J].Life Sci,2016,162:60-69.doi:10.1016/j.lfs.2016.08.014.
[3]Wang X,Zhen L,Miao H,et al.Concomitant retrograde coronary venousinfusion ofbasic fibroblastgrowth factorenhances engraftment and differentiation of bone marrow mesenchymal stem cells for cardiac repair after myocardial infarction[J].Theranostics,2015,5(9):995-1006.doi:10.7150/thno.11607.
[4]Yang Y,Jin G,Li L,et al.Enhanced osteogenic activity of mesenchymal stem cells and co-modified BMP-2 and bFGF genes[J].Ann Transplant,2014,19(1):629-638.doi:10.12659/AOT.892461.
[5]Xu J,Lu H,Miao ZN,et al.Immunoregulatory effect of neuronallike cells in inducting differentiation of bone marrow mesenchymal stem cells[J].Eur Rev Med Pharmacol Sci,2016,20(24):5041-5048.
[6]Zhu L,Liu YJ,Shen H,et al.Astragalus and baicalein regulate inflammation of mesenchymal stem cells(MSCs)by the mitogenactivated protein kinase (MAPK)/ERK pathway[J].Med Sci Monit,2017,23:3209-3216.
[7]Luo G,Huang Y,Gu F.rhBMP2-loaded calcium phosphate cements combined with allogenic bone marrow mesenchymal stem cells for bone formation[J].Biomed Pharmacother,2017,92:536-543.doi:10.1016/j.biopha.2017.05.083.
[8]Liu X,Bao C,Xu HHK,et al.Osteoprotegerin gene-modified BMSCs with hydroxyapatite scaffold for treating critical-sized mandibular defects in ovariectomized osteoporotic rats[J].Acta Biomater,2016,42:378-388.doi:10.1016/j.actbio.2016.06.019.
[9]Luo G,Gu F,Zhang Y,et al.Icariside II promotes osteogenic differentiation of bone marrow stromal cells in beagle canine[J].Int J Clin Exp Pathol,2015,8(5):4367-4377.
[10]王雪,杨婧,袁红,等.丹参素冰片酯对同型半胱氨酸诱导大鼠骨髓间充质干细胞损伤的保护作用及机制[J].中华心血管病杂志,2017,45(2):130-136.Wang X,Yang J,Yuan H,et al.Protective effect and related mechanism of tanshinol borneol ester on homocysteine induced rat bone marrow mesenchymal stem cells damage[J].Chin J Cardiol,2017,45(2):130-136.doi:10.3760/cma.j.issn.0253-3758.2017.02.012.
[11]Xu W,Wang X,Xu G,et al.Basic fibroblast growth factor expression is implicated in mesenchymal stem cells response to light-induced retinal injury[J].Cell Mol Neurobiol,2013,33(8):1171-1179.doi:10.1007/s10571-013-9983-y.
[12]Du M,Zhu T,Duan X,et al.Acellular dermal matrix loading with bFGF achieves similar acceleration of bone regeneration to BMP-2 via differential effects on recruitment,proliferation and sustained osteodifferentiation of mesenchymal stem cells.[J].Mater Sci Eng C Mater Biol Appl,2017,70(Pt1):62-70.doi:10.1016/j.msec.2016.08.049.
[13]Xu Y,Fu M,Li Z,et al.A prosurvival and proangiogenic stem cell delivery system to promote ischemic limb regeneration[J].Acta Biomater,2016,31:99-113.doi:10.1016/j.actbio.2015.12.021.
[14]崔利德,李铁民.碱性成纤维细胞生长因子基因修饰骨髓间充质干细胞移植修复急性肾损伤[J].中国组织工程研究,2016,20(28):4169-4175.Cui LD,Li TM.Basic fibroblast growth factortransfected bone marrow mesenchymal stem cell transplantation for acute kidney injury[J].Chinese Journal of Tissue Engineering Research,2016,20(28):4169-4175.doi:10.3969/j.issn.2095-4344.2016.28.010.
[15]刘伟,王杰,幸永明,等.绿色荧光蛋白标记SOX9基因慢病毒载体的构建及在兔骨髓间充质干细胞中的表达[J].中国实验诊断学 ,2017,21(1):140-145.Liu W,Wang J,Xing YM,et al.Construction of a SOX9 gene recombinant lentivirus vector marked by green fluorescent protein and it’s expression in rabbit bone marrow derived mesenchymal stem cells[J].Chin J Lab Diagn,2017,21(1):140-145.doi:10.3969/j.issn.1007-4287.2017.01.055.
[16]Ortinski PI,O'Donovan B,Dong X,et al.Integrase-deficient lentiviral vector as an all-in-one platform for highly efficient CRISPR/Cas9-mediated gene editing[J].Mol Ther Methods Clin Dev,2017,5:153-164.doi:10.1016/j.actbio.2015.12.021.
[17]Kraus TM,Imhoff FB,Reinert J,et al.Stem cells and bFGF in tendon healing:Effects of lentiviral gene transfer and long-term follow-up in a rat Achilles tendon defect model[J].BMC Musculoskelet Disord,2016,17:148.doi:10.1186/s12891-016-0999-6.
[18]Zhang X,Li J,Ye P,et al.Coculture of mesenchymal stem cells and endothelial cells enhances host tissue integration and epidermis maturation through AKT activation in gelatin methacryloyl hydrogel-based skin model[J].Acta Biomater,2017,59:317-326.doi:10.1016/j.actbio.2017.07.001.
[19]周航宇,夏德林,甘生远,等.骨形态发生蛋白2和血管内皮生长因子165双基因转染骨髓基质干细胞的异位诱导成骨能力[J].中国组织工程研究,2017,21(9):1334-1339.Zhou HY,Xia DL,Gan SY,et al.Ectopic osteogenesis of bone marrow stromal stem cells under bone morphogenetic protein 2/vascular endothelial growth factor 165 co-transfections[J].Chinese Journal of Tissue Engineering Research,2017,21(9):1334-1339.doi:10.3969/j.issn.2095-4344.2017.09.005.
[20]Chen YX,Zhu DY,Xu ZL,et al.The protective effect of cordycepin on alcohol-induced osteonecrosis of the femoral head[J].Cell Physiol Biochem,2017,42(6):2391-2403.doi:10.1159/000480181.
[21]Zhang H,Kot A,Lay YE,et al.Acceleration of fracture healing by overexpression of basic fibroblast growth factor in the mesenchymal stromal cells[J].Stem Cells Transl Med,2017,6(10):1880-1893.doi:10.1002/sctm.17-0039.

