血清对大鼠星形胶质细胞形态和水通道蛋白-4表达的影响
贾 梅,师忠芳,王玉娇,闫 旭,徐立新,董丽萍,李佳欣,陈 烨,袁 芳
首都医科大学北京市神经外科研究所病理生理室,首都医科大学附属北京天坛医院,北京市100050
脑水肿是脑外伤后严重的并发症,常常危及生命[1]。星形胶质细胞上的水通道蛋白-4(aquaporin-4,AQP-4)是脑内最丰富的水通道蛋白,主要维持细胞内外水平衡,在外伤性脑水肿的病理生理过程中发挥重要作用[2-4]。现有研究显示,在不同类型的脑外伤模型中,AQP-4表达增高或降低[5-9]。不同原因引起的脑外伤均导致血脑屏障(blood-brain barrier,BBB)功能障碍[1],漏出到脑组织间隙的血清蛋白是否对AQP-4表达有影响目前并不清楚。整体实验存在多种组织细胞之间的相互作用,无法观察单一因素引起的变化,故本实验应用无血清培养基中添加血清的方法模拟BBB功能障碍,离体水平观察血清对培养星形胶质细胞形态及AQP-4表达的直接影响,旨在明确BBB破坏对AQP-4表达的影响,为更好地理解AQP-4在外伤性脑水肿中的作用提供实验依据。
1 材料与方法
1.1 实验动物
出生24 h内的雌性Wistar大鼠,由军事科学院军事医学研究院实验动物中心提供,动物许可证号SCXK-(军)2012-0004。实验过程按照实验动物使用“3R”原则给予人道关怀,所有实验操作通过北京市神经外科研究所伦理委员会审查。
1.2 实验材料
1.2.1 实验仪器
Light Cycler480实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)仪:瑞士ROCHE公司。Observer A1倒置荧光显微镜:德国ZEISS公司。5415R高速离心机:德国EPPENDORF公司。CB150三气细胞培养箱:德国BINDER公司。
1.2.2 实验试剂
DMEM培养基(11966025)、NB培养基(A2477501)、丙酮酸盐溶液(11360070)、Glutamax溶液(35050061)、胎牛血清(fetal bovine serum,FBS)(10099-141):美国THERMO FISHER公司。牛胰岛素(I5500)、肝素-表皮生长因子(E4643)、腐胺(P5780)、转铁蛋白(T1147)、N-乙酰-L-半胱氨酸(A8199)、亚硒酸盐(S5261)、多聚赖氨酸(P1524):美国SIGMA公司。血清白蛋白(HY-D0842)、孕酮(HY-N0437):美国MEDCHEM EXPRESS公司。
兔抗大鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(Z0334):丹麦DAKO公司。小鼠抗大鼠AQP-4抗体(ab9512):美国ABCAM公司。兔抗大鼠代谢型谷氨酸受体5(metabotropic glutamate receptor 5,mGluR5)抗体(ab76316):美国ABCAM公司。Alexa Fluor 488标记的山羊抗兔二抗(A1108)、Alexa Fluor 546标记的山羊抗小鼠二抗(A1103)、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI):美国THERMO FISHER公司。抗荧光淬灭封片剂(ZLI-9556):北京中杉金桥生物技术有限公司。总RNA提取试剂盒(LS1040)、反转录试剂盒(A3500):美国PROMEGA公司。SYBR GreenⅠ核酸染色试剂盒(04887352001):瑞士ROCHE公司。
1.3 实验方法
1.3.1 细胞原代培养
细胞培养参考本课题组已发表的方法[10]并进行改良。出生24 h内雌性Wistar大鼠乙醚麻醉后取大脑皮层,剥除脑膜后用解剖刀切碎成1 mm3组织块,加入DMEM培养基并制成细胞悬液。200目滤网过滤后,血球计数板计数。调整细胞密度,按照1.2×105/cm2接种到已包被多聚赖氨酸的培养板或培养瓶中,15 min后将上清取出,添加新鲜无血清培养基或者有血清培养基,置于37℃、5%CO2培养箱中培养。
无血清培养基(serum free medium,SFM)配方参考文献[11]并进行改良,主要成分为DMEM培养基和NB培养基,添加丙酮酸盐、Glutamax、牛胰岛素、肝素-表皮生长因子、腐胺、转铁蛋白、N-乙酰-L-半胱氨酸、亚硒酸盐、血清白蛋白、孕酮。有血清培养基分别为DMEM培养基加10%FBS(DMEM+FBS)、上述无血清培养基加10%FBS(SFM+FBS)。
1.3.2 倒置相差显微镜观察细胞形态
细胞分别在SFM、DMEM+FBS及SFM+FBS培养基中培养7 d,每天在倒置相差显微镜下观察培养细胞形态并拍照。
1.3.3 细胞免疫荧光染色
培养细胞免疫荧光染色方法参考文献[10]。原代培养7 d后,丙酮固定,先后进行山羊血清避光封闭20 min、一抗4℃过夜孵育、二抗室温孵育2 h、DAPI复染后,抗淬灭的封片剂封片,倒置荧光显微镜下观察并拍照。抗体浓度如下:GFAP(1∶50)、AQP-4(1∶200)、mGluR5(1∶200)一抗,山羊抗兔/小鼠二抗(1∶200)。阴性对照使用PBS代替一抗。
1.3.4 图像分析
应用Image-Pro Plus 6.0图像分析软件对细胞免疫荧光结果进行图像分析[12]。每组取3个样本,每个样本在镜下(200×)随机选取3个非重叠视野,计算每个视野的积分光密度值(integrated optical density,IOD)。以9个视野中免疫反应阳性细胞的平均IOD代表目标蛋白的表达水平。
1.3.5 RT-qPCR
逆转录RT-qPCR方法参考文献[10]。细胞原代培养7 d后,提取总RNA并进行反转录,随后进行PCR扩增。GFAP、AQP-4及mGluR5引物由深圳华大基因科技服务有限公司设计合成。引物序列见表1。

表1 上下游引物序列
PCR 反 应体系构成(20 μl):SYBR Green PCR Master Mix 10 μl,无核酸酶的水 7 μl,模板 cDNA 1 μl,上、下游引物各1 μl。PCR反应共40个循环,条件如下:95℃预热10 min,95℃变性15 s,60℃退火30 s,72℃延伸30 s。使用LightCycler480实时PCR仪进行实验,LightCycler480 1.5.0软件分析荧光信号,以 β-actin 为内参,GFAP/β-actin,AQP-4/β-actin 及mGluR5/β-actin分别表示星形胶质细胞GFAP、AQP-4及mGluR5的mRNA表达水平。
1.4 统计学分析
应用SPSS 21.0统计软件进行数据分析,实验数据以表示。星形胶质细胞GFAP、AQP-4及mGluR5在蛋白水平和mRNA水平的比较均采用单因素方差分析及最小显著性差异法(least-significant difference,LSD)。显著性水平α=0.05。每组实验至少重复3次。
2 结果
2.1 星形胶质细胞的形态
GFAP是星形胶质细胞标志物[13],GFAP细胞免疫荧光染色结果表明,SFM、DMEM+FBS及SFM+FBS中的细胞免疫荧光染色均为阳性,证实为星形胶质细胞。星形胶质细胞在SFM中细胞折光性强,细胞核和胞体较小,细胞突起细长;在DMEM+FBS及SFM+FBS中,细胞折光性弱,呈多角扁平形,细胞突起短小,细胞核和胞体较大。见图1。
2.2 GFAP、AQP-4蛋白表达
不同培养基培养的星形胶质细胞GFAP和AQP-4蛋白水平有非常高度显著性差异(P<0.001),mGluR5水平无显著性差异(P>0.05)。DMEM+FBS和SFM+FBS中GFAP和AQP-4蛋白水平均显著低于SFM(P<0.001)。见图2、表2。
2.3 GFAP、AQP-4 mRNA表达
不同培养基培养的星形胶质细胞GFAP和AQP-4 mRNA水平有非常高度显著性差异(P<0.001),mGluR5 mRNA水平无显著性差异(P>0.05)。DMEM+FBS和SFM+FBS中GFAP和AQP-4的mRNA水平均显著低于SFM(P<0.001)。见表3。
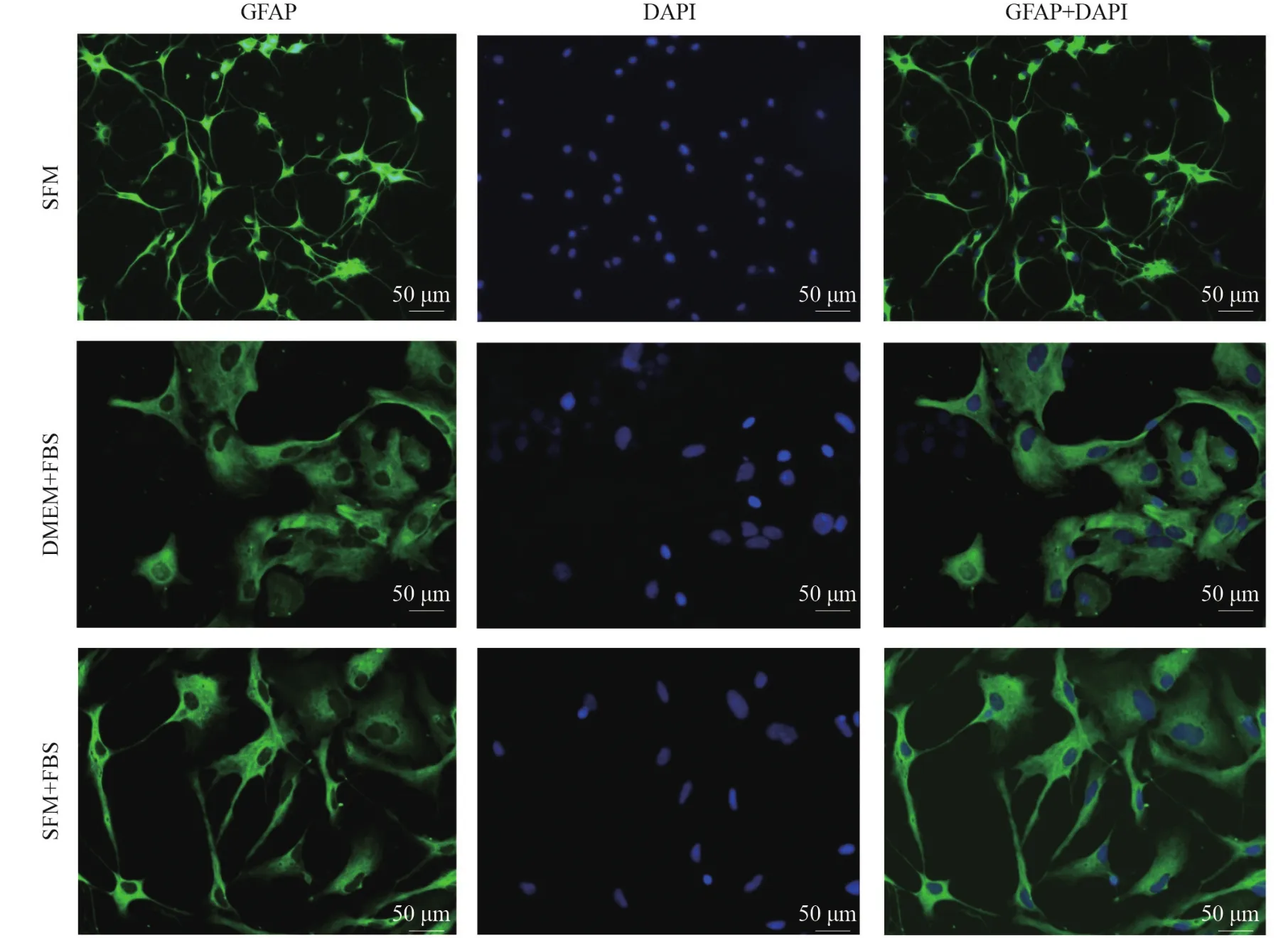
图1 各组GFAP免疫荧光染色(200×,bar=50 μm)
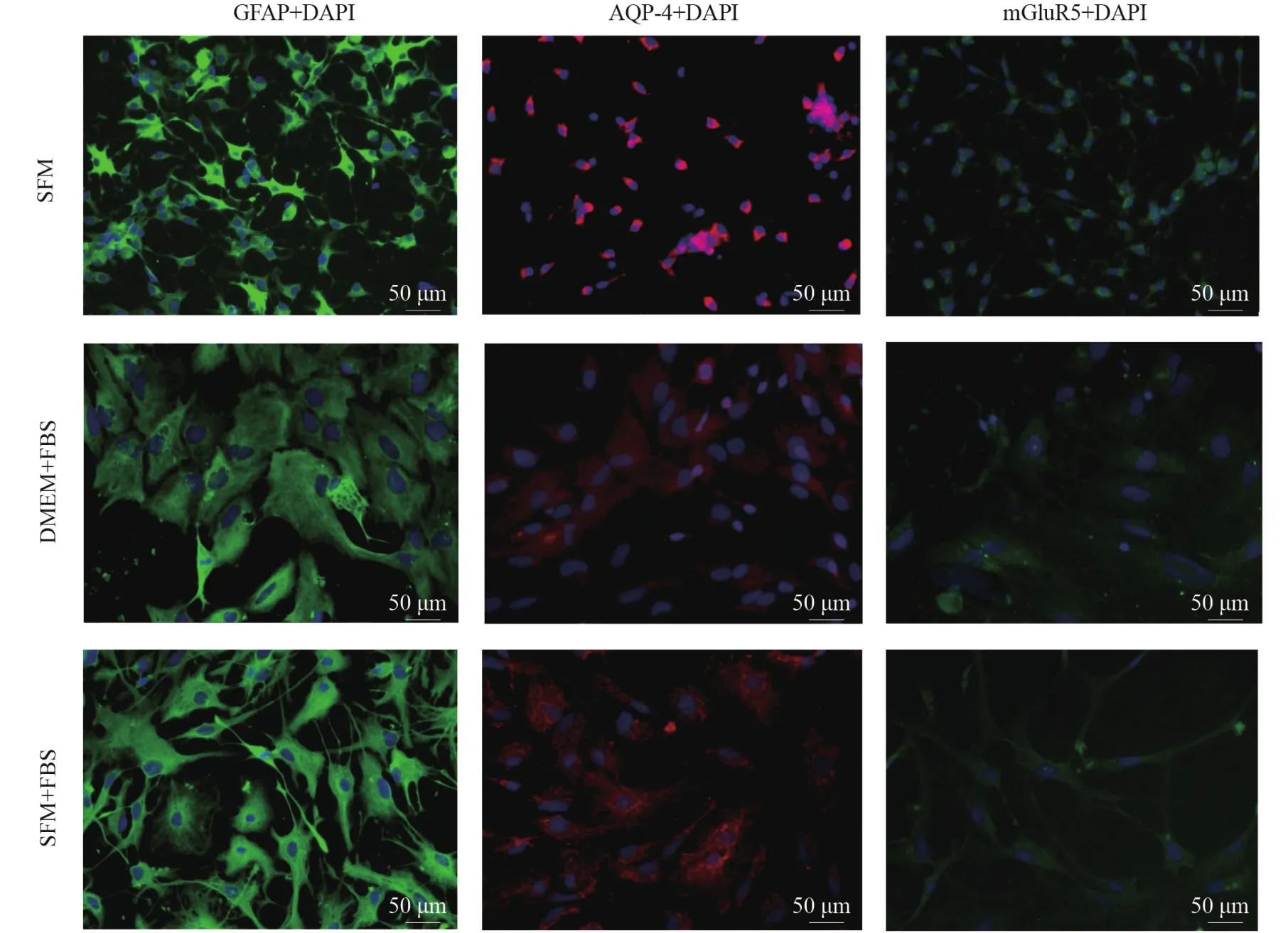
图2 各组GFAP、AQP-4及mGluR5免疫荧光染色(200×,bar=50 μm)
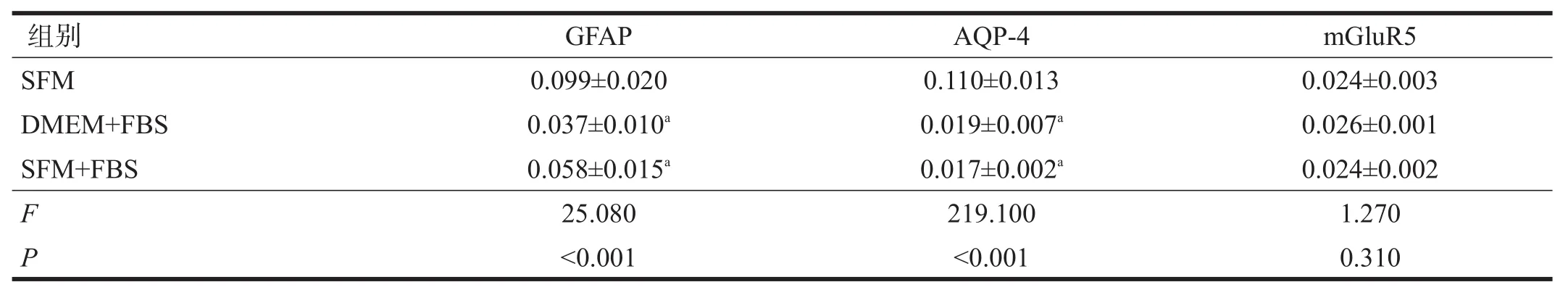
表2 不同血清培养的星形胶质细胞GFAP、AQP-4和mGluR5蛋白水平比较

表3 不同血清培养的星形胶质细胞GFAP、AQP-4和mGluR5 mRNA水平比较
3 讨论
脑外伤后首先出现BBB破坏所致的血管源性脑水肿,然后出现继发性的细胞毒性脑水肿[14]。在BBB功能障碍的病理情况下,渗出到血管外的血清是否对星形胶质细胞AQP-4表达有影响,目前并不清楚。本研究利用培养的星形胶质细胞发现,星形胶质细胞的形态、GFAP及AQP-4表达水平在无血清及有血清培养基中均不一致,同时设立的对照实验显示,无血清培养基添加FBS引起的星形胶质细胞形态变化、GFAP及AQP-4表达变化与有血清培养基相似,即星形胶质细胞形态由胞体小突起长变为胞体大突起短,同时GFAP及AQP-4表达降低,说明FBS直接改变星形胶质细胞形态、降低GFAP及AQP-4的表达。许多研究表明,在血管源性脑水肿中,星形胶质细胞AQP-4表达减少促进脑水肿的形成[14-15];本研究结果提示,脑外伤后BBB功能障碍引起的AQP-4表达降低,促进外伤性脑水肿的进展。
尸检及动物模型中均发现,脑外伤后星形胶质细胞出现水肿、肥大等形态改变[16]。我们的离体实验结果显示,培养基中添加血清后星形胶质细胞的胞体及细胞核均变大,细胞突起变短,这与脑外伤后脑组织标本中所见的星形胶质细胞形态相似。Foo等[17]及Zhang等[18]也报道,血清引起培养星形胶质细胞形态出现同样的变化。GFAP是星形胶质细胞主要的中间丝蛋白[19],在维持星形胶质细胞的结构和功能方面发挥重要作用[20]。本研究还发现血清降低星形胶质细胞GFAP的表达。本研究结果提示,在BBB破坏的病理情况下,血清蛋白是引起星形胶质细胞形态及功能改变的因素之一。
AQP-4在外伤性脑水肿中发挥重要作用。Kiening等[14]报道,在外伤性脑水肿模型中检测到AQP-4表达减少。Papadopoulos等[15]发现AQP-4基因敲除促进血管源性脑水肿模型的进展。本实验发现,在培养基中添加血清引起AQP-4表达降低。前期实验表明,细胞划痕损伤降低培养星形胶质细胞的AQP-4表达[21],因此我们的离体实验结果提示,脑外伤的直接损伤以及BBB破坏导致的血清蛋白漏出均直接导致AQP-4表达降低。在外伤性血管源性脑水肿中,组织内多余的水来自于BBB通透性增加,而非AQP-4介导的水转运,因此,血管源性脑水肿中AQP-4的减少导致星形胶质细胞调节水平衡能力下降,无法将组织内多余的水排出,加重脑水肿[15]。但是也有研究发现,在外伤性脑水肿模型中AQP-4表达增加[22-23]。现有实验中观察到的AQP-4表达变化不同,一方面可能与脑外伤模型的种类、损伤严重程度和损伤时间长短有关,另一方面可能与脑外伤后脑组织分泌多种炎症因子和凝血因子[24-25]、机体微环境发生复杂变化有关[26]。本研究在离体水平模拟研究BBB破坏后血清对星形胶质细胞AQP-4表达的影响,但是血清成分复杂,具体何种成分降低AQP-4表达仍有待进一步研究。
mGluR5是脑内兴奋性神经递质谷氨酸的代谢型受体中的一种亚型,在星形胶质细胞和神经元上均有表达[27]。蔡英等[9]在液压打击颅脑损伤模型中发现,脑外伤引起mGluR5表达减少。前期研究发现,星形胶质细胞上mGluR5参与谷氨酸引起AQP-4表达变化的调节[28],但是本研究未观察到血清对mGluR5表达的影响。目前mGluR5与AQP-4表达的关系及其在外伤性脑水肿中的作用研究很少,还有待深入探讨。
综上所述,本研究在无血清培养基中添加血清,部分模拟了脑外伤后BBB功能障碍的情况,发现血清直接改变星形胶质细胞形态和GFAP表达,并引起AQP-4的表达降低,因此可能促进血管源性脑水肿的发展,为更好地理解AQP-4在外伤性脑水肿中的作用提供了新的实验依据。最新研究发现促红细胞生成素(erythropoietin,EPO)可以通过恢复BBB结构和功能的完整性、阻止AQP-4表达降低而发挥治疗外伤性脑水肿的作用[29]。因此,以BBB及AQP-4为治疗靶点的研究将为外伤性脑水肿的临床治疗提供新的线索及方法。
]
[1]Alluri H,Wiggins-Dohlvik K,Davis ML,et al.Blood-brain barrier dysfunction following traumatic brain injury[J].Metab Brain Dis,2015,30(5):1093-1104.
[2]Stokum JA,Kurland DB,Gerzanich V,et al.Mechanisms of astrocyte-mediated cerebral edema[J].Neurochem Res,2015,40(2):317-328.
[3]崔向宁,尹岭,王玉来.水通道蛋白4在大鼠创伤性脑水肿中的作用机制[J].中国康复理论与实践,2005,11(9):719-721.
[4]Filippidis AS,Carozza RB,Rekate HL.Aquaporins in brain edema and neuropathological conditions[J].Int J Mol Sci,2016,18(1):55.
[5]Ding JY,Kreipke CW,Speirs SL,et al.Hypoxia-inducible factor-1alpha signaling in aquaporin upregulation after traumatic brain injury[J].Neurosci Lett,2009,453(1):68-72.
[6]Lopez NE,Krzyzaniak MJ,Blow C,et al.Ghrelin prevents disruption of the blood-brain barrier after traumatic brain injury[J].J Neurotrauma,2012,29(2):385-393.
[7]Lopez-Rodriguez AB,Acaz-Fonseca E,Viveros MP,et al.Changes in cannabinoid receptors,aquaporin 4 and vimentin expression after traumatic brain injury in adolescent male mice.Association with edema and neurological deficit[J].PLoS One,2015,10(6):e0128782.
[8]Zhao J,Moore AN,Clifton GL,et al.Sulforaphane enhances aquaporin-4 expression and decreases cerebral edema following traumatic brain injury[J].J Neurosci Res,2005,82(4):499-506.
[9]蔡英,黄慧玲,范维佳,等.颅脑创伤后期大鼠代谢型谷氨酸受体5表达变化及牛磺酸治疗作用[J].中国现代神经疾病杂志,2016,16(8):503-508.
[10]徐立新,董丽萍,师忠芳,等.体外培养大鼠星形胶质细胞水通道蛋白4的表达[J].中国康复理论与实践,2017,23(9):1051-1055.
[11]Foo LC.Purification of rat and mouse astrocytes by immunopanning[J].Cold Spring Harb Protoc,2013,2013(5):421-432.
[12]吴敏,方庆,师忠芳,等.亚甲基蓝对大鼠局灶性脑缺血再灌注后血脑屏障的保护作用[J].中国康复理论与实践,2016,22(2):125-131.
[13]Rajkowska G,Stockmeier CA.Astrocyte pathology in major depressive disorder:insights from human postmortem brain tissue[J].Curr Drug Targets,2013,14(11):1225-1236.
[14]Kiening KL,van Landeghem FK,Schreiber S,et al.Decreased hemispheric aquaporin-4 is linked to evolving brain edema following controlled cortical impact injury in rats[J].Neurosci Lett,2002,324(2):105-108.
[15]Papadopoulos MC,Manley GT,Krishna S,et al.Aquaporin-4 facilitates reabsorption of excess fluid in vasogenic brain edema[J].FASEB J,2004,18(11):1291-1293.
[16]Karve IP,Taylor JM,Crack PJ.The contribution of astrocytes and microglia to traumatic brain injury[J].Br J Pharmacol,2016,173(4):692-702.
[17]Foo LC,Allen NJ,Bushong EA,et al.Development of a method for the purification and culture of rodent astrocytes[J].Neuron,2011,71(5):799-811.
[18]Zhang Y,Sloan SA,Clarke LE,et al.Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse[J].Neuron,2016,89(1):37-53.
[19]Hol EM,Pekny M.Glial fibrillary acidic protein(GFAP)and the astrocyte intermediate filament system in diseases of the central nervous system[J].Curr Opin Cell Biol,2015,32:121-130.
[20]Middeldorp J,Hol EM.GFAP in health and disease[J].Prog Neurobiol,2011,93(3):421-443.
[21]Shi ZF,Zhao WJ,Xu LX,et al.Downregulation of aquaporin 4 expression through extracellular signal-regulated kinases1/2 activation in cultured astrocytes following scratch-injury[J].Biomed Environ Sci,2015,28(3):199-205.
[22]Lv Q,Fan X,Xu G,et al.Intranasal delivery of nerve growth factor attenuates aquaporins-4-induced edema following traumatic brain injury in rats[J].Brain Res,2013,1493:80-89.
[23]Piazza M,Munasinghe J,Murayi R,et al.Simulating vasogenic brain edema using chronic VEGF infusion[J].J Neurosurg,2017,127(4):905-916.
[24]Corps KN,Roth TL,McGavern DB.Inflammation and neuroprotection in traumatic brain injury[J].JAMANeurol,2015,72(3):355-362.
[25]Hun Lee J,Won S,Stein DG.Progesterone attenuates thrombin-induced endothelial barrier disruption in the brain endothelial cell line bEnd.3:The role of tight junction proteins and the endothelial protein C receptor[J].Brain Res,2015,1613:73-80.
[26]Logsdon AF,Lucke-Wold BP,Turner RC,et al.Role of microvascular disruption in brain damage from traumatic brain injury[J].Compr Physiol,2015,5(3):1147-1160.
[27]Panatier A,Robitaille R.Astrocytic mGluR5 and the tripartite synapse[J].Neuroscience,2016,323:29-34.
[28]Shi Z,Zhang W,Lu Y,et al.Aquaporin 4-mediated glutamate-induced astrocyte swelling is partially mediated through metabotropic glutamate receptor 5 activation[J].Front Cell Neurosci,2017,11:116.
[29]Blixt J,Gunnarson E,Wanecek M.Erythropoietin attenuates the brain edema response following experimental traumatic brain injury[J].J Neurotrauma,2018,35(4):671-680.

