轮虫、卤虫无节幼体及蝇蛆三种开口饵料对黄颡鱼仔鱼生长、存活及免疫酶活性的影响
隋延鸣 ,庄亚润 ,周凯 ,厉成新 ,来琦芳
(1.中国水产科学研究院东海水产研究所,中国水产科学研究院盐碱水域渔业工程技术中心,上海200090;2.上海市上海农场海丰水产养殖有限公司,江苏 盐城 224153)
鱼类仔鱼由内源性营养逐渐过渡到外源性营养,消化代谢能力发生了剧烈变化[1]。这一阶段鱼类极其敏感,容易死亡,为生活史中的“危险期”。多数鱼类在这一阶段为肉食性,然后才逐渐分化为各自的食性。这一阶段开口饵料是否适合、充足直接影响仔鱼的存活率[2]。目前关于经济鱼类开口饵料的研究报道较多。刘利平等(2017)比较了9种开口饵料对日本鳗鲡Anguilla japonica仔鱼存活率的影响,发现投喂以鲨鱼卵、磷虾提取液为基础的饵料和以鲨鱼卵、海蜇匀浆液为基础的饵料以及微绿球藻Nannochloris oculata液均提高了日本鳗鲡仔鱼的存活率[3];投喂营养加强的轮虫可以显著提高银汉鱼Chirostoma estor仔鱼的存活率[4]。探究适合仔鱼阶段的开口饵料是水产经济鱼类人工养殖的基础。
黄颡鱼Pelteobagrus fulvidraco刺少、肉质鲜美,雄鱼比雌鱼生长快,深受消费者的喜爱,全雄黄颡鱼养殖规模逐渐扩大。但是,在全雄黄颡鱼养殖过程中,仔鱼时期存活率低严重阻碍了全雄黄颡鱼养殖。目前黄颡鱼仔鱼的开口饵料主要为池塘培养的轮虫。培育轮虫常导致轮虫高峰提前或延迟,与鱼苗开口摄食时间不一致[5];轮虫过多容易败坏水质,与养殖物种争夺氧气。因此尝试其他开口饵料代替轮虫非常必要。卤虫初孵无节幼体卵黄含量高,含有丰富的蛋白质、脂肪和矿物质,在世界各国鱼虾蟹育苗生产中普遍应用[6]。蝇蛆Musca domestica vicina是一种高蛋白、高脂肪、氨基酸含量较全面的饲料资源和优质的动物的活饵料,被誉为“动物的营养宝库”。蝇蛆含有的抗菌肽、几丁质等具有调节免疫功能的生理活性物质,可以有效提高养殖物种的免疫水平[7]。本实验尝试以卤虫、蝇蛆匀浆为全雄黄颡鱼开口饵料,探究其对全雄黄颡鱼仔鱼生长生理的影响。
磷酸酶作为免疫系统中的非特异性磷酸单酯水解酶,依催化的最适pH分为酸性磷酸酶(ACP)和碱性磷酸酶(AKP)。酸性磷酸酶是生物体内磷代谢的重要酶类,除了参与磷酸酶的代谢外,还参与代谢调节、能量转换以及信号传导等重要生命活动;碱性磷酸酶是一类单酯磷酸水解酶,为一种膜结合金属糖蛋白,主要存在于鱼类前肠上皮细胞的浅部和纹状缘上,在碱性条件下催化无机和有机的磷酸酯水解,参与肠上皮细胞的吸收和转运,在机体防御和特定药物在养殖物种的代谢中发挥重要作用[8,9]。两种磷酸酶在鱼类处于不利环境时均会改变自身活性,对免疫系统进行调节[10]。溶菌酶是一类具有免疫保护作用的天然抗菌肽,在水产动物抵抗病原微生物感染中具有重要作用[11]。本实验以酸性磷酸酶、碱性磷酸酶以及溶菌酶为检测指标,探究卤虫以及蝇蛆匀浆对全雄黄颡鱼仔鱼生长生理的影响。
1 材料与方法
1.1 材料
实验在江苏省大丰市海丰渔场进行,实验用仔鱼为出膜后 4d的仔鱼,体长为(0.25±0.004)cm,健康且规格一致。所用开口饵料为轮虫、卤虫无节幼体及蝇蛆匀浆。轮虫为渔场人工捕捞,卤虫卵为美国大盐湖牌,蝇蛆购自江苏省南通希源特种养殖有限公司。
1.2 方法
将10 000尾全雄黄颡鱼仔鱼分为3组,放入长2m×宽1.4m×水深30cm的孵化槽中,分别投喂轮虫、卤虫无节幼体和蝇蛆匀浆。实验期间,每天8:00、19:00各投喂一次约20g湿重饵料,投喂1h后吸污,换水1/4。水温维持在(25±0.5)℃,溶解氧>6mg/L。实验共持续7d,在实验的第0d、第3d、第7d从每个孵化槽中取50尾鱼,测量体长和体质量。
在实验第0d、第3d、第7d每个水槽随机取6尾仔鱼,称量体质量后与生理盐水按质量体积比1∶9研磨成浆,在1 200r/min离心3min后取上清液,采用磷酸苯二钠法[12]测定磷酸酶活力,定义:每g组织蛋白在25℃与基质作用30min产生1mg酚为1个活力单位;溶菌酶活力采用南京建成生物工程公司试剂盒测定,试验步骤按说明书进行;采用考马斯亮蓝法测定各组蛋白含量。
1.3 数据处理
数据用SPSS 18.0统计软件进行统计分析,采用单因子方差分析(One-way,ANOVA)比较黄颡鱼仔鱼体长、体质量、磷酸酶活性等指标,并用邓肯多重检验比较各处理组间均值的差异。
2 结果与分析
2.1 仔鱼摄食不同饵料时的生长及存活率
由图1可知,投喂三种饵料3d后仔鱼体质量出现显著性差异。投喂卤虫无节幼体组仔鱼的体质量显著大于投喂轮虫组(P<0.05),而投喂蝇蛆组仔鱼体质量介于投喂卤虫无节幼体与投喂轮虫组之间,两组间无显著差别(P>0.05)。实验7d后,投喂蝇蛆组仔鱼体质量最大,其次为投喂卤虫无节幼体组,最后为投喂轮虫组,且投喂蝇蛆和卤虫无节幼体组体质量显著大于投喂轮虫组(P<0.05)。
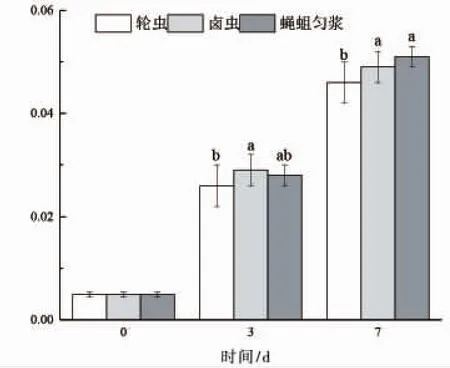
图1 仔鱼摄食不同开口饵料时的体质量Fig.1 Body weight of yellow catfish larvae fed various initial food
图2示三种饵料对仔鱼体长变化的影响。投喂3d后,全雄黄颡鱼仔鱼体长出现显著差异,投喂蝇蛆组和卤虫无节幼体组仔鱼体长显著大于投喂轮虫组(P<0.05),这一趋势一直保持到实验结束。

图2 仔鱼摄食不同开口饵料时的体长Fig.2 Body length of yellow catfish larvae fed various initial food
图3为摄食不同开口饵料的仔鱼的存活率。在实验第3d、第7d统计,投喂蝇蛆组和卤虫无节幼体组仔鱼的存活率显著高于投喂轮虫组(P<0.05),且投喂蝇蛆组仔鱼存活率最高。
2.2 不同饵料对仔鱼溶菌酶、ACP、AKP活力的影响
由图4可知,黄颡鱼仔鱼ACP活力随着个体增曾长逐渐升高,但在实验前期投喂不同饵料仔鱼ACP活力没有显著差异(P>0.05),直到第 7d时各组别间ACP活力才出现显著变化,投喂蝇蛆组ACP活力显著性大于其余两组(P<0.05)。
由图5可知,黄颡鱼仔鱼的AKP活力随着个体增长逐渐升高。投喂蝇蛆组仔鱼AKP活力从实验第3d开始显著高于其他两组,且一直保持到实验结束,而投喂轮虫和卤虫无节幼体组仔鱼AKP活力在整个实验过程中均无显著差别。
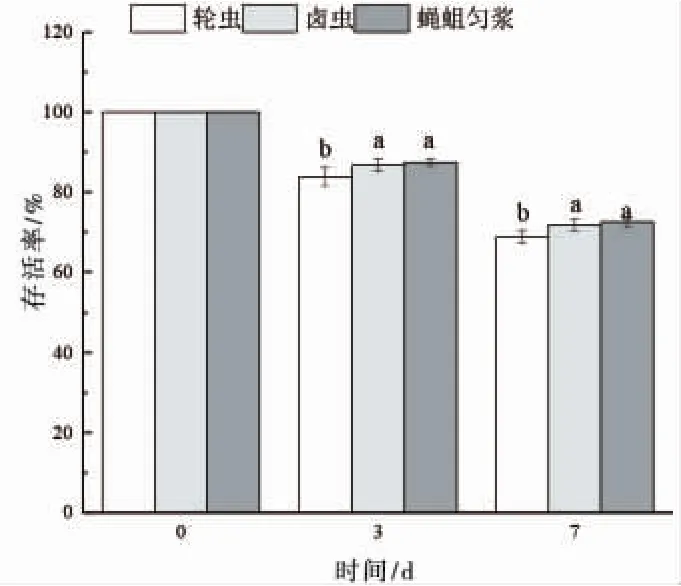
图3 仔鱼不同开口饵料时的存活率Fig.3 Survival rate of larvae fed various initial food
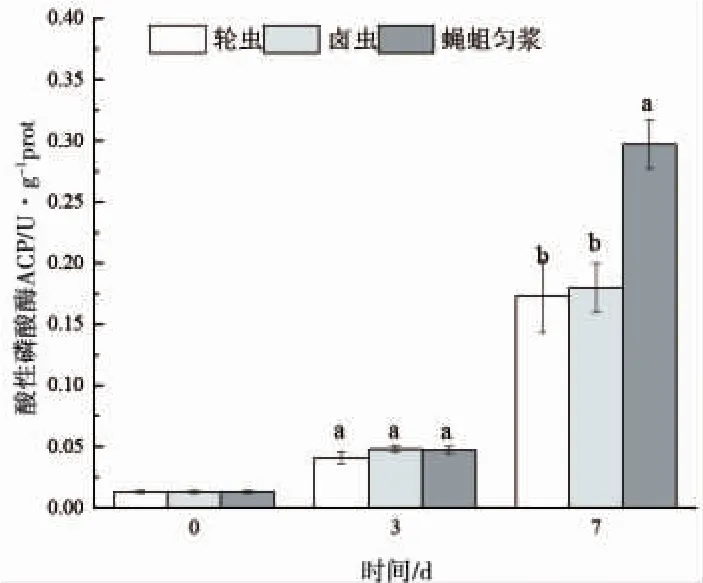
图4 仔鱼摄食不同开口饵料时的酸性磷酸酶活性Fig.4 ACP activity of larvae fed various initial food
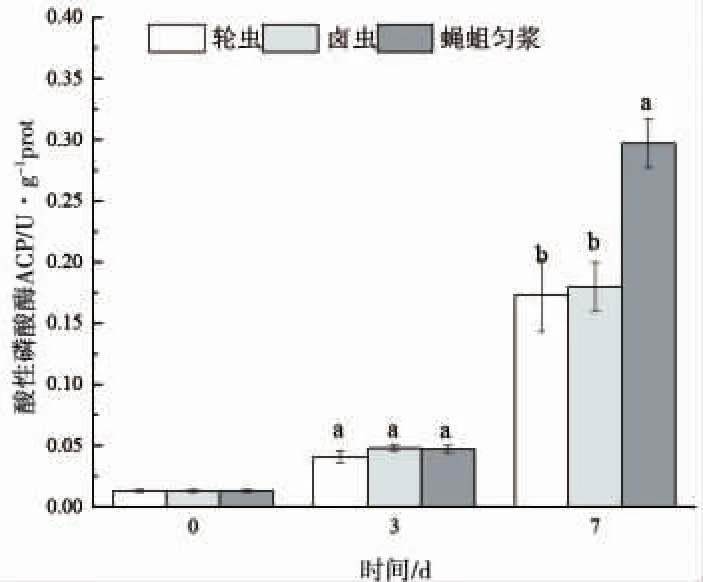
图5 仔鱼不同开口饵料时碱性磷酸酶的活性Fig.5 AKP activity of yellow catfish larvae fed various initial food
图6示三种饵料对仔鱼溶菌酶活性的影响。各实验组仔鱼LZM活力的变化趋势类似于AKP活力。同样,从实验的第3d开始投喂蝇蛆组仔鱼LZM活力显著高于其他两组(P<0.05),且一直保持到实验结束,而投喂轮虫和卤虫无节幼体组仔鱼LZM活力在整个实验过程中无显著差别(P>0.05)。

图6 仔鱼摄食不同开口饵料时的溶菌酶活性Fig.6 LZM activity of yellow catfish larvae fed various initial food
3 讨论
3.1 不同开口饵料对全雄黄颡鱼仔鱼生长性能的影响
近年来,围绕着水生动物开口时所需营养物质的研究逐步深入。吴文化等[13]研究了不同强化饵料对匙吻鲟Polyodon spathala仔鱼生长和发育的影响。结果表明,匙吻鲟仔鱼以桡足幼体为开口饵料驯化效果较好,特别是未强化桡足幼体组仔鱼的存活率高,鱼油强化桡足幼体组仔鱼生长速度较快,而以卤虫饲喂效果较差。何国森等[14]研究了蛋黄、轮虫、豆浆、脱脂奶粉、鳗鱼饲料、鱼粉和酵母粉等7种饵料对泥鳅misgurnus anguillicaudatus苗种前期培育生长和存活的影响。经过21d培育,泥鳅摄食不同饵料时生长速度和存活率存在显著差异(P<0.05),轮虫组生长速度较快,平均日增全长达0.31mm,且存活率最高,达到39.5%;其次是蛋黄组,达到25.5%;其他组存活率都较低。本实验发现,黄颡鱼仔鱼摄食蝇蛆匀浆、卤虫较投喂轮虫的生长速度和存活率显著上升。这说明与轮虫相比,蝇蛆匀浆和卤虫更适合作全雄黄颡鱼仔鱼的开口饵料。卤虫无节幼体含有丰富的EPA,可以提高鱼虾幼苗的存活率,作为海水鱼虾开口饵料自20世纪80年代起已广泛应用[6]。本实验中,用卤虫无节幼体投喂淡水黄颡鱼,同样提高了其存活率和生长性能,说明卤虫无节幼体作为淡水仔稚鱼的开口饵料有广阔的前景。蝇蛆富含蛋白和不饱和脂肪酸,且含有多种生命活动所需要的微量元素、抗菌肽、几丁质等多种有价值的成分[15],作为动物蛋白源在水产养殖中广泛应用。本实验首次使用蝇蛆匀浆作为全雄黄颡鱼开口饵料,黄颡鱼仔鱼存活率及生长显著高于轮虫组,说明蝇蛆匀浆在水产动物开口饵料中也有一定的潜力。
3.2 不同开口饵料对全雄黄颡鱼仔鱼生理指标的影响
磷酸酶是一类参与营养代谢、矿化作用、肠道转运和磷酸化蛋白水解的酶类,具有两个重要的功能:其一,参与磷酸化蛋白的胞内水解,所产生的无机磷用于能量代谢(酸性磷酸酶);其二,参与营养物质从膜到细胞内的转运,即吸收过程(碱性磷酸酶)。此外磷酸酶还可通过对其他消化酶进行磷酸化修饰提高其酶活力和消化能力。研究表明,磷酸酶活力快速增加时预示着肠道发育成熟,因此磷酸酶活力作为机体功能性酶在动物个体发育过程中往往作为指示指标,直接反映个体发育水平和健康水平[16,17]。对胚胎发育的研究发现,点纹斑竹鲨Chiloscyllium punctatum碱性磷酸酶活力随着个体发育而活力逐渐增强[17]。类似的结果同样出现在匙吻鲟仔稚鱼中。吉红等[18]发现,匙吻鲟仔稚鱼肠道酸性磷酸酶和碱性磷酸酶活性随着发育时间的延长逐渐升高,分别于受精后30d和40d达到最大值。本实验发现投喂三种饵料7d后,投喂蝇蛆组的黄颡鱼仔鱼碱性磷酸酶和酸性磷酸酶活性显著高于其他两组,这说明蝇蛆匀浆有助于全雄黄颡鱼消化系统的发育。
溶菌酶作为鱼类的非特异性免疫物质之一,在机体的炎症过程、修复再生、杀灭细菌等调节中发挥重要作用[19,20]。张婷婷等[21]在凡纳滨对虾Litopenaeus vannamei饲料中分别添加了四种蛋白水解物替代配方中10%的鱼粉,配制成五组等氮等脂的饲料。结果添加鱼蛋白水解物的饲料凡纳滨对虾生长速度以及血清溶菌酶活力显著高于其他组,这说明不同的饲料蛋白源会直接影响对虾的溶菌酶活力。本实验中,投喂蝇蛆匀浆的全雄黄颡鱼仔鱼溶菌酶活力显著高于卤虫无节幼体组和轮虫组,说明不同饵料同样可以影响黄颡鱼溶菌酶活力水平。黄颡鱼仔鱼易感染各种细菌性疾病(肠炎病、水肿病)造成大量死亡[22],而投喂蝇蛆匀浆可以提高仔鱼的溶菌酶活力,提升免疫水平,这将有助于提高黄颡鱼仔鱼的抗病能力。
综上所述,认为与轮虫和卤虫无节幼体相比,使用蝇蛆匀浆作为全雄黄颡鱼开口饵料更有助于黄颡鱼仔鱼的养殖。
[1]Mitra A,Mukhopadhyay P K&Homechaudhuri S.Histomorphological study of the gut developmental pattern in early life history stages of featherback,Chitala chitala(Hamilton)[J].Archives ofPolish Fisheries,2015,23(1):25-35.
[2]朱成德.仔鱼的开口摄食期及其饵料综述[J].水生生物学报,1986,10(1):86-95.
[3]刘利平,刘登攀,蒲金成,等.日本鳗鲡仔鱼的开口饵料和行为特征[J].水产学报,2017,41(5):703-710.
[4]Ríos-Durán MG,Navarrete-Ramírez P,Fonseca-Madrigal J,et al.Optimizinginitial feedingofthe pike silverside Chirostoma estor:oil droplet depletion,point of no return,growth and fatty acid utilization in larvae fed enriched rotifers[J].Aquaculture Nutrition,2016,22(3):517-526.
[5]黄权,姜夙,齐科翀,等.投喂卤虫无节幼体条件下黄颡鱼仔稚鱼生长、存活率、摄食力和体成分的变化[J].中国水产科学,2012,12(6):1034-1042.
[6]朱地琴,吴旭干,潘迎捷,等.土池肥水培育的生物饵料与卤虫无节幼体的脂类及脂肪酸组成的比较研究[J].上海海洋大学学报,2007,16(5):448-453.
[7]朱绍辉,张国雨,王晓丽,等.蝇蛆的营养价值及在水产养殖方面的应用[J].饲料研究,2012(4):59-61.
[8]李芹,唐洪玉.中华倒刺鲃仔稚鱼期消化酶及碱性磷酸酶活性变化的研究[J].水生态学杂志,2010,3(5):82-85.
[9] Cheng L,Chen Y,Zheng Y Y,et al.Bioaccumulation of sulfadiazine and subsequent enzymatic activities in Chinese mitten crab(Eriocheir sinensis)[J].Marine Pollution Bulletin,2017,121(1-2):176-182.
[10]de Mora S,Sheikholeslami MR,Wyse E,et al.An assessment of metal contamination in coastal sediments of the Caspian Sea[J].Marine Pollution Bulletin,2004,48(1-2):61-77.
[11]徐永平,汪婷婷,孙永欣,等.水产动物溶菌酶研究的最新进展[J].水产科学,2011,30(5):307-310.
[12]王书平,孔祥会,江红霞,等.金鱼胚胎发育过程中磷酸酶活性的变化[J].水产科学,2011,30(7):405-408.
[13]吴文化,张秀娟,宋聃,等.不同饵料对匙吻鲟仔鱼生长发育和消化酶活性的影响[J].动物学杂志,2015,50(4):571-580.
[14]何国森,陈度煌,曾占壮,等.不同饵料对泥鳅苗种前期培育效果的研究[J].渔业研究,2015,37(1):62-67.
[15]徐丽兰,单安山,陈鹏.无菌蝇蛆在饲料领域中的应用及研究进展[J].中国畜牧兽医,2010,37(11):16-19.
[16] Pimentel M S,Faleiro F,Diniz M,et al.Oxidative stress and digestive enzyme activity offlatfish larvae in a changingocean[J].PLoSOne,2015,10(7):e0134082.
[17]Rosa R,Pimentel M,Galan J G,et al.Deficit in digestive capabilities of bamboo shark early stages under climate change[J].Marine Biology,2016,163(3):60.
[18]吉红,孙海涛,田晶晶,等.匙吻鲟仔稚鱼消化酶发育的研究[J].水生生物学报,2012,36(3):457-465.
[19]Li Y,Li J,Lu J,et al.Effects of live and artificial feeds on the growth,digestion,immunityand intestinal microflora of mandarin fish hybrid(Siniperca chuatsi♀ × Siniperca scherzeri ♂)[J].Aquaculture Research,2017,48(8):4479-4485.
[20]栾鹏,王荻,李绍戊,等.三种复方中草药对鲫血清、肝胰脏及脾脏中溶菌酶活性的影响[J].水产学杂志,2012,25(1):46-48,57.
[21]张婷婷,陈效儒,梁萌青,等.不同来源的蛋白水解物对凡纳滨对虾生长及非特异性免疫的影响[J].饲料工业,2016,37(12):15-20.
[22]江海龙,甘小顺,王永杰,等.全雄黄颡鱼常见疾病防控技术[J].现代农业科技,2015(21):280-281.

