高通量测序法对剑南春大曲真菌群落结构的分析
徐占成,徐姿静,刘孟华,唐清兰
(四川剑南春集团有限责任公司,四川绵竹618200)
曲为“酒之骨”,大曲作为我国传统大曲酒酿造的糖化、发酵、生香剂,是我国传统酿造的特征与精华之所在[1]。剑南春作为中国浓香型白酒的典型代表,其生产用曲采用自然接种、开放式发酵生产,导致大曲中微生物种类繁多,群系复杂,采用传统的分离培养方法研究,将会遗漏很多微生物种类,其中甚至可能有关键性功能微生物[2-3]。
宏基因组学作为一种研究环境样品中的微生物总基因组信息的新的微生物研究方法,能通过微生物总基因组信息来反映群落的生物多样性、种群结构、功能活性、相互协作关系及与环境之间的关系[4]。该技术已在许多领域应用,在“肠道微生物”[5]“土壤微生物”[6]和“海洋微生物”[7]方向上取得了显著成就。为认识环境微生物群落结构及筛选新基因提供了一条新的方法和思路。
前期本课题组利用宏基因组学的16S rDNA V4区高通量测序对剑南春大曲细菌多样性进行了系统研究。为了更加深入的探索大曲糖化生香机理,本研究以剑南春大曲曲药为研究对象,通过大曲总DNA的提取、PCR扩增及构建ITS基因文库,对剑南春大曲真菌群落组成进行了全面研究,为进一步解析剑南春大曲的功能微生物、筛选优良酿造微生物提供坚实的理论依据。
1 材料与方法
1.1 实验材料
剑南春集团有限公司的中温大曲曲药(由剑南春集团公司提供),MO BIO强力土壤DNA提取试剂盒(MO BIO Laboratories,Carlsbad,CA,USA),其他分子实验耗材(由上海生工提供)。
1.2 实验方法
1.2.1 基因组DNA提取
采用MO BIO强力土壤DNA提取试剂盒(MO BIO Laboratories,Carlsbad,CA,USA)对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳和Nanodrop检测DNA的纯度和浓度,取适量的样品于离心管中,使用无菌水稀释样品至10 ng/μL,保存在-40℃冰箱中以备后续实验使用。
1.2.2 PCR扩增
以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物和高效高保真的酶(TaKaRa,Dalian)进行PCR,确保扩增效率和准确性。
引物对应区域[8]:
ITS4(5'-TCCTCCGCTTATTGATATGC-3');
gITS7F(5'-GTGARTCATCGARTCTTTG-3')。
PCR反应体系(25 μL)的组成:
10 × PCR buffer 2.5 μL,MgCl2(25 mM)6 μL,10 mM dNTP mix 1 μL,双向引物(10 μM)2 μL,Taq DNA聚合酶(TaKaRa,Dalian)0.5 U,无菌去离子水补足至25 μL。PCR扩增程序:94℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,68 ℃延伸45 s,34个循环;72℃延伸10 min。每个样品做2个PCR扩增平行样,最后根据PCR产物浓度进行等量混样。
1.2.3 PCR产物纯化和定量
PCR产物使用1%浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等量混样,充分混匀后使用1%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用生工公司提供的胶回收试剂盒(Sangon Biotech,China,Cat#SK8132)回收产物,并用Nanodrop进行浓度和质量的测定。
1.2.4 文库构建和上机测序
使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和qPCR定量,文库合格后,使用v2测序试剂盒(2×250 bp)和Miseq测序仪进行上机测序。
1.3 生物信息学分析
1.3.1 Alpha多样性分析
Alpha Diversity用于分析样品内(Within-community)的微生物群落多样性,通过单样品的多样性分析(Alpha多样性)可以反映样品内的微生物群落的丰富度和多样性,包括用稀释曲线和一系列统计学分析指数来评估各样品中微生物群落的物种丰富度和多样性。
1.3.2 Beta多样性分析
Beta多样性指沿环境梯度不同生境群落之间物种组成的相异性或物种沿环境梯度的更替速率,也被称为生境间的多样性。
2 结果和分析
2.1 Alpha多样性指数表(表1)

表1 Alpha多样性指数(测序深度5786条序列/样品)
从表1可以看出:3个大曲样品的Chao1丰富度指数在37~43范围内变化;Shannon指数(Index)在3.039~1.889范围内变化;Simpson指数,其值的变化范围介于0.567~0.795间。其中,最大值均出现在2号大曲,最小值由1号大曲检测取得。三大指数检测表明在大曲真菌多样性方面:2号大曲>3号大曲>1号大曲。
2.2 群落组成分析
2.2.1 门水平大曲样品群落组成图
基于微生物ITS基因,对检测样品的有效序列进行聚类,以97%的序列相似性将序列在门水平上聚类成为OTU,其结果见图1。图1表明,在3类大曲中,Ascomycota、Zygomycota、Basidiomycota 3类微生物占绝对优势,相对丰度总和均超过90%。其中,1号大曲中,3类微生物相对丰度总和最高,达到95.65%;而在2号大曲中,3类微生物相对丰度总和最低,为90.88%。由此可见,基于ITS基因的门水平分析结果,上述3类微生物是剑南春大曲中的优势微生物。

图1 大曲样品群落组成图(门水平)
在所研究样品中,Ascomycota的相对丰度于30.07%~60.18%的范围内变化。其中,最大值在1号大曲中获得;最小值在2号大曲中获得。利用方差分析(ANOVA)对3个不同大曲Ascomycota相对丰度的差异显著性进行检验,结果表明,不同大曲中该类微生物的相对丰度差异并不显著(p>0.05)。
从Zygomycota相对丰度值分析,其变化范围介于28.22%~60.44%之间。其中,在2号大曲中,该类微生物的相对丰度最高,而在1号大曲中最低。而Basidiomycota相对丰度值分析发现,3个大曲相对丰度值差距不大(<0.2%)。
对3类优势微生物的总相对丰度进行方差分析,结果发现,不同大曲间并不存在显著差异(p>0.05)。由此可见,基于ITS基因的群落分析表明,剑南春大曲的优势微生物,其相对丰度并无显著差别。
2.2.2 科水平大曲样品群落组成图
利用数据库聚类,在科水平上对不同大曲中微生物的种类进行分析,其结果见图2。

图2 大曲样品群落组成图(科水平)
从科的水平分析结果表明,在3类大曲中,Mucoraceae、Saccharomycopsidaceae、Trichocomaceae及Thermoascaceae 4类微生物占均对优势,相对丰度总和均超过85%。其中,1号大曲4类微生物相对丰度总和最高,达到93.69%;而在2号大曲中,3类微生物相对丰度总和最低,为86.65%。由此可见,基于ITS基因的科水平分析结果,上述4类微生物是剑南春大曲中的优势微生物。
从各科分析来看:2号大曲,在Mucoraceae的相对丰度值最高达到60.44%,1号和3号分别为28.22%、32.92%;1号大曲在Saccharomycopsidaceae有最大相对丰度值,为61.15%,2号大曲有最小值16.44%;而在Trichocomaceae及Thermoascaceae分布上3号大曲占据优势。
对4类优势微生物的总相对丰度进行方差分析,结果发现,不同大曲间并不存在显著差异(p>0.05)。由此可见,基于ITS基因的群落科水平分析表明,剑南春大曲的优势微生物,其相对丰度并无显著差别。
2.2.3 属水平大曲样品群落组成图
利用数据库聚类,在属水平对不同大曲中微生物的种类进行分析,其结果见图3。
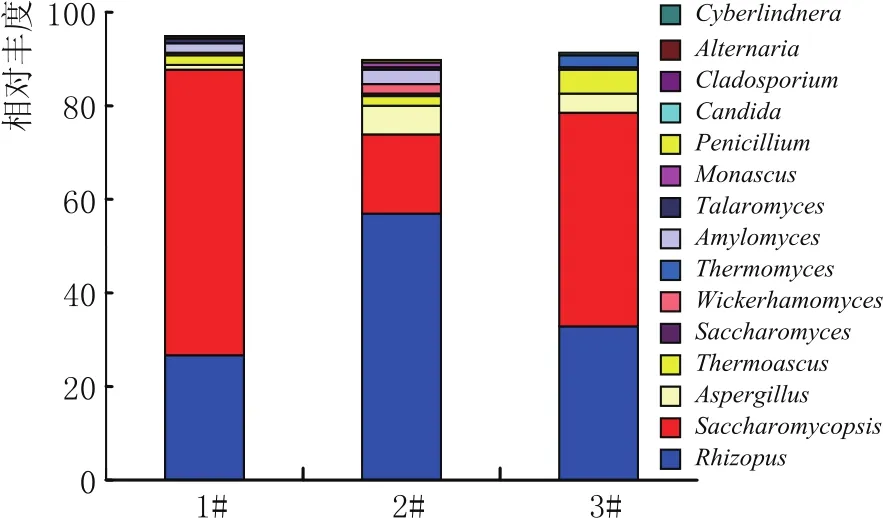
图3 大曲样品群落组成图(属水平)
根据各属的相对丰度值,选择数值最高的前10类微生物进行展示,分别为:Rhizopus、Saccharomycopsis、Aspergillus、Thermoascus、Saccharomyces、Wickerhamomyces、Thermomyces、Amylomyces、Talaromyces、Monascus。
在所有样品中,Rhizopus的相对丰度值介于26.51%~57.17%之间。其中,最小值在1号大曲获得;最大值在2号大曲获得。方差分析(ANOVA)表明,不同大曲间的Rhizopus相对丰度并无显著差异(p>0.05)。
Saccharomycopsis的相对丰度在16.44%~61.15%范围内变化。其中,最小值在2号大曲获得;最大值则在1号大曲获得。根据方差分析(ANOVA),结果表明不同大曲间Saccharomycopsis的相对丰度并无显著差异(p>0.05)。
Aspergillus的相对丰度在1.19%~6.22%范围内变化。其中,最小值在1号大曲获得;最大值则在2号大曲获得。根据方差分析(ANOVA),结果表明不同大曲间Aspergillu的相对丰度并无显著差异(p>0.05)。
Thermoascus在检测大曲样品中的相对丰度值介于1.711%~5.081%之间。其中,最小值由1号大曲获得;最大值由3号大曲获得。经方差分析(ANOVA),结果表明,大曲间的Thermoascus相对丰度并无显著差异(p>0.05)。
由此可见,基于ITS基因的群落属水平分析表明,剑南春大曲的优势真菌群落多样性分布在Rhizopus、Saccharomycopsis、Aspergillus、Thermoascus、Saccharomyces、Wickerhamomyces、Thermomyces、Amylomyces、Talaromyces、Monascus。这与前期采用PCR-DGGE技术研究结果相符[3]。
3 结论
剑南春大曲中真菌群落结构多样性的研究结果表明,剑南春大曲的优势真菌多样性分布,从门水平说集中在Ascomycota、Zygomycota、Basidiomycota,相对丰度总和超过90%;从科水平说集中在Mucoraceae、Saccharomycopsidaceae、Trichocomaceae及Thermoascaceae,4类微生物相对丰度总和超过80%;从属水平说主要分布在Rhizopus、Saccharomycopsis、Aspergillus、Thermoascus、Saccharomyces、Wickerhamomyces、Thermomyces、Amylomyces、Talaromyces、Monascus。
霉菌、酵母是白酒生产不可或缺的优良菌种,霉菌能产生丰富的葡萄糖淀粉酶,因而可以将原料中的淀粉直接降解为酵母菌可利用的还原糖,进而刺激酵母菌的生长,同时促进原料中的碳源向发酵终端产物酒精的代谢。胡承等[9]对浓香型大曲制曲过程中微生物的变化规律进行了研究,其结果表明,出房大曲中霉菌主要是根霉和曲霉。高亦豹[10]通过对不同工艺大曲酵母26S rRNA区基因DGGE图谱分析发现,扣囊复膜孢酵母、异常威克汉姆酵母普遍存在于大曲中。本研究利用高通量测序法分析优势菌种与他们的结果相符,而又更为全面,是对剑南春浓香型大曲真菌群落较为客观真实的解析。
参考文献:
[1]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2009:46-48.
[2]高亦豹,王海燕,徐岩.利用PCR-DGGE未培养技术对中国白酒高温和中温曲药细菌群落结构的分析[J].微生物学通报,2010(7):999-1004.
[3]徐占成,唐清兰,刘孟华,等.剑南春大曲曲药真菌群落结构的分析[J].酿酒,2015,42(4):13-16.
[4]唐婧,苏迪,徐小蓉,等.基于宏基因组学的茅台酒酒曲细菌的多样性分析[J].贵州农业科学,2014,42(11):180-183.
[5]YOUSSEF N,SHEIK C S,KRUMHOLZ L R,et al.Comparison of species richness estimates obtained using nearly complete fragments and simulated pyrosequencing-generated fragments in 16S rRNA genebased environmental surveys[J].Applied and environmental microbiology,2009,75(16):5227-5236.
[6]LANG K S,ANDESON J M,SCHWARZ S,et al.Novel florfenicol and chloramphenicol resistance gene discovered in Alaskan soil by using functional metagenomics[J].Applied and environmental microbiology,2010,76(15):5321-5326.
[7]KENNEDY J,FLEMER B,JACKSON S A,et al.Marine metagenomics:new tools for the study and exploitation of marine microbial metabolism[J].Marine drugs,2010,8(3):608-328.
[8]BOKULICH N A,MILLS D A.Improved selection of internal transcribed spacer-specific primers enables quantitative,ultra-high-throughput profiling of fungal communities[J].Applied and environmental microbiology,2013,79(8):2519-2526.
[9]胡承,邬捷锋,沈才洪,等.浓香型(泸型)大曲的研究及其应用[J].酿酒科技,2004(1):33-36.
[10]高亦豹.聚合酶链式反应-变性梯度电泳技术(PCRDGGE)研究中国白酒大曲中微生物群落结构[D].无锡:江南大学,2010.

