亚甲蓝对高原低氧脑损伤的保护作用研究
巩生辉何云凌赵名赵彤成祥吴奎武范明吴丽颖朱玲玲
高原低氧脑损伤是由低氧等多种高原环境因素对脑组织造成的一系列损伤综合征。近年来多项研究从不同方面部分阐述了其致病机制,如低氧刺激所致的脑血流动力学改变[1]、氧化应激学说[2]以及炎性介质的活化[3-4]等,但高原低氧所致脑损伤的具体病理生理机制还不十分清楚。因此,目前对高原低氧脑损伤治疗仍缺乏特异性方法。
亚甲蓝(methylene blue,MB)是一种人工合成的含有3个杂环的芳香族噻嗪类化合物,鉴于最初的活体内注射研究发现它可以特异性染色神经组织,随后多项研究发现亚甲蓝对异环磷酰胺所致脑病[5]、阿尔茨海默病[6]以及缺血性脑损伤[7]等多种脑损伤具有脑组织保护作用,其作用机制可能通过其自身的氧化-还原特性改善线粒体功能,维持细胞内稳态。本文作者前期实验研究发现,MB可通过诱导线粒体自噬而对大鼠缺血性脑损伤具有脑组织保护作用[7],但MB对高原缺氧引起的脑损伤是否具有脑组织保护作用尚不清楚。因此,本研究利用高原低氧模拟舱建立高原低氧脑损伤模型,评价高原低氧对脑组织的损伤情况以及MB对损伤脑组织的保护作用,并初步探索MB的脑组织保护机制。
1 材料和方法
1.1材料
1.1.1实验药品、试剂以主要仪器:脂多糖(lipopolysaccharide,LPS)、自噬蛋白轻链3(autophagy marker light chain 3, LC3)抗体、β-actin抗体(Sigma公司,美国),MB(Amresco公司,美国),B淋巴细胞-2结合蛋白1(Bcl-2 binding protein 1, Beclin1)抗体(BD公司,美国),电子密天平(上海天平仪器厂),低压低氧实验动物舱(DYC-DWY,贵州风雷航空军械有限责任公司,中国),Morris 水迷宫动物行为学分析系统(北京鼎大软件技术有限公司,中国)。
1.1.2实验动物:健康、雄性的SPF 级C57BL/6小鼠(体质量22~24 g)75只,购自北京维通利华实验动物有限公司,许可证号SCXX(京)2012-0001。小鼠饲养于恒温(22±2 ℃)、昼夜节律12/12 h的动物室中,小鼠可自由取食水。
1.2方法
1.2.1脑组织含水量测定:(1)处理及分组:35只健康雄性C57BL/6小鼠随机分为常氧组、低氧组和低氧+亚甲蓝组,其中低氧+亚甲蓝组按体质量设0.1、0.2、0.5、1.0和2.0 mg/kg[8]5个MB浓度组,共计7个组,每组5只。低氧组和低氧+亚甲蓝组小鼠在低压低氧前30 min按体质量0.5 mg/kg[4]给予腹腔注射LPS;常氧组小鼠给予腹腔注射等体积生理盐水作为对照;30 min后,低氧+亚甲蓝组小鼠给予MB注射,随后将低氧组和低氧+亚甲蓝组小鼠置于低压低氧实验动物舱,以10 m/s的上升速度模拟海拔6000 m持续低压低氧6 h。实验过程中未出现小鼠死亡。低压低氧舱内的温度和湿度分别保持在20~24℃和40%~50%,小鼠可自由取食饮水。常氧组小鼠置于低氧舱外的正常环境中,可自由取食饮水。
(2)脑组织含水量测定:低压低氧处理结束后,将经常氧组及低氧组和低氧+亚甲蓝各组小鼠给予1%(体积浓度)戊巴比妥钠腹腔注射麻醉,快速颈椎脱臼获取脑组织,置于已称重的小玻璃瓶中,计量脑组织湿重(精确到0.001 g),然后在100℃电热恒温箱中烘烤24 h,计量脑组织干重。根据Elliot公式计算脑组织含水量,即脑组织含水量=(湿重-干重)/湿重×100%[9]。选取脑组织含水量降低最明显的MB剂量用于后续实验。
1.2.2脑组织病理学和自噬活性观察:(1)Morris水迷宫实验:40只小鼠先进行隐蔽平台训练以获得学习和记忆,训练结束后随机分为常氧组、常氧+亚甲蓝组、低氧组以及低氧+亚甲蓝组4组,每组10只。低氧组和低氧+亚甲蓝组小鼠给予腹腔注射0.5 mg/kg LPS,常氧组和常氧+亚甲蓝组小鼠给予等体积生理盐水;30 min后,常氧+亚甲蓝组和低氧+亚甲蓝组小鼠按体质量给予腹腔注射0.5 mg/kg MB,常氧组和低氧组给予等体积生理盐水,然后将低氧组和低氧+亚甲蓝组小鼠置于低压低氧实验动物舱,以10 m/s的上升速度模拟海拔6000 m持续低压低氧6 h。观察低压低氧对小鼠的学习记忆的损伤情况以及MB对低压低氧引起的小鼠学习记忆损伤的保护作用。低压低氧期间未出现小鼠死亡情况。低压低氧处理结束后,进行空间探索实验,从任一入水点将4组小鼠依次面向池壁放入水中,记录小鼠在60 s内穿越靶标的次数、潜伏期、小鼠在靶标象限的运动时间和距离以及小鼠的运动速度。
(2)脑组织病理学观察:Morris水迷宫结束后,每组选3只小鼠取新鲜脑组织,以4%(质量浓度)多聚甲醛固定24 h后,酒精脱水、石蜡包埋,脑组织制成4 μm切片后于60℃恒温烤干切片。然后经二甲苯和酒精梯度脱水,充分冲洗,苏木素-伊红染色,然后盐酸乙醇分化,流水冲洗。切片随后经酒精梯度85%-90%-95%-100%(体积分数)逐级脱水和二甲苯透明,最后封片。切片于光学显微镜下放大200倍观察病理改变,并拍摄图片。
(3)Western blot检测脑组织自噬活性:Morris水迷宫实验结束后,各组选取3只小鼠分离新鲜皮质,用RIPA裂解液(含2%蛋白酶抑制剂)裂解组织,4℃离心后取上清定量,制备蛋白上样缓冲样品。然后按电泳-电转-封闭-一抗-二抗-显影Western blot常规步骤进行实验。主要一抗稀释比例:Beclin1 1∶1000,LC3 1∶5000,β-actin 1∶10000,二抗稀释比例均为1∶5000。将Beclin1和LC3的表达X线片进行扫描拍片,Image J软件分析计算Beclin1/β-actin和LC3Ⅱ/LC3Ⅰ的灰度值,并进行分析。
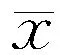
2 结果
2.1各组小鼠脑含水量比较亚甲蓝剂量筛选结果显示:与常氧组〔(78.42±0.01)%〕相比,低氧组小鼠脑组织含水量明显升高〔(78.62±0.01)%,P<0.01)〕;与低氧组相比,低氧+亚甲蓝不同剂量组小鼠脑组织含水量〔亚甲蓝0.1 mg/kg组(78.57±0.01)%, 0.2 mg/kg组(78.53±0.02)%, 0.5 mg/kg组(78.44±0.02)%, 1.0 mg/kg组(78.52±0.01)%,2.0 mg/kg组(78.54±0.02)%〕呈现不同程度的减轻(均P<0.01)。而低氧+亚甲蓝各剂量组中,低氧+亚甲蓝0.1 mg/kg组(P<0.01)、低氧+亚甲蓝0.2 mg/kg组(P<0.01)、低氧+亚甲蓝1.0 mg/kg组(P<0.05)以及低氧+亚甲蓝2.0 mg/kg组(P<0.05)小鼠脑组织含水量均高于低氧+亚甲蓝0.5 mg/kg组。因此,选取0.5 mg/kg MB用于后续实验。
2.2MB改善低压低氧造成的小鼠空间记忆能力的减退在连续6天的隐蔽平台实验中,小鼠表现出明显的学习效应,随着训练天数的延长,小鼠找到平台的时间,即潜伏期明显缩短(图1)。
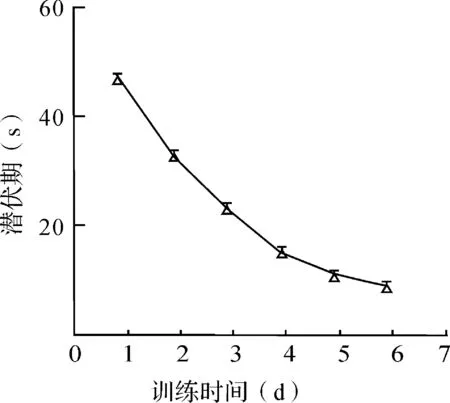
图 1 隐蔽平台实验训练期间小鼠潜伏期变化
在空间探索实验中,与常氧组比较,常氧+亚甲蓝组小鼠穿越靶标的次数增加(表1,P<0.05),潜伏期略有缩短但差异无统计学意义;在靶标象限的运动时间、距离延长及运动速度差异无统计学意义。与常氧组比较,低氧组小鼠的空间记忆能力以及运动能力明显受损,表现为小鼠穿越平台的次数明显减少(P<0.01)、运动距离明显缩短(P<0.01),运动速度明显减慢(P<0.05),小鼠潜伏期延长,在靶标象限的运动时间有所减少,但均无统计学差异。与低氧组小鼠相比,低氧+亚甲蓝组(0.5 mg/kg)小鼠潜伏期缩短但差异无统计学意义,穿越靶标的次数明显增加(P<0.05),在靶标象限的运动距离延长(P<0.05)。具体结果见表1。
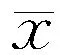
表1 4组小鼠Morris水迷宫各项指标检测比较(n=10,±s)
注:与常氧组比较,*P<0.05,**P<0.01;与低氧组比较,#P<0.05
2.3各组小鼠脑组织结构的变化各组脑组织HE常规染色结果显示(图2),常氧组小鼠皮质和海马DG区域组织结构清晰完整、细胞层次清楚,形态正常,常氧+亚甲蓝组(0.5 mg/kg)脑组织形态结构与常氧组相似,低氧组较常氧组小鼠脑组织除血管间隙增宽外,小鼠脑组织并没出现明显的脑组织结构紊乱以及神经细胞损伤,低氧+亚甲蓝组(0.5 mg/kg)小鼠的脑组织形态结构与低氧组相比亦无明显变化。
2.4各组脑组织自噬活性比较与常氧组比较,常氧+亚甲蓝组小鼠脑Beclin1的表达和LC3自噬流升高,低氧组小鼠脑组织中Beclin1表达(P<0.01)和LC3自噬流(P<0.01)减低;与低氧组比较,低氧+亚甲蓝组小鼠脑组织的Beclin1表达(P<0.01)和LC3自噬流(P<0.01)明显升高。具体结果见表2、图3。
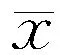
表2 4组小鼠脑组织中Beclin1和LC3Ⅱ/Ⅰ表达比较(n=3,±s)
注:与常氧组比较,*P<0.01;与低氧组比较,#P<0.01
3 讨论
高原脑损伤是急性高原病中枢神经系统损伤的表现,主要包括高原性头痛、急性高山病以及高原脑水肿[10]。从临床诊断角度来看,急性高山病是高原性头痛病情进展所致,而高原脑水肿则是急性高山病最严重的形式[11]。流行病学调查显示在海拔4500 m高原脑水肿的发病率虽然仅为0.5%~1.0%[10],但是高原性头痛和急性高山病的发病率在此海拔高度可达100%[12]和70%[13]。遗憾的是,目前仍没有针对高原脑损伤的特效药。
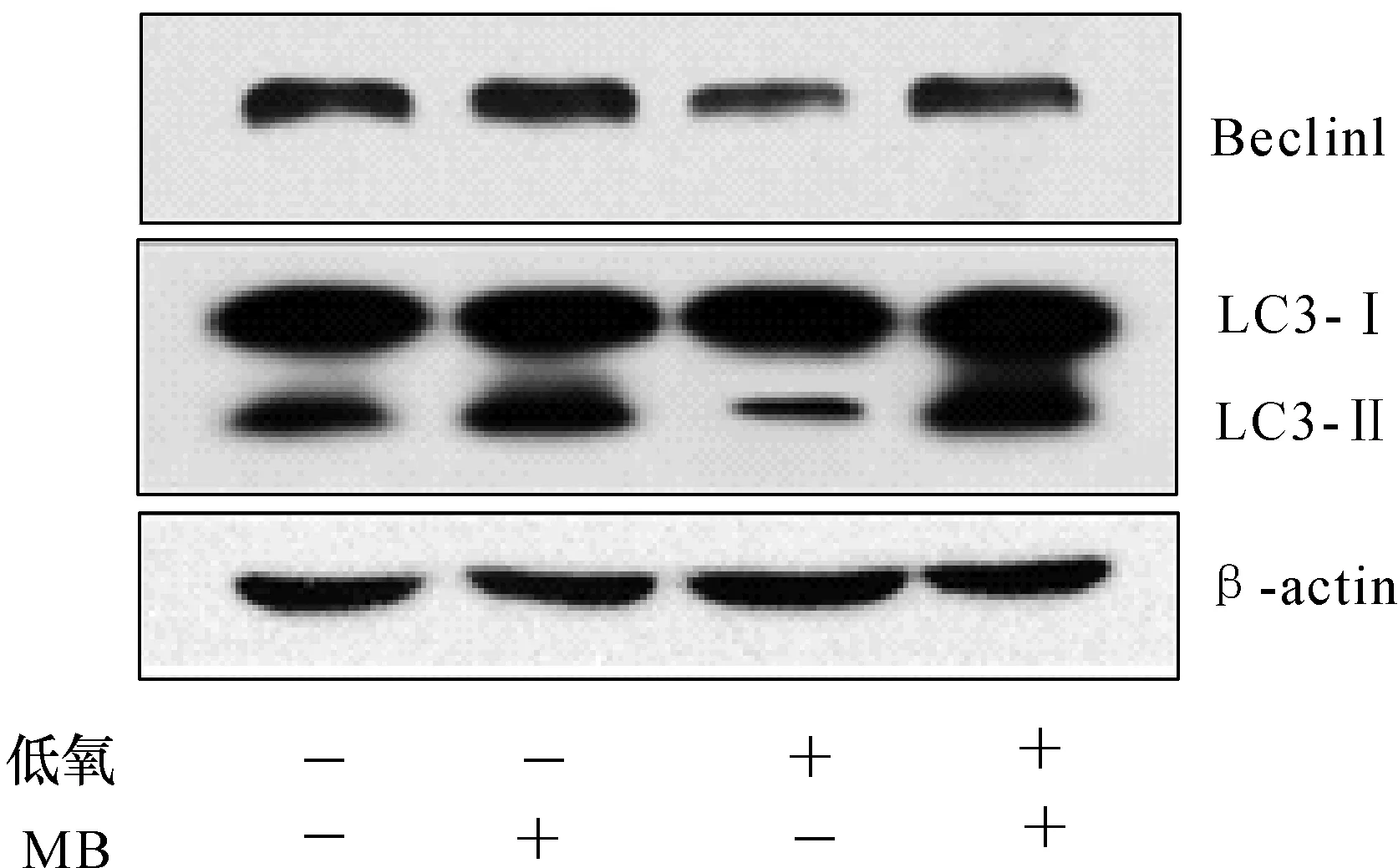
图 3 4组小鼠皮质中Beclin1和LC3表达比较(Western blot)
高原低氧所致脑组织损伤的具体病理生理过程还不明确,目前有多项研究从不同方面阐述了其发病机制。Ross等认为高原脑损伤的发生与神经轴顺应性相关,即当颅腔和椎管不能缓冲因高原低氧导致的脑组织体积增加时,便可出现脑组织肿胀,颅内压升高等现象,进而引起高原脑损伤[10]。氧化应激学说则认为,低氧应激使得细胞内自由基生成增加,一方面其可直接激活三叉神经血管系统导致偏头痛以及急性高山病[14],另一方面自由基生成增加使得钠钾泵衰竭从而使体液重新分布,最终导致高原脑水肿[2,10,14]。此外,低氧暴露所致的自由基生成增加或可激活核因子κB(NF-κB)通路,致使炎性因子生成增加,进而损伤血管内皮细胞造成脑水肿[2-3,15]。
MB是人工合成的芳香族化合物,芳香族属性赋予的亲脂性使其易于穿过血脑屏障,它自身具有的氧化-还原特性致使其进入脑组织后可被线粒体捕获进入线粒体,从而参与氧化呼吸链电子的传递并减少自由基的生成。本实验前期工作表明,MB能显著改善永久性脑缺血大鼠的神经功能障碍,其机制与MB促进线粒体自噬、减少活性氧生成有关[7]。自噬在维持细胞稳态中具有重要作用,尤其当缺血/缺氧等氧化应激时自噬可通过清除受损的细胞器、蛋白质或过多产生的自由基使细胞度过危险期[9]。
本研究采用低剂量LPS复合低压低氧模拟6000 m海拔高度建立高原低氧脑损伤模型,实验结果显示在LPS复合低压低氧处理小鼠6 h后,低氧组小鼠脑组织含水量明显升高,而与低氧组相比,而预先给予不同剂量MB腹腔注射后,低氧+亚甲蓝各组小鼠脑组织含水量较低氧组小鼠脑组织含水量呈不同程度的降低,其中按体质量0.5 mg/kg剂量 MB作用最显著。本实验研究结果还显示,低压低氧可损伤小鼠的空间记忆能力,与常氧组小鼠相比,低氧组小鼠潜伏期延长、穿越平台的次数明显减少(P<0.01),运动路程明显缩短(P<0.01);而按体质量0.5 mg/kg预先给予MB可明显改善低压低氧导致的小鼠空间记忆能力受损,表现为穿越靶标的次数明显增加(P<0.05),在靶标象限的运动距离明显延长(P<0.05)。MB改善记忆的作用在脑缺血损伤、轻度认知障碍的阿尔茨海默病等疾病模型中已被报道[16],分析其作用机制可能是通过增强脑组织细胞色素氧化酶的活性,或者作为电子循环体参与电子呼吸链传递并减少自由基的生成,维持脑组织细胞的氧耗而减少了神经元的死亡[17]。
本实验结果表明MB具有增强自噬作用,无论是在常氧还是在低氧情况下,MB都有助于激活自噬的发生,小鼠脑组织自噬分子Beclin1的表达以及LC3Ⅱ/LCⅠ自噬流明显增加。目前认为自噬是一种维持细胞稳态的质量控制和代谢调控系统。Congdon等[18]研究发现,MB可通过抑制哺乳动物雷帕霉素(mTOR)的活性诱导细胞自噬进而消除tau蛋白缠结所致的神经变性,提示MB可通过诱导自噬的发生发挥神经保护作用,但是对于MB如何诱导自噬的发生仍需要进一步的探索。
综上,本研究中发现,低压低氧可抑制脑组织的自噬活性,而MB却可以解除这种抑制作用,推测MB可能通过诱导细胞自噬这一细胞保护机制维持神经细胞稳态从而发挥神经保护作用,但MB是如何诱导细胞自噬的还有待于进一步探索。
参考文献:
[1]Imray C. Lessons from altitude:Cerebral perfusion insights and their potential clinical significance[J]. Exp Physiol,2016,101(9):1167-1172.
[2]Himadri P, Kumari SS, Chitharanjan,et al. Role of oxidative stress and inflammation in hypoxia-induced cerebral edema:a molecular approach[J]. High Alt Med Bio,2010,11(3):231-244.
[3]Song TT,Bi YH, Gao YQ,et al. Systemic pro-inflammatory response facilitates the development of cerebral edema during short hypoxia[J]. J Neuroinflammation,2016,13(1):63.
[4]Zhou YZ,Huang X,Zhao T,et al. Hypoxia augments LPS-induced inflammation and triggers high altitude cerebral edema in mice[J]. Brain Behav Immun,2017,64 (8):266-275.
[5]Richards A, Marshall H, McQuary A. Evaluation of methylene blue, thiamine, and/or albumin in the prevention of ifosfamide-related neurotoxicity[J]. J Oncol Pharm Pract,2011,17 (4):372-380.
[6]van der Ven AT, Pape JC, Hermann D,et al. Methylene blue (tetramethylthionine chloride) influences the mobility of adult neural stem cells:A potentially novel therapeutic mechanism of a therapeutic approach in the treatment of Alzheimer’s disease[J]. J Alzheimers Dis,2017,57(2):531-540.
[7]Di Y, He YL, Zhao T,et al. Methylene blue reduces acute cerebral ischemic injury via the induction of mitophagy[J]. Mol Med (Cambridge, Mass.),2015,21(1):420-429.
[8]Oz M, Lorke DE, Hasan M,et al. Cellular and molecular actions of Methylene Blue in the nervous system[J]. Med Res Rev,2011,31 (1):93-117.
[9]Galluzzi L, Bravo-San Pedro JM, Blomgren K,et al. Autophagy in acute brain injury[J]. Nat Rev Neurosci,2016,17(8), 467-484.
[10]Wilson MH, Newman S, Imray CH. The cerebral effects of ascent to high altitudes[J]. Lancet Neurol,2009,8(2):175-191.
[11]Hackett PH, Roach RC. High altitude cerebral edema[J]. High Alt Med Bio,2004,5(2):136-146.
[12]Lopez JI, Holdridge A, Mendizabal JE. Altitude headache [J]. Curr Pain Headache Rep,2013,17(12):383.
[13]Netzer N, Strohl K, Faulhaber M,et al. Hypoxia-related altitude illnesses[J]. J Travel Med,2013,20(4):247-255.
[14]Bailey DM, Bartsch P, Knauth M,et al. Emerging concepts in acute mountain sickness and high-altitude cerebral edema:from the molecular to the morphological[J]. Cell Mo Life Sci,2009,66(22):3583-3594.
[15]Patir H, Sarada SK, Sing S,et al. Quercetin as a prophylactic measure against high altitude cerebral edema[J]. Free Radic Bio Med,2012,53(4):659-668.
[16]Rojas JC, Bruchey AK, Gonzalez-Lima F. Neurometabolic mechanisms for memory enhancement and neuroprotection of methylene blue[J]. Prog Neurobiol,2012,96(1):32-45.
[17]Wrubel KM, Riha PD, Maldonado MA,et al.The brain metabolic enhancer methylene blue improves discrimination learning in rats[J]. Pharmaco Biochem Behav,2007,86(4):712-717.
[18]Congdon EE, Wu JW, Myeku N,et al. Methylthioninium chloride (methylene blue) induces autophagy and attenuates tauopathy in vitro and in vivo[J]. Autophagy,2012,8(4):609-622.

