社区老年人群痴呆早期筛查和预测的生物指标研究
赵程 于会艳 张坚 秦斌
阿尔茨海默病(Alzheimer’s disease,AD)是一种与年龄高度相关的进行性神经退行性病变,其主要表现为认知功能障碍、日常生活能力降低和精神行为异常。据统计,我国痴呆患病率为7.8%,高于6.2%的全球平均水平,其中AD患者超过1000万,且患病率随年龄增加而增长,65岁以下为4%,65~74岁为15%,75~84岁为44%,而超过85岁达58%[1]。迄今AD早期诊断仍然很困难,目前国内主要通过简易智力状态检查量表(Minimental State Examination,MMSE)、蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)等进行早期筛查,实施较为方便快捷,但量表筛查容易受被试者自身精神状况及周边环境影响,准确性欠佳,且需多次跟踪随访,有关生物标志物检查未广泛应用且缺少统一标准。本研究通过分析石家庄市3个社区正常老年人群的一般信息、血生化与免疫炎性反应指标、基因筛查结果等,旨在寻找痴呆早期筛查的生物学指标。
1 对象和方法
1.1研究对象采用随机整群抽样方法选取河北省石家庄市3个社区老年人为研究对象,首先通过社区老年人健康档案根据本研究的排除标准进行初步筛查,再通过入户调查进行第2次筛查。纳入标准:(1)年龄≥60岁的本地老年居民;(2)自愿参加该研究并签署知情同意书;(3)意识清楚,能提供合格的血液样本并能配合完成调查问卷。排除标准:(1)患有心脑血管疾病和其他脏器功能不全者;(2)在县/区级或以上医院被诊断患有帕金森病、非典型的帕金森病或其他锥体外系疾病;(3)在县/区级或以上医院被诊断患有AD、痴呆等神经退行性疾病;(4)有严重头部外伤史、肝性脑病、尿毒症脑病、感染性脑病、重金属中毒史、晚期肿瘤患者。本研究获得本院伦理委员会批准,入组对象均签署知情同意书。
1.2方法
1.2.1一般资料收集:采用统一问卷调查表,由培训合格的护士、医师调查并填写。调查内容包括人口学资料、MoCA量表评分。行MoCA检测时尽量减少周围环境的干扰,确保测评结果可靠性[2]。根据MoCA量表评分将入组者分为认知正常组(MoCA评分≥26分)、轻度认知障碍(mild cognitive impairment,MCI)组(22分≤MoCA评分<26分)和痴呆组(MoCA<22分)。其中认知正常组221人、MCI组256人、痴呆组184人。
1.2.3基因检测:通过全球近20年GWAS研究筛查AD与早期发病的相关基因位点46个(表1),并通过MassArray方法对入组人群进行基因分型。
2 结果
2.1一般资料与生化指标比较(1)与认知正常组比较,MCI组高密度脂蛋白胆固醇(high density lipoprotein,HDL)、载脂蛋白A-1(apolipoprotein a1,ApoA-1)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)水平降低(P<0.05或P<0.01),血糖(glucose,Glu)、载脂蛋白B(apolipoprotein B,ApoB)、载脂蛋白E(apolipoprotein E,ApoE)水平升高(P<0.05)。(2)与认知正常组比较,痴呆组ApoA-1、IL-6、TNF-α水平均降低(P<0.05或P<0.01),而Glu、ApoB、ApoE、C反应蛋白(C-reactionprotein ,CRP)水平均升高(P<0.05或P<0.01)。结果见表2。
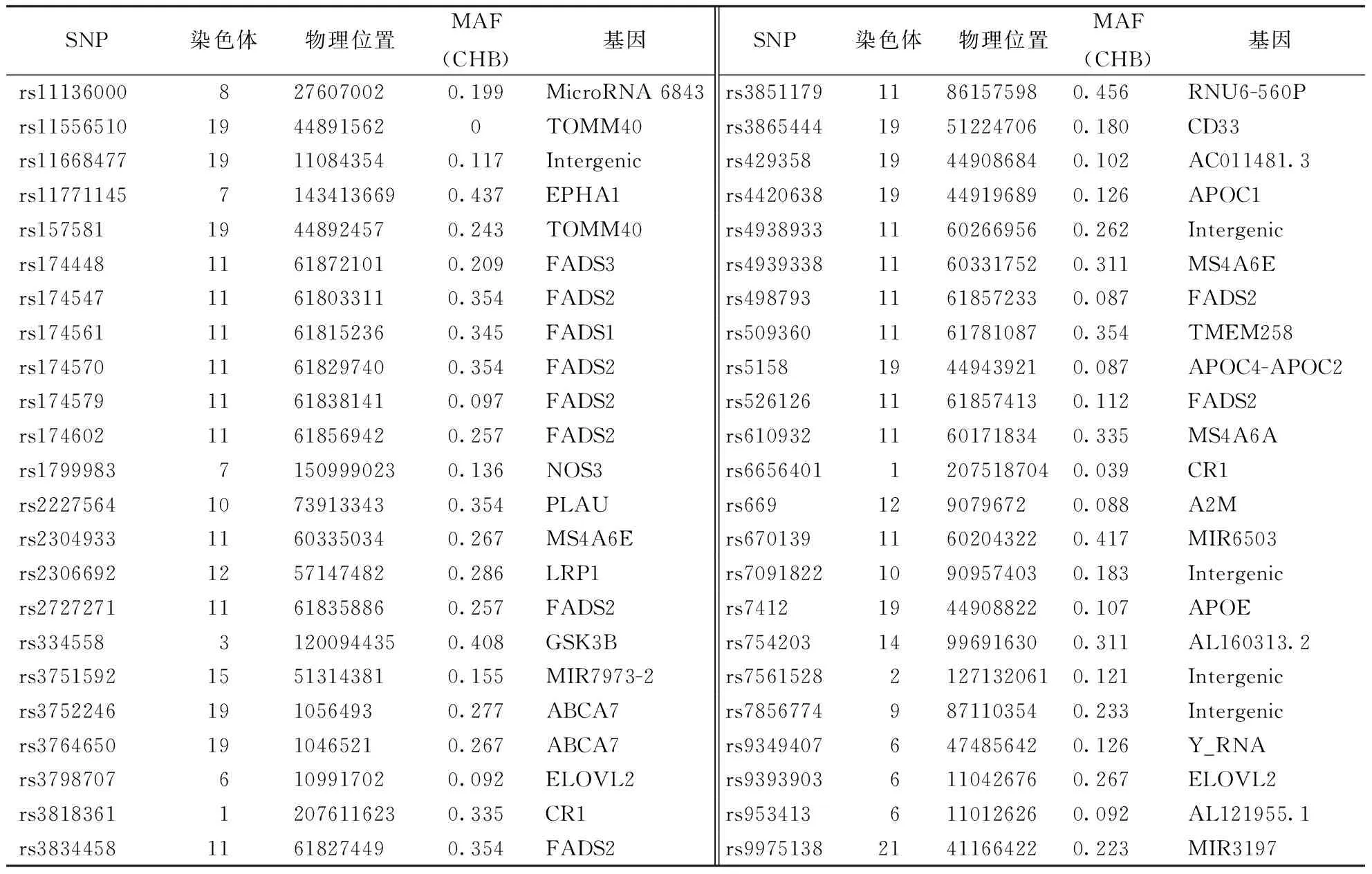
表1 本文所筛查的46个易感基因位点
注:SNP:单核苷酸多态性(single nucleotide polymorphism);MAF:最小的等位基因频率(minor allele frequency);CHB:中国北京汉族人口(China Han Beijing);表3同
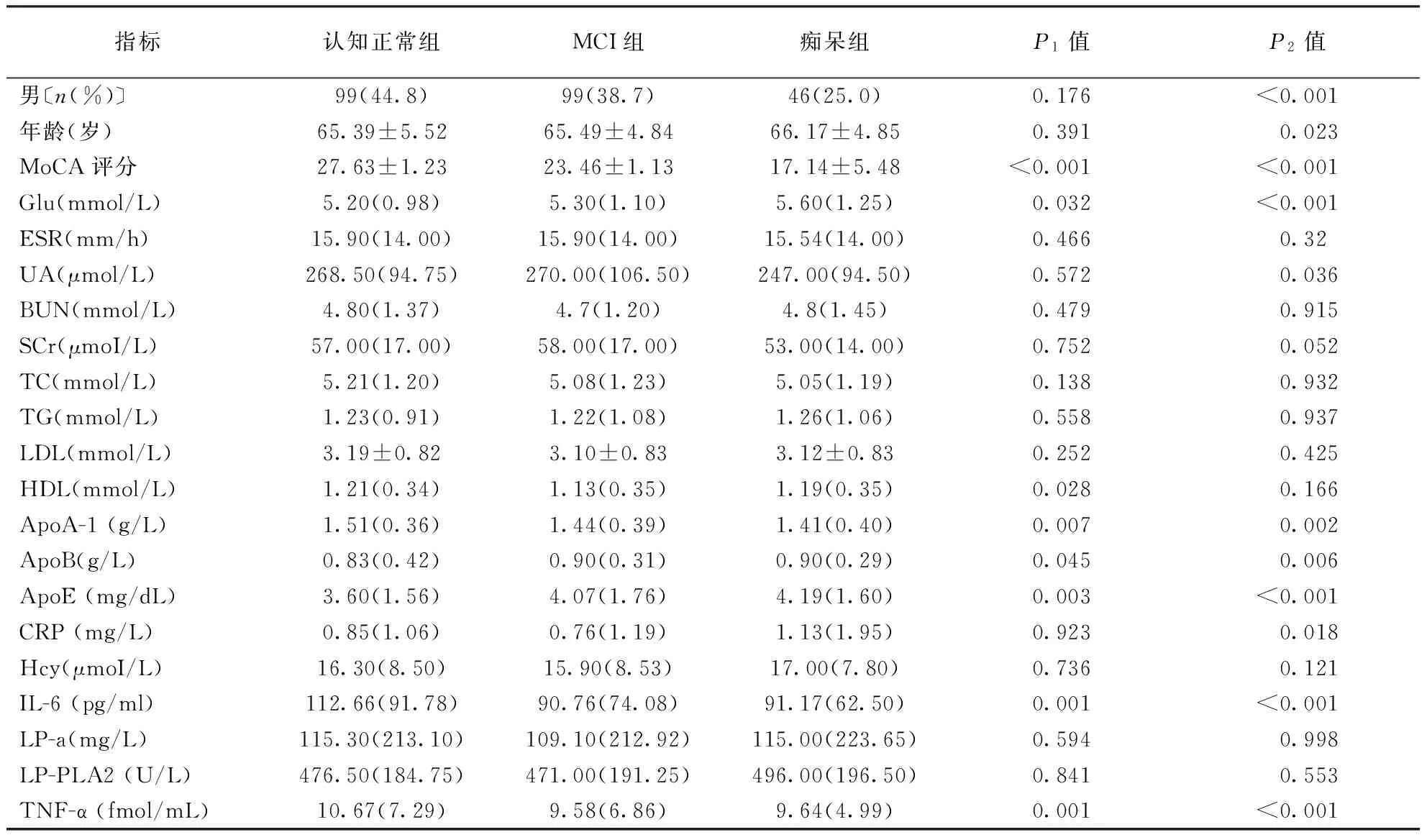
表2 各组人群一般资料与实验室指标比较
注:MCI:轻度认知障碍,表3同;MoCA:蒙特利尔认知评估量表;Glu:血糖;ESR:血沉;UA:血清尿酸;BUN:血清尿素氮;SCr:血清肌酐;TC:总胆固醇;TG:三酰甘油;LDL:低密度脂蛋白;HDL:高密度脂蛋白;ApoA-1:载脂蛋白A-1;ApoB:载脂蛋白B;ApoE:载脂蛋白E;CRP:C反应蛋白;Hcy:同型半胱氨酸;IL-6:白细胞介素-6;LP-a:脂蛋白a;LP-PLA2:脂蛋白相关磷脂酶2;TNF-α:肿瘤坏死因子α;P1值:为认知正常组与MCI组间比较;P2值:为痴呆组与认知正常组间比较
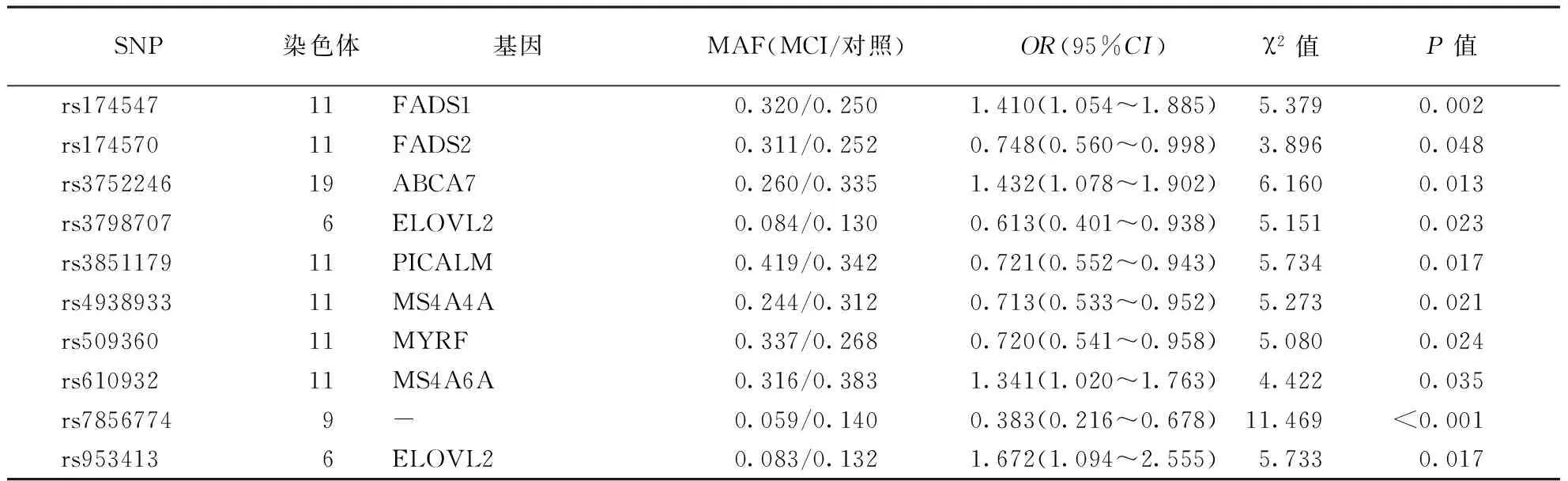
表3 MCI组中有统计学意义的SNP位点
注:“—”表示该位点位于基因间区,表4同
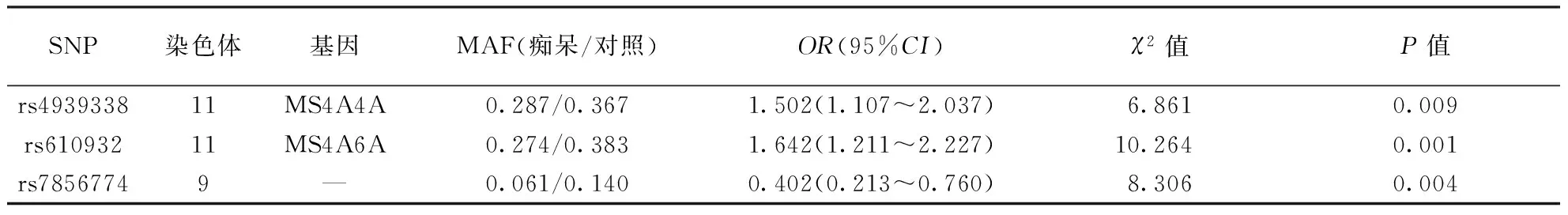
表4 痴呆组中有统计学意义的SNP位点
2.2各组基因分型经检验,入组对象符合Hardy-Weinberg平衡定律。通过对痴呆、脂代谢相关基因的46个SNP位点的筛查发现,与认知正常组相比较,MCI组中有10个单核苷酸多态性(SNP)位点具有统计学意义(表3),痴呆组中有3个SNP位点具有统计学意义(表4)。
3 讨论
3.1生化指标与MCI和痴呆既往研究表明HDL、ApoA-1为认知的保护因素[3],ApoB、ApoE、Glu为认知的危险因素[4]。本研究结果与上述研究结果一致。载脂蛋白ApoA-1是HDL的重要组成部分,血液中的ApoA-1进入大脑直接与APP结合抑制其进入细胞,并阻断β分泌酶和γ分泌酶与APP接触,促进α分泌酶分解APP,减少β-淀粉样蛋白(Aβ)的产生;ApoA-1还可以与Aβ结合,在脑内直接被分解或者转运至肝脏分解,从而抑制Aβ的聚合和细胞毒性。ApoB是体内重要的载脂蛋白,是LDL的主要成分,主要转运内源性和外源性三酰甘油和胆固醇,加剧血管动脉粥样硬化的损害进而影响认知功能。有研究发现ApoB相关的免疫反应在认知障碍患者的脑部血管和老年斑中均有体现[4],提示LDL增高会加速MCI向痴呆的转化率,间接证实HDL对认知具有保护作用。ApoE是大脑中主要的脂蛋白,当大脑中的ApoE含量过多时可能会导致MCI的发生。本研究结果显示,认知正常组血液中ApoE水平均低于MCI组和痴呆组,提示ApoE水平升高可能对认知具有损伤作用。有研究表明2型糖尿病患者认知障碍的风险远远高于健康人[5],这可能与高血糖水平影响海马等与记忆相关的脑部结构有关。
既往文献表明高Hcy水平是认知功能障碍、脑血管病和动脉粥样硬化的独立危险因素[6-7]。本研究未发现MCI和痴呆组Hcy水平与认知正常组有统计学差异,这可能与本研究样本量小有关,但MCI组和痴呆组其水平有高于认知正常组的趋势,提示Hcy升高可能与认知功能减退相关,其机制可能与其直接的神经毒性损害或对脑血管的损伤有关,其产生级联应激反应导致脑内小动脉粥样硬化,造成脑供血不足和脑萎缩等。高Hcy水平还可提高神经元对兴奋性毒物的敏感性,促进神经元的凋亡,影响神经传导功能[8-9]。
用药错误的频发,引发了世界上多个国家、整个医学界以及社会大众对用药安全问题的关注,美国从20世纪80年代起就建立了药差错报告及监测系统,并建立了用药错误的风险分级及防范措施。
3.2炎性反应指标与MCI和痴呆目前关于IL-6、TNF-α等炎性反应指标与MCI、痴呆的关系尚无确切结论。Puzianowska等[10]在波兰检测了4979名65岁以上的老人血液IL-6、TNF-α水平,结果发现血液IL-6、TNF-α水平越高,活动能力和认知能力越差。有研究表明先天免疫系统的过度激活是神经退行性疾病的主要病因之一,长期慢性炎性反应和促炎性反应因子的产生是诱导神经变性、导致神经元丢失和大脑损伤的主要原因之一,最终促进AD的进展[11]。Akiyama等[12]发现在AD患者脑内,Aβ可诱导IL-6、TNF-α释放,但本文研究并未发现类似的趋势,反而认知正常组血液IL-6、TNF-α水平高于MCI组和痴呆组,这可能是因为痴呆早期存在炎性反应代偿机制,各项免疫指标均会升高,而发展至痴呆晚期代偿机制失衡,患者体内免疫功能下降有关。
3.3基因SNP位点与MCI和痴呆本研究对46个SNP位点分析发现有统计学意义的位点主要分布在FADS1、FADS2、ABCA7、ELOVL2、PICALM、MYRF、MS4A4A、MS4A6A等基因上,MCI组和认知正常组相比,在其有统计学意义的SNP位点位于FADS1、FADS2、ABCA7、ELOVL2、PICALM、MS4A4A、MYRF、MS4A6A、ELOVL2等基因上,痴呆组有统计学意义的SNP位点在MS4A4A、MS4A6A,与MCI组保持一致,可能提示从MCI到痴呆的转化过程中,MS4A4A、MS4A6A基因具有重要意义。
FADS1、FADS2、ABCA7、ELOVL2为与脂代谢相关的基因,FADS1和FADS2为多不饱和脂肪酸代谢限速酶基因,已有大量研究指出其SNP可能会影响长链多不饱和脂肪酸代谢进而影响认知功能,并在特异反应性疾病的发展中发挥潜在作用[13]。ABCA7基因与FADS1、FADS2基因一样,同样为脂代谢基因,ABCA7基因是ATP结合转运体家族中的成员,主要作用于多数脂蛋白的转运和维持跨膜运输中脂质的稳态,同样也参与Aβ的形成与吞噬;Hollingworth等[14]、Naj等[15]依据GWAS研究均发现ABCA7参与AD的发病机制,ABCA7基因位点的多态性会增加AD的患病风险(OR=1.22,P=4.5×1017)。ELOVL2基因是脂肪酸延长酶基因家族的一种,可以参与到单不饱和与多不饱和脂肪酸的生成,以不同的链长作为膜脂类和脂质调解剂的前体参与多种生物过程,同时也增加三酰甘油的合成[16]。发生MCI时这些基因表达较为活跃,这与其血液中脂代谢相关生化指标升高有关,进而影响认知功能。PICALM基因可表达磷脂酰肌醇结合网格蛋白组装蛋白,其可无选择性广泛分布于突触前后膜结构,并能促进网格蛋白突触小泡的形成,参与其介导的内噬作用,进而减少淀粉样前体蛋白和Aβ的生成[17]。已有大量GWAS研究发现PICALM基因变异者会增加AD风险[18]。MS4A4A、MS4A6A为第11号染色体的MS4A基因簇,GWAS研究均表明MS4A6A、MS4A4A基因为晚发性阿尔茨海默病(Late-onset Alzheimer’s disease,LOAD)的风险基因[19-20],可能其与CD20同源,在免疫和Aβ清除过程中有关联[21]。发生MCI和痴呆时这些基因表达可减少Aβ的生成或加速其清除,减少脑内老年斑的形成,进而保护认知功能。
目前医学上并无可以治愈或者改变病程发展的治疗方案,早期诊断、治疗就显得尤其重要。本研究表明血脂、Glu水平以及炎性反应因子在早期筛查MCI和痴呆中可能具有重要意义。既往研究也发现MCI往往合并血脂异常、糖尿病[22-23],这可能与高脂膳食可促进MCI患者脑脊液Aβ、Tau蛋白磷酸化增加有关[24-25]。健康的饮食习惯以及适当的体力、智力及社会活动均有助于降低MCI的患病率[26]。随着精准医疗的推广与基因筛查诊断的广泛应用,在健康查体人群中准确筛查FADS1、FADS2、ABCA7、ELOVL2、PICALM、MYRF、MS4A4A、MS4A6A等风险基因,从而做到早预防、早诊断、早治疗,可帮助早期潜在记忆与认知障碍人群采取积极应对措施从而降低认知损害发展的几率。由于本研究入组样本量较少,有关Glu、HDL、ApoA-1、ApoB、ApoE、IL-6、TNF-α等生化指标和FADS1、FADS2、ABCA7、ELOVL2、PICALM等基因在早期筛查MCI和痴呆中的确切价值仍需进一步验证。
参考文献:
[1]田金洲,王永炎,王荫华,等.中国痴呆诊疗指南[M].北京:人民卫生出版社,2012.1-5.
[2] 田金洲,解恒革,秦斌,等.中国简短认知测试在痴呆诊断中的应用指南[J].中华医学杂志,2016,96(37):2945-2959.
[3] Crichton GE,Elias MF,Davey A,et al.Higher HDL cholesterol is associated with better cognitive function: the Maine-Syracuse study[J].J Int Neuropsychol Soc,2014,20(10):961-970.
[4] Namba Y,Tsuchiya H,Ikeda K.Apolipoprotein B immunoreactivity in senile plaque and vascular amyloids and neurofibrillary tangles in the brains of patients with Alzheimer’s disease[J].Neurosci Lett,1992,134(2):264-266.
[5] Wilcock DM,Griffin WS.Down’s syndrome,neuroinflammation,and Alzheimer neuropathogenesis[J].J Neuroinflammation,2013,10:84.
[6] Schafer JH,Glass TA,Bolla KI,et al.Homocysteine and cognitive function in a population-based study of older adults[J].J Am Geriatr Soc,2005,53(3):381-388.
[7] Tay SY,Ampil ER,Chen CP,et al.The relationship between homocysteine,cognition and stroke subtypes in acute stroke[J].J Neurol Sci,2006,250(1-2):58-61.
[8] Samoylenko V,Rahman MM,Tekwani BL,et al. Banisteriopsis caapi,a unique combination of MAO inhibitory and antioxidative constituents for the activities relevant to neurodegenerative disorders and Parkinson’s disease[J].J Ethnopharmacol,2010,127(2):357-367.
[9] Kumar A,Zou L,Yuan X,et al.N-methyl-D-aspartate receptors: transient loss of NR1/NR2A/NR2B subunits after traumatic brain injury in a rodent model[J].J Neurosci Res,2002,67(6):781-786.
[10] Puzianowska-Kuznicka M,Owczarz M,Wieczorowska-Tobis K,et al.Interleukin-6 and C-reactive protein,successful aging,and mortality: the PolSenior study[J].Immun Ageing,2016,13:21.
[11] Wirth M,Madison CM,Rabinovici GD,et al.Alzheimer’s disease neurodegenerative biomarkers are associated with decreased cognitive function but not beta-amyloid in cognitively normal older individuals[J].J Neurosci,2013,33(13):5553-5563.
[12] Akiyama H,Arai T,Kondo H,et al.Cell mediators of inflammation in the Alzheimer disease brain[J].Alzheimer Dis Assoc Disord,2000,14 Suppl 1:S47-S53.
[13] Lattka E,Illig T,Heinrich J,et al.FADS gene cluster polymorphisms: important modulators of fatty acid levels and their impact on atopic diseases[J].J Nutrigenet Nutrigenomics,2009,2(3):119-128.
[14] Hollingworth P,Harold D,Sims R,et al.Common variants at ABCA7,MS4A6A/MS4A4E,EPHA1,CD33 and CD2AP are associated with Alzheimer’s disease[J].Nat Genet,2011,43(5):429-435.
[15] Naj AC,Jun G,Beecham GW,et al.Common variants at MS4A4/MS4A6E,CD2AP,CD33 and EPHA1 are associated with late-onset Alzheimer’s disease[J].Nat Genet,2011,43(5):436-441.
[16] Kobayashi T,Zadravec D,Jacobsson A.ELOVL2 overexpression enhances triacylglycerol synthesis in 3T3-L1 and F442A cells[J].FEBS Lett,2007,581(17):3157-3163.
[17] Carey RM,Balcz BA,Lopez-Coviella I,et al.Inhibition of dynamin-dependent endocytosis increases shedding of the amyloid precursor protein ectodomain and reduces generation of amyloid beta protein[J].BMC Cell Biol,2005,6:30.
[18] Lambert JC,Ibrahim-Verbaas CA,Harold D,et al.Meta-analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer’s disease[J].Nat Genet,2013,45(12):1452-1458.
[19] Chen B,Jin X,Guo R,et al.Metabolic syndrome and cognitive performance among Chinese ≥50 years: A cross-sectional study with 3988 participants[J].Metab Syndr Relat Disord,2016,14(4):222-227.
[20] Gasecki D,Kwarciany M,Nyka W,et al.Hypertension,brain damage and cognitive decline[J].Curr Hypertens Rep,2013,15(6):547-558.
[21] Edmonds EC,Delano-Wood L,Galasko DR,et al.Subjective cognitive complaints contribute to misdiagnosis of mild cognitive impairment[J].J Int Neuropsychol Soc,2014,20(8):836-847.
[22] Bocchetta M,Galluzzi S,Kehoe PG,et al.The use of biomarkers for the etiologic diagnosis of MCI in Europe: an EADC survey[J].Alzheimers Dement,2015,11(2):195-206.
[23] Li X,Ma C,Zhang J,et al.Prevalence of and potential risk factors for mild cognitive impairment in community-dwelling residents of Beijing[J].J Am Geriatr Soc,2013,61(12):2111-2119.
[24] Puzianowska-Kuznicka M,Owczarz M,Wieczorowska-Tobis K,et al.Interleukin-6 and C-reactive protein,successful aging,and mortality: the PolSenior study[J].Immun Ageing,2016,13:21.
[25] Wirth M,Madison CM,Rabinovici GD,et al.Alzheimer’s disease neurodegenerative biomarkers are associated with decreased cognitive function but not beta-amyloid in cognitively normal older individuals[J].J Neurosci,2013,33(13):5553-5563.
[26] Trollor JN,Smith E,Baune BT,et al.Systemic inflammation is associated with MCI and its subtypes: the Sydney Memory and Aging Study[J].Dement Geriatr Cogn Disord,2010,30(6):569-578.

