富钾烤烟品种成熟期钾素代谢特征研究
张小全,张鋆鋆,刘冰洋,阚洪赢,郭传滨,杨立均,夏宗良
(1 河南农业大学烟草学院,郑州 450002;2 河南省烟草公司驻马店市公司,驻马店 463000;3 河南农业大学生命科学学院,郑州 450002)
钾是烟草生长必需的大量营养元素,有重要的营养和生理作用,与烟叶品质密切相关[1]。烟叶钾含量偏低是我国烟叶与国际优质烟叶品质差异的重要原因之一[2]。研究烟草高效吸收钾的机理,选育含钾量高的烟草新品种,提高烟株钾素营养效率,对促进我国优质烟叶生产具有重要的意义。
不同烟草品种的吸钾能力、叶片含钾量及钾的营养效率存在显著的差异。杨铁钊等对钾含量不同的基因型的钾积累特性进行分析后发现,富钾烟草基因型ND202具有钾积累速率高和高积累速率持续时间较长两个重要特征[3]。采用盆栽和水培的方法对旺长期富钾烟草基因型ND202钾高效积累的机制研究发现,富钾基因型烤烟根系发达,根系活力强,根系分泌物活化能力强,根系具有较高的钾吸收速率等特点[3–9]。钾在植物体内流动性很强,根吸收的钾离子其中一部分通过韧皮部运回到根中,再转入木质部继续向上运输,从而形成钾在植株根与地上部之间的循环流动,旺长期烟株运往地上部的钾大约有20%~40%可回流到根中,而打顶后烟株运往地上部的钾大约有50%~70%可回流到根中[10]。烟草成熟期是决定烟叶钾含量的关键时期,打顶可导致由根系向地上部运输的钾离子减少,根系钾离子外溢量会显著增加,从而使烟叶中钾累积量降低[11],同时烤烟叶片同样可以存在钾素的外流[12]。而成熟期富钾烟草基因型高效吸收钾的机理却鲜有报道。本研究选用富钾烤烟品种ND202和常规品种K326、NC89进行盆栽试验,分析了不同烤烟品种生长过程中非根际和根际土壤速效钾含量的变化,成熟期根系生理特性差异,成熟期不同部位钾积累量、钾通道和转运体基因表达差异,旨在探明烟草富钾基因型成熟期钾素代谢特征,探究烟草高效吸收钾的机理,为富钾烤烟基因型的筛选提供参考依据。
1 材料与方法
1.1 试验材料
供试材料为富钾烤烟品种ND202,对照品种为K326、NC89。种子由河南农业大学烟草育种实验室提供。
1.2 试验方法
试验于2016年在河南农业大学郑州科教园区进行。将种子消毒、浸种、催芽后播于装有蛭石、珍珠岩、草木灰和适量化肥的塑料格盘内育苗,至5叶1心时挑选生长健壮、整齐的烟苗进行移栽。
试验采用盆栽种植 (每盆装25 kg土),供试土壤为肥力一致的壤质潮土,基本理化性状为有机质11.50 g/kg、全氮0.85 g/kg、全磷0.11 g/kg、速效钾120 mg/kg、缓效钾675 mg/kg、pH 7.67。烟苗5月3日移栽,每个材料种植180株。施用肥料为NH4NO3、NaH2PO4和K2SO4,分别在移栽时、移栽后第1周、移栽后第2周分3次施入,3次施肥量比例为2∶1∶1。移栽后,使用田间滴灌系统进行水分管理,保持土壤田间持水量在80%左右。烟株第一朵中心花开放50%时,进行打顶,每株留叶数为22片,按优质烤烟生产技术进行田间管理。
在移栽后 35 d (团棵期)、65 d (旺长期)、85 d (成熟期) 各处理中分别随机选取6株生长整齐的健壮烟株,小心将烟株从盆中取出,防止伤及烟株根系,去掉2 cm的表层土壤,轻轻抖动烟株根系外围土壤,即为非根际土;然后慢慢去除根系周围较大土块,用毛刷轻轻从烟株根系表面刷下土壤,即为根际土。不同处理的根际土和非根际土分别充分混合均匀,各分为三份,用作土壤速效钾含量检测。
在成熟期 (移栽后85 d),各处理选取生长整齐一致的健壮烟株18株,其中6株用于根系体积、根重、根系活力测定。6株用于钾含量测定,根、茎、叶分开,烟株叶片从下往上第1~6片叶为下部叶,第7~16片叶为中部叶,第17~22片叶为上部叶,于烘箱中105℃杀青30 min,70℃烘干用于钾含量测定。6株用于钾相关基因相对表达量测定,取烟株叶片从下往上第3叶位 (下部叶)、第10叶位 (中部叶)、第20叶位 (上部叶) 等各部位取10 g左右的烟叶,并取10 g左右的须根 (用去离子水清洗干净),每两株对应样品混合,每个部位均含3个重复样品,分开存放,–80℃保存,用于钾吸收转运相关基因相对表达量的测定。
1.3 测定项目与方法
根际土和非根际土速效钾含量的测定采用乙酸铵浸提—火焰光度法[13]。
植株钾含量采用盐酸溶液浸提—火焰光度法,连续流动分析仪测定[14]。
根系鲜重、根系干重的测定采用称重法,根系体积的测定采用排水法,根系活力的测定采用氯化三苯基四氮唑 (TTC) 法[8]。
钾相关基因相对表达量采用实时荧光定量PCR法测定:采用trizol法提取总RNA,利用NanoDrop 2000分光光度计 (Thermo Scientific,USA)测定浓度及OD260/OD280,琼脂糖凝胶电泳检测RNA完整性。利用HiScript II Q RT SuperMix for qPCR (+gDNA wiper) (Vazyme,R223-01) 将待测RNA逆转录成cDNA。引物采用primer premier 5.0软件设计并由上海捷瑞生物工程有限公司合成,引物序列信息见表1。内参基因为烟草ACTIN基因。利用QuantiFast® SYBR® Green PCR Kit试剂盒(Qiagen,Germany) 在 LightCycler® 480 Ⅱ型荧光定量PCR仪 (Roche,Swiss) 上进行反应。体系:2 ×QuantiFast® SYBR® Green PCR Master Mix,5 μL;10 μM Forward primer,0.2 μL;10 μM Reverse primer,0.2 μL;cDNA,1 μL;Nuclease-free H2O,3.6 μL。PCR 程序:95℃ 5 min,95℃ 10 s,60℃ 30 s,40个循环。反应结束后分析荧光值变化。所有的样品都设置3个重复,反应结束后,基因相对表达水平用 2–△△CT方法进行计算[15]。

表 1 目的基因引物序列Table 1 Primer of target genes
1.4 数据分析
数据采用SPSS21 软件进行One-way ANOVA方差分析和多重比较,文中的数据表示为平均值 ± SD。
2 结果与分析
2.1 不同烤烟品种成熟期钾积累特性差异
成熟期不同部位样品的钾含量见表2,烤烟成熟期不同器官的钾含量变化呈现出“叶 > 茎 > 根”的规律;NC89烟叶中的钾含量随着部位的降低而增大,而ND202与K326却恰好相反;就烤烟烟叶的不同部位而言,无论是哪个部位,ND202烟叶中的钾含量均是最大,且与其他品种存在显著性差异。
钾积累量是研究植物钾吸收特性的重要指标,在一定程度上,能够反映植物的钾吸收效率。而干物质重与钾积累量关系密切。由表3可知,烤烟中部叶和茎的干物质量最大;不同品种上部叶、茎、根的干物质重差异不显著;ND202中部叶的干物质重最大,比NC89高83.06%,与其他两个品种存在显著性差异;下部叶的干物质重品种间存在极显著差异;ND202植株的干物质总重达到497.75 g/株,与其他两个品种存在显著差异。
由表4可知,整体上来说,烤烟植株在叶片中钾素的积累量最高,远高于茎中的积累量,根中钾的积累量最低。就叶片来说,烤烟在中部叶中的钾积累量最大。ND202叶片中的钾积累量极显著地高于其他品种,茎和根中的钾积累量品种间差异不显著。全株钾积累量以ND202最高,达到10.18 g/株,分别比NC89和K326高109.9%和90.3%,差异达极显著水平。说明ND202具有较强的钾积累能力。
2.2 不同烤烟品种成熟期根系生理特性比较
由不同烤烟品种成熟期根系生理特性(表5)可知,成熟期富钾品种ND202的平均根鲜重、根干重、根体积、根系活力均较K326和NC89高,其中根鲜重和根体积显著地高于K326,根系活力显著地高于NC89。说明成熟期ND202根系较发达,根系吸收能力较强。
2.3 不同烤烟品种根际土壤速效钾含量比较
随着生长时期的推移,烤烟植株根际土壤速效钾含量呈现出逐步增加的趋势(表6)。富钾品种ND202根际土壤速效钾含量分别在团棵期极显著地低于NC89,在旺长期极显著地低于K326,在成熟期更是极显著地低于其他2个品种,说明ND202与其他2个品种相比在整个生长发育过程中具有较强的钾素吸收能力。非根际土壤速效钾含量NC89和K326均是在旺长期最高,ND202则是随着生长时期的推进,含量逐步升高,并在成熟期极显著地高于NC89和K326,说明ND202根系活化土壤矿物钾的能力持续时间长,活化能力较强。
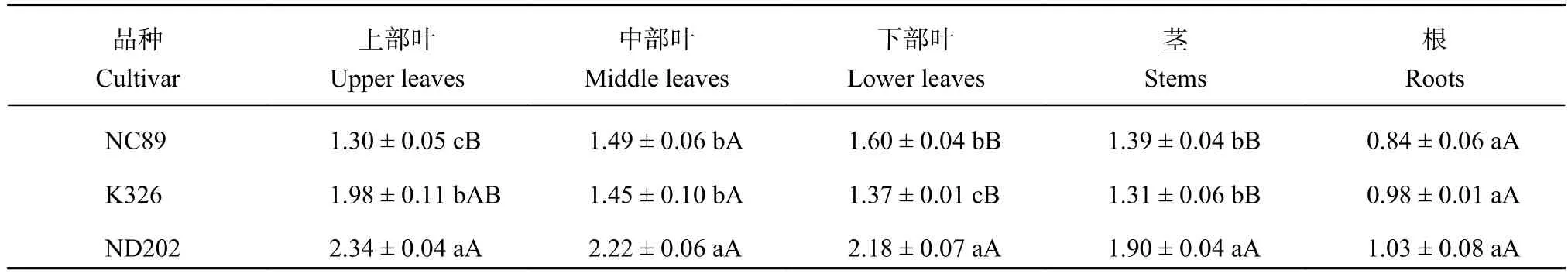
表 2 不同烤烟品种成熟期不同部位钾含量 (%)Table 2 Potassium contents in different parts of different flue-cured tobacco cultivars at the mature stage

表 3 不同烤烟品种成熟期不同部位干物质的积累量 (g/plant)Table 3 Accumulation of dry matter in different parts of different flue-cured tobacco cultivars at the mature stage

表 4 不同烤烟品种成熟期不同部位钾积累量 (g/plant)Table 4 Potassium accumulation in different parts of different flue-cured tobacco cultivars at the mature stage

表 5 不同烤烟品种成熟期根系生理特性Table 5 Root physiological characteristics of different flue-cured tobacco cultivars at the mature stage

表 6 不同烤烟品种不同生长时期根际土壤速效钾含量 (mg/kg)Table 6 Readily available potassium contents in rhizosphere soil of different cultivars during different growth periods
2.4 不同烤烟品种成熟期钾离子通道和转运体基因表达差异
目前,关于烤烟钾离子通道基因方面的报道很多[16]。试验选定了与烤烟根系吸收转运钾素过程关系最为密切的NKT1、NTORK1、NtTPK1、NtKC1等4个通道基因和NtHAK1、NtKT12等2个转运体基因进行研究。
2.4.1 钾离子通道基因NKT1和NtKC1基因属于内流型钾离子通道基因。NKT1主要在根细胞质膜上表达,可促进植物根细胞对土壤中钾的吸收[11,17–20],因此NKT1表达量增加对提高烤烟钾素累积是有利的。由图1可知,成熟期NKT1在根中的表达量相对较高,但品种间差异不显著,在上部叶中ND202的NKT1表达量显著高于K326和NC89,中部叶中3个品种间差异不明显,下部叶中NC89的NKT1表达量显著高于其他品种。NtKC1基因在烤烟的叶片和根系中均有表达,但在根系中的表达量远高于在叶片中的表达量,这与郭兆奎等人的研究结果一致[21]。成熟期ND202在根、上部烟和中部叶中NtKC1的相对表达量极显著地高于NC89和K326。说明成熟期ND202具有相对较高的钾素吸收能力。

图 1 不同品种成熟期不同部位钾离子通道基因的相对表达量Fig. 1 Relative expression of potassium channel gene in different parts of different cultivars at the mature stage
NTORK1属于外流型钾离子通道基因[22–24]。由图1可知,该基因在根、上部叶和中部叶中的相对表达量品种间差异极显著,均以ND202最高,说明富钾品种ND202的钾代谢运输旺盛,外排较多。而在成熟期叶龄较大的下部叶中,ND202的相对表达量则极显著地低于NC89和K326,钾素外排较少有利于钾含量的提高。
NtTPK1基因包含典型的钾吸收转运功能保守域,具有KCO家族的钾吸收与转运的生物学功能[25]。成熟期富钾品种ND202 该基因的相对表达量在下部叶中极显著地低于其他品种,在根、中部叶中极显著地高于NC89和K326,在上部叶中极显著地高于K326,说明ND202在成熟期对钾具有较强的吸收能力。
2.4.2 钾转运体基因NtHAK1和NtKT12基因是烟草中重要的钾转运体基因,其表达量的高低与烤烟品种的富钾能力密切相关[16,26]。由图2可知,3个品种不同部位NtHAK1基因的表达量存在极显著的差异,且各部位表达量相当。成熟期ND202在根、上部叶和中部叶中NtHAK1的相对表达量均呈极显著地高于K326和NC89。成熟期3个品种根、上部叶和中部叶NtKT12基因的表达量存在极显著的差异,且叶片的表达量高于根。ND202在根和上部叶中NtKT12的相对表达量均呈极显著地高于K326和NC89。说明富钾品种ND202在成熟期具有较强的钾素运转和积累能力。
3 讨论

图 2 不同品种成熟期不同部位钾转运体基因的相对表达量Fig. 2 Relative expression of potassium transporter gene in different parts of different cultivars at the mature stage
植物生长所需的钾素绝大部分来自土壤, 而根系是植物从土壤中获取钾的主要器官, 因此, 根系吸钾功能的发挥与根系生理特性密切相关[27]。本研究发现,富钾品种ND202在成熟期仍然具有根系发达、根系吸收能力较强、根系活化土壤矿化钾的能力持续时间长、活化能力较强的特点。Batten等总结了钾高效吸收基因型根系所具有的特征:根冠比高,根系纵向、侧向分布广,根多且细,根毛多且长,根系吸收面积和活跃面积大,理想的根系吸收动力学参数[28]。前期研究也发现富钾品种ND202旺长期根系活力、H+分泌量、阳离子交换量、可溶性蛋白含量和三磷酸腺苷 (ATP) 酶活性都显著高于低效品种[8],ND202还表现出根系发达、抗旱能力强的特点。Zhang等研究发现棉花根系钾吸收动力学参数受苗龄的显著影响[29]。烤烟对钾素的吸收、积累高峰出现在旺长期,进入成熟后,由于前期的大量吸收、钾素随水分流失、土壤对钾素的矿化固定等影响,烤烟根际的速效钾通常供应不足,影响烟叶钾的积累。生产上通常采用追施钾肥的办法来提高烟叶含钾量。富钾品种ND202根系活化土壤矿化钾的能力持续时间长,活化能力较强,有利于根际钾素的持续供应和钾含量的提高。研究发现ND202根系分泌物对土壤钾具有较强的活化能力,可能与其根系分泌物中有机酸含量较高有关[7]。李廷轩等通过测定不同基因型籽粒苋根系分泌物中有机酸和氨基酸的含量,并进一步模拟籽粒苋根系分泌物对土壤矿物钾的活化能力,结果表明低钾胁迫下,富钾基因型籽粒苋根系分泌物中的氨基酸和有机酸含量,以及其分泌物对土壤钾的活化作用都明显高于一般基因型,其根际真菌和细菌的数量是一般基因型的3 倍以上[30–33],研究也发现富钾品种ND202也具有根际真菌和细菌数量较多的特点[7]。
目前烟草钾吸收与转运相关基因的研究主要集中于钾通道、钾转运体和钾营养相关调控基因三个方面[16]。钾离子通道不仅能调控保卫细胞气孔开闭[34],影响根细胞的生长发育,同时能促进植物对土壤中钾的吸收[35],调控根中钾向地上部的转运[36],协调钾在植物源库组织中的运输和分配[22]。代晓燕等[11]研究发现,内流型钾离子通道基因表达量增加对提高烤烟钾素累积是有利的。本研究发现成熟期富钾品种ND202上部叶中的NKT1表达量显著高于K326和NC89,根、上部和中部叶中NtKC1的相对表达量极显著地高于NC89和K326,ND202的钾离子通道基因NtTPK1在根、中部叶中极显著地高于NC89和K326,有利于钾离子的吸收。NTORK1与拟南芥SKOR/GORK钾通道亚族同源,均属于外向整流Shaker钾通道,在叶片保卫细胞和根表皮木质部薄壁细胞中表达,主要参与钾在木质部中的长距离运输[22,36]。ND202下部叶中外流型钾离子通道基因NTORK1的相对表达量极显著地低于NC89和K326,钾素外排较少有利于钾含量的提高。NtHAK1与拟南芥、水稻、大麦等植物的高亲和钾吸收转运基因具有较高的同源性,在根、茎、叶及花中均有表达,且不受外界低钾环境的诱导,在烟草栽培品种K326中表达后,转化株的钾含量显著高于野生型,表明其可提高烟株富集钾的能力[37]。ND202在根、上部叶和中部叶中NtHAK1的相对表达量极显著地高于K326和NC89,有利于钾素运转和积累。李较等[26]研究发现NtKT12具有KUP/HAK/KT家族钾转运体蛋白的共同特征,该基因在根中的表达量最高,而且受低钾诱导。而本研究发现NtKT12在叶部的表达量要高于根部,这可能与本试验的取样时期为成熟期,试验为正常供钾有关。
由本试验结果可知,富钾品种ND202具有成熟期根系较发达、根系吸收能力较强、钾离子通道和转运体基因相对表达量较高、叶片中钾积累量较大的特征。进一步深入研究富钾品种ND202根系分泌物、根际微生物与根际土壤有效钾含量间的相互作用,以及对钾素吸收和运转的影响机制,对阐明烟草高效吸收钾的机理,进而筛选富钾烤烟品种应用于生产具有重要的意义。
参 考 文 献:
[ 1 ]中国农业科学院烟草研究所. 中国烟草栽培学[M]. 上海: 上海科学技术出版社, 2005. 321–323.Tobacco Research Institute of CAAS. China tobacco cultivation [M].Shanghai: Shanghai Science and Technology Press, 2005. 321–323.
[ 2 ]刘文祥, 颜合洪, 周益, 等. 烟草钾素营养与提高烤烟烟叶含钾量的研究进展[J]. 作物研究, 2007, 21(S1): 736–740.Liu W X, Yan H H, Zhou Y,et al. Recent advances in tobacco potassium nutrition and improving potassium content of flue-cured tobacco[J]. Crop Research, 2007, 21(S1): 736–740.
[ 3 ]杨铁钊, 彭玉富. 富钾基因型烤烟钾积累特征研究[J]. 植物营养与肥料学报, 2006, 12(5): 750–753.Yang T Z, Peng Y F. Potassium accumulation characteristics of rich potassium genotypic flue-cured tobacco[J]. Plant Nutrition and Fertilizer Science, 2006, 12(5): 750–753.
[ 4 ]杨铁钊, 范进华. 不同基因型烤烟品种吸收钾差异的根系特性研究[J]. 西北农学报, 2006, 15(3): 41–44.Yang T Z, Fan J H. The roots charateristics of different genotype flue-cured tobacco varieties in absorption potassium[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2006, 15(3): 41–44.
[ 5 ]鲁黎明, 杨秋云, 杨铁钊. 不同烤烟基因型钾吸收特性及其根皮层细胞内向钾电流差异研究[J]. 河南农业大学学报, 2007, 41(3):251–254.Lu L M, Yang Q Y, Yang T Z. Study on the difference of characteristics of potassium absorption of different flue-cured tobacco genotypes and their whole cell inward potassium current[J]. Journal of Henan Agricultural University, 2007, 41(3): 251–254.
[ 6 ]杨铁钊, 鲁黎明, 夏巍, 等. 烤烟富钾基因型钾吸收积累与内向钾电流特性[J]. 中国农业科学, 2008, 41(8): 2392–2399.Yang T Z, Lu L M, Xia W,et al. Characteristics of potassiumenriched flue-cured tobacco genotype in potassium absorption,accumulation and inward potassium currents of root cortex[J].Scientia Agricultura Sinica, 2008, 41(8): 2392–2399.
[ 7 ]杨铁钊, 杨志晓, 林娟, 等. 不同烤烟基因型根际钾营养和根系特性研究[J]. 土壤学报, 2009, 46(4): 646–651.Yang T Z, Yang Z X, Lin J,et al. K nutrition in rhizosphere and characteristics of roots of flue-cured tobaccos different in genotype[J]. Acta Pedologica Sinica, 2009, 46(4): 646–651.
[ 8 ]杨志晓, 张小全, 尚晓颍, 等. 富钾基因型烤烟根系形态和生理特性研究[J]. 西北植物学报, 2009, 29(3): 555–560.Yang Z X, Zhang X Q, Shang X Y,et al. Morphological and physiological characteristics of root in potassium-enriched flue-cured tobacco genotype[J]. Acta Botanica Boreali-Occidentalia Sinica,2009, 29(3): 555–560.
[ 9 ]杨铁钊, 杨志晓, 聂红资, 等. 富钾基因型烤烟的钾积累及根系生理特性[J]. 作物学报, 2009, 35(3): 535–540.Yang T Z, Yang Z X, Nie H Z,et al. Potassium accumulation and root physiological characteristics of potassium-enriched flue-cured tobacco genotypes[J]. Acta Agronomica Sinica, 2009, 35(3):535–540.
[10]郑宪滨. 烤烟体内钾的循环、累积和分配[D]. 北京: 中国农业大学博士学位论文, 2000.75–80.Zheng X B. Circulation, accumulation and distribution of potassium in flue-cured tobacco [D]. Beijing: PhD Dissertation of China Agricultural University, 2000.75–80.
[11]代晓燕, 苏以荣, 魏文学, 等. 打顶对烤烟植株钾素代谢和钾离子通道基因表达的影响[J]. 中国农业科学, 2009, 42(3): 854–861.Dai X Y, Su Y R, Wei W X,et al. Effects of topping on potassium metabolism and expression of potassium channels in tobacco plants[J]. Scientia Agricultura Sinica, 2009, 42(3): 854–861.
[12]Chen Y F, Wang Y, Wu W H,et al. Membrane transporters for nitrogen, phosphate and potassium uptake in plants[J]. Journal of Integrative Plant Biology, 2008, 50(7): 835–848.
[13]鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.108–109.Bao S D. Soil and agro-chemistry analysis methods [M]. Beijing:China Agriculture Press, 2000.108–109.
[14]贝美容, 罗雪华, 杨红竹. AA3 型连续流动分析仪-CFA-同时测定橡胶叶全氮、全磷、全钾的方法研究[J]. 热带作物学报, 2011,32(7): 1258–1264.Bei M R, Luo X H, Yang H Z. Simultaneous determination of nitrogen, phosphorus and potassium in rubber leaf samples by AA3 continuous flow analyzer (CFA)[J]. Chinese Journal of Tropical Crops, 2011, 32(7): 1258–1264.
[15]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J]. Methods,2001, 25: 402–408.
[16]王倩, 刘好宝. 烟草重要基因篇: 2. 烟草钾吸收与转运相关基因[J].中国烟草科学, 2014, 35(2): 139–142.Wang Q, Liu H B. Important genes in tobacco: 2. genes related to potassium absorption and translocation in tobacco[J]. Chinese Tobacco Science, 2014, 35(2): 139–142.
[17]Sano T, Becker D, Ivashikina N,et al. Plant cells must pass a K+threshold to re-enter the cell cycle[J]. The Plant Journal, 2007, 50(3):401–413.
[18]Sentenac H, Bonneaud N, Minet M,et al. Cloning an expression in yeast of a plant potassium ion transport system[J]. Science, 1992,256: 663–665.
[19]Basset M, Conejero G, Leppetit M,et al. Organization and expression of the gene coding for the potassium transport systemAKT1ofArabidopsis thaliana[J]. Plant Molecular Biology, 1995, 29:947–958.
[20]Lagarde D, Basset M, Lepetit M,et al. Tissue-specific expression ofArabidopsis AKT1gene is consistent with a role in K+nutrition[J].Plant Journal, 1996, 9: 195–203.
[21]郭兆奎, 杨谦, 颜培强, 等. 黄花烟草K+通道基因NKC1克隆与序列分析[J]. 中国烟草学报, 2008, 14(5): 63–68.Guo Z K, Yang Q, Yan P Q,et al. Cloning and homology modeling of a potassium channel geneNKC1fromNicotiana rustica[J]. Acta Tabacaria Sinica, 2008, 14(5): 63–68.
[22]Gaymard F, Pilot G, Lacombe B,et al. Identification and disruption of a plant Shaker-like outward channel involved in K+release into the xylem sap[J]. Cell, 1998, 94: 647–655.
[23]Moshelion M, Becker D, Czempinski K,et al. Diuranl and circadian regulation of putative potassium channels in a leaf moving organ[J].Plant Physiology, 2002, 128: 634–642.
[24]Ache P, Becker D, Ivashikina N,et al.GORK, a delayed outward rectifier expressed in guard cells ofArabidopsis thaliana, is a K+-selective, K+-sensing ion channel[J]. FEBS Letters, 2000, 486: 93–98.
[25]Hamamoto S, Marui J, Matsuoka K,et al. Characterization of a tobacco TPK-type K+channel as a novel tonoplast K+channel using yeast tonoplasts[J]. Journal of Biological Chemistry, 2008, 283(4):1911–1920.
[26]李姣, 许力, 鲁黎明, 李立芹. 烟草钾转运体NtKT12的克隆及表达分析[J]. 华北农学报, 2016, 31(2): 65–70.Li J, Xu L, Lu L M, Li L Q. Cloning and expression analysis of a potassium transporterNtKT12inNicotiana tabacum[J]. Acta Agriculturae Boreali-Sinica, 2016, 31(2): 65–70.
[27]Lynch J P. Root architecture and plant productivity[J]. Plant Physiology, 1995, 109: 7–13.
[28]Batten G D, Khan M A, Cullis B R. Yield responses by modern wheat genotypes to phosphates fertilizer and their implications for breeding[J]. Euphytica, 1984, 33: 81–89.
[29]Zhang Z Y, Wang G W, Tian X L,et al. Preliminary study of K+uptake kinetics of cotton (Gossypium hirsutumL.) and its application[J]. Cotton Science, 2005, 17(3): 165–170.
[30]李廷轩, 马国瑞. 籽粒苋富钾基因型筛选研究[J]. 植物营养与肥料学报, 2003, 9(4): 473–479.Li T X, Ma G R. Screening grain amaranths for genotypes of the capability of enrichment in potassium[J]. Plant Nutrition and Fertilizer Science, 2003, 9(4): 473–479.
[31]李廷轩, 马国瑞. 籽粒苋富钾基因型的生理生化基础研究[J]. 植物营养与肥料学报, 2004, 10(4): 380–385.Li T X, Ma G R. Study on the physiological and biochemical characters of grain amaranth genotype with rich-potassium[J]. Plant Nutrition and Fertilizer Science, 2004, 10(4): 380–385.
[32]李廷轩, 马国瑞. 籽粒苋富钾基因型的根系形态和生理特性[J]. 作物学报, 2004, 30(11): 1145–1151.Li T X, Ma G R. Physiological and morphological characteristics of roots in grain amaranth genotypes enrichment in potassium[J]. Acta Agronomica Sinica, 2004, 30(11): 1145–1151.
[33]李廷轩, 马国瑞, 张锡洲. 富钾基因型籽粒苋主要根系分泌物及其对土壤矿物态钾的活化作用[J]. 应用生态学报, 2006, 17(3):368–372.Li T X, Ma G R, Zhang X Z. Root exudates of potassium enrichment genotype grain amaranth and their activation on soil mineral potassium[J]. Chinese Journal of Applied Ecology, 2006, 17(3):368–372.
[34]Ivashikina N, Deeken R, Fischer S,et al.AKT2/3subunits render guard cell K+channels Ca2+sensitive[J]. The Journal of General Physiology, 2005, 125: 483–492.
[35]Hirsch R E, Lewis B D, Spalding E P,et al. A role for theAKT1potassium channel in plant nutrition[J]. Science, 1998, 280: 918–921.
[36]Johansson I, Wulfetange K, Poree F,et al. External K+modulates the activity of the Arabidopsis potassium channelSKORvia an unusual mechanism[J]. The Plant Journal, 2006, 46: 269–281.
[37]鲁黎明, 杨铁钊. 烟草钾转运体基因NtHAK1的克隆及表达模式分析[J]. 核农学报, 2011, 25(3): 469–476.Lu L M, Yang T Z. Cloning and expression profile analysis of a putative potassium transporter geneNtHAK1in tobacco[J]. Journal of Nuclear Agricultural Sciences, 2011, 25(3): 469–476.

