红球菌BAP-1对荧蒽的跨膜运输过程
李 艺,王红旗,吴枭雄,许 洁 (1.广西师范大学环境与资源学院,广西 桂林 541004;.北京师范大学水科学研究院,北京 100875)
多环芳烃包括一系列潜在的环境污染物,这些污染物通常具有“三致”效应,是一类典型的持久性有机污染物[1-2].能够降解多环芳烃的微生物有很多种,包括细菌、真菌和藻类.这些微生物通过摄取运输和生物转化过程,将高疏水性的多环芳烃分解成为较为简单代谢产物,然后通过矿化作用,将这些简单的代谢产物转化成无机物质,如 H2O和 CO2(好氧生物降解)或者CH4(厌氧生物降解)[3].红球菌是一种典型的多环芳烃降解菌,可以有效的降解萘、菲、荧蒽等多环芳烃[4-5].在加入非离子表面活性剂如Tween 80后,能够有效的促进红球菌分泌表面活性剂,使处理效果得到显著的提高[6].同时,红球菌在高酸碱性、高盐度及低温的条件下,依然可以有较好的降解效果[7].
由于多环芳烃具有高毒性,因此在低浓度下就能对其降解微生物造成毒性效应;另外由于多环芳烃本身的高疏水性和低生物利用性,要通过一些特殊的机制和反应,微生物才能与多环芳烃进行充分的接触,吸附并且代谢,从而达到更好的处理效果[8-10].在微生物成功的对多环芳烃进行吸附摄取后,多环芳烃需要通过微生物的细胞膜跨膜运输进入到细胞体内.此时,微生物才能对多环芳烃进行降解.然而,细胞为了完成特定的生理功能,必须与周围的环境发生信息,物质和能量的交换,因此,细胞必须具备一套物质转运体系,用来获取所需的物质和排泄代谢废物.Bateman等[11]的研究表明菌株Pseudomonas putida PpG1064对萘的运输过程与底物浓度无关,是不需要能量的简单扩散过程;而Beal等[10]的研究表明,人为添加ATP抑制剂 CCCP(间苯腙氯羰氰,carbonyl cyanide m-chlorophenyhydrazone)和 DNP(2,4-二硝基酚,2,4-dinitrophenol),严重阻碍了菌株 Pseudomonas aeruginosa对正十烷的摄取,这说明菌株对正十烷的摄取过程是需要能量的主动运输.Bugg等[12]的研究表明,菌株Pseudomonas fluorescens LP6a从环境中摄取多环芳烃时,所采取的运输方式是被动扩散;而当其将多环芳烃从体内释放时,则是通过需要能量的主动运输方式来实现.这些研究表明,在跨膜运输过程中,有些机制有可能单一起作用也有可能综合作用于反应过程.
然而,对多环芳烃跨膜运输的研究主要集中在对萘和菲的研究,对中高环芳烃的跨膜运输方式的研究较少,同时对微生物跨膜运输多环芳烃过程中的关键环节和控速步骤都尚不明确.基于此,本研究利用同位素示踪法,以红球菌 BAP-1作为靶微生物,分析在不同底物条件以及有无能量抑制剂存在的情况下,红球菌BAP-1对荧蒽的跨膜运输规律.并且结合米氏方程,对红球菌BAP-1跨膜运输荧蒽的动力学过程进行探讨.
1 材料与方法
1.1 实验材料
实验过程使用的主要化学药品及来源:荧蒽(分析纯,日本 TCI公司);14C-荧蒽(99%纯,美国ChemDeop 实验室);丙酮,乙腈,甲醇,正己烷(色谱纯,美国J.T.Baker公司);NaCl, Na2HPO4, KH2PO4,NH4Cl, MgSO4·7H2O 、 CaCl2, FeSO4·7H2O,NaNO3,牛肉膏等(分析纯,北京试剂公司);蛋白胨(分析纯,北京鼎国生物试剂公司);酵母粉(分析纯,OXOID公司).
本研究以课题组前期研究所筛选出的高效多环芳烃降解菌––红球菌BAP-1作为研究靶细胞,GenBank登录号:JX683682; 中国科学院微生物所菌株保藏号7.68[13].
1.2 培养基及相关溶液的配制
无机盐培养基(MSM):4g Na2HPO4, 1.5g KH2PO4, 1g NH4Cl, 0.2g MgSO4·7H2O, 0.02g CaCl2, 0.03g FeSO4·7H2O, 1.0g NaNO3, 1mL 微量元素/L培养基(每 100mL溶液包括:0.25mg CoCl2·6H2O, 0.37mg (NH4)6Mo7O24·4H2O, 4.0mg CuSO4·5H2O, 5.7mg H3BO3, 4.3mg MnSO4·5H2O,4.3mg ZnSO4·7H2O),去离子水定容到 1000mL,121℃高压蒸汽灭菌20min.
LB培养基:5g牛肉膏,10g蛋白胨,5g NaCl,去离子定容到 1000mL, 121℃高压蒸汽灭菌20min.选择性无机培养基:将无机盐培养基置于121℃下高压灭菌 20min,在无菌条件下,加入一定量含荧蒽的丙酮溶液,使其达到预定浓度,置于摇床上振荡 24h,待丙酮挥发后使用.磷酸盐缓冲溶液(PBS):0.87g K2HPO4, 0.68g KH2PO4, 8.77g NaCl,去离子水定容到1000mL, pH=6.8.
荧蒽储备液:用电子天平准确称量1.0g荧蒽,用丙酮溶液定容至 1L,浓度为 1000mg/L.14C-荧蒽储备液:实验用的14C-荧蒽初始浓度为50mCi/mmol(0.1mCi/mL),溶剂为甲醇.通过稀释再配置浓度为 25µCi/mL (0.5µmol/mL)和 0.25µCi/mL(0.005µmol/mL)的14C-荧蒽溶液待用.
1.3 实验方法
1.3.114C-荧蒽的取样分析方法 用玻璃注射器吸取1mL的发酵液直接加入到闪烁液中分析发酵液中残留的14C-荧蒽含量.用玻璃注射器吸取1mL的发酵液,用0.2µm的 Whatman聚碳酸酯滤膜过滤收集菌体,并用灭菌磷酸缓冲液(PBS)清洗 6次后,将滤膜取出加入到闪烁液中分析红球菌BAP-1膜结合14C-荧蒽的含量,实验平行样3个.胞外14C-荧蒽含量(µmol/L)=发酵液中总14C-荧蒽含量-膜结合14C-荧蒽含量;14C-荧蒽的降解率(%)=1-发酵液中残留的14C-荧蒽含量/发酵液初始14C-荧蒽含量. 其中,14C-荧蒽的放射量采用TR-2900液体闪烁仪(美国Packard)进行分析.
1.3.2 生物降解过程中14C-荧蒽在细胞膜内外的含量分配 实验在150mL的三角瓶中进行,在60mL的灭菌MSM培养基中加入MSM重悬的 BAP-1菌体,控制初始 OD600值为 0.5,控制14C-荧蒽的初始浓度为0.25µmol/L;同时在另一组实验中加入 NaN3,控制 NaN3的浓度为30mmol/L.对照组不添加红球菌 BAP-1,仅加入14C-荧蒽以分析其非生物损失量,分别在 1, 5,10, 30min, 1, 12, 24, 36, 48, 60, 72, 84, 96h取样分析膜结合14C-荧蒽的含量和发酵液中残留的14C-荧蒽含量.
1.3.3 不同荧蒽浓度下红球菌BAP-1对14C-荧蒽跨膜运输规律 实验在100mL的三角瓶中进行,在15mL的灭菌MSM培养基中加入MSM重悬的BAP-1菌体,控制初始OD600值为0.2,之后加入甲醇溶解的14C-荧蒽.分别从 25µCi/mL的14C-荧蒽储备液中移取 0.6, 1.2, 4.8, 9.6, 28.8,60mL溶液加入到15mL MSM培养基中,此时培养基中14C-荧蒽的初始浓度分别为 0.20, 0.40,1.60, 3.20, 9.60, 20.00µmol/L.在 1, 3, 5, 10, 12, 15,18和20min取样,分析细胞膜内跨膜摄取14C-荧蒽的量.
1.3.4 不同接菌量条件下红球菌BAP-1对14C-荧蒽跨膜运输规律 实验在100mL的三角瓶中进行,控制14C-荧蒽的初始浓度为0.40µmol/L(即从 0.25µCi/mL的储备液中移取 1.2mL加至15mLMSM培养基中).在15mL的灭菌MSM培养基中加入MSM重悬的BAP-1菌体,控制初始OD600值分别为0.1, 0.2, 0.5, 0.8, 1.0, 1.5和2.0.在1和20min取样,分析细胞膜内跨膜摄取14C-荧蒽的量.
1.3.5 红球菌BAP-1体内包涵体形态的变化观察 以在含有5和150mg/L荧蒽的MSM培养基中生长 168h的红球菌BAP-1菌体及同时含有30mmol/L NaN3和5mg/L荧蒽的MSM培养基中生长168h的红球菌BAP-1作为观察对象,利用透射电镜(JEM-1400,日本电子 JEDL)对红球菌BAP-1体内包涵体的形态变化进行观察,从微观角度分析红球菌BAP-1对荧蒽的跨膜运输过程.透射电镜的前处理方法:在 4500r/min的条件下(10min, 4℃)离心收集菌体,在收集的菌体中加入磷酸缓冲戊二醛溶液约1~2mL静置3h对菌体进行固定.3h后离心,加入磷酸盐缓冲液(pH=7.0)吹打使细胞重悬,静置 15min离心,重复 3次;加入1%俄酸固定2h,用磷酸盐缓冲液(PBS)清洗6次,每次 15min;然后依次用 30%, 50%, 70%, 80%,90%酒精-水溶液洗涤细胞,每次静置15min后离心,浓度依次递增,最后用 100%乙醇洗涤细胞 3次,每次15min.将处理好的样品用EPON812树脂包埋剂进行包埋,包埋后对聚合好的包埋块进行修块、切片及染色,最后用透射电镜观察菌体内部包涵体形态的变化.
1.3.6 米氏方程结合同位素示踪法分析红球菌跨膜运输荧蒽的动力学过程 实验在 50mL的三角瓶中进行,在15mL的灭菌MSM培养基中加入MSM重悬的BAP-1菌体,控制初始OD600值为 0.2.之后加入甲醇溶解的14C-荧蒽,分别从25µCi/mL的14C-荧蒽储备液中移取0.6, 1.2, 4.8,9.6, 28.8, 60mL溶液加入到15mLMSM培养基中,此时培养基中14C-荧蒽的初始浓度分别为0.20,0.40, 1.60, 3.20, 9.60, 20.00µmol/L. 1, 3和 5min内取样分析膜结合14C-荧蒽的量,实验结果(14C-荧蒽的浓度)用 µmol/L表示.跨膜运输动力学方程:V=Vmax·S/(Kt+S).其中:V 表示14C-荧蒽的膜结合速率,µmol/(L·min);Vmax表示红球菌 BAP-1 对14C-荧蒽的最大摄取速率;Kt表示摄取速率达到最大速率一半时的底物浓度,µmol/L;S表示初始14C-荧蒽的浓度,µmol/L.
1.4 数据处理
文中所有实验数据的测定重复 3次,实验数据的方差分析采用 SPSS 19.0软件完成,数据的表达方式为:平均数±标准偏差;图像绘制采用Excel 2010软件完成.
2 结果与讨论
2.114C-荧蒽在红球菌BAP-1细胞膜内外的含量分配研究
控制14C-荧蒽的初始浓度为 0.25µmol/L,如图 1(a)所示,在 1min时对第一个样品进行分析,发现红球菌BAP-1细胞膜内所结合的14C-荧蒽的含量为(0.0531±0.0084)µmol/L,占总14C含量的21.24%,而此时细胞膜外的14C-荧蒽的含量为0.1969±0.0075µmol/L.从图中可以看出,在反应开始的1h内,红球菌BAP-1膜内所结合的14C-荧蒽的含量缓慢增加,在 1h时达到最高的(0.0962±0.0159)µmol/L,占总14C 含量的 38.4%.随着反应的继续,在培养 24h后,发现红球菌BAP-1膜结合14C-荧蒽的含量降低至(0.0506±0.0048)µmol/L,培养 48h 后继续降低至(0.0345±0.0176)µmol/L,之后保持稳定.这一过程说明在红球菌 BAP-1对14C-荧蒽的跨膜运输过程中,目标物质首先与微生物相接触从而进入到微生物体内.这时微生物开始对目标污染物进行降解,随着降解过程的进行,膜结合14C-荧蒽的量逐渐减少,最后达到稳定.
然而,如图 1(b)在有 NaN3的存在下,从反应开始红球菌BAP-1细胞膜内所结合的14C-荧蒽含量几乎不变.即 NaN3的存在抑制了红球菌BAP-1对14C-荧蒽跨膜运输,从而使得微生物对底物无降解作用.在反应进行了96h之后,红球菌BAP-1细胞膜内所结合的14C-荧蒽的含量为(0.0095±0.0041)µmol/L,细胞外14C-荧蒽含量为(0.2405±0.0027)µmol/L. NaN3的存在阻断了电子链的传递同时也消除了跨膜的H+电势,造成了菌体的死亡,也抑制了菌体对底物的摄取.
Kallimanis等[14]的研究表明,在 NaN3和DNP的存在下,微生物 Arthrobacter sp. strain Sphe3细胞膜内依然可以富集发酵液中的菲,表明微生物是以被动运输的方式对菲进行摄取.Miyata等[15]的研究则表明,在CCCP和KCN的存在下,微生物 Mycobacterium sp. strain RJGII-135细胞膜内富集菲的含量降低,表明微生物是以主动运输的方式对菲进行摄取.从本文的研究结果可以看出,NaN3的存在抑制了红球菌 BAP-1对14C-荧蒽跨膜运输,表明红球菌BAP-1对荧蒽的跨膜运输过程是需要能量的主动运输过程,荧蒽是需要在红球菌 BAP-1的内部进行降解的,如果跨膜运输过程无法进行,荧蒽将无法得到有效的降解.

图1 红球菌BAP-1膜内外14C-荧蒽的含量分布Fig.1 Content of 14C-fluoranthene in the Rhodococcus sp.BAP-1 during the trans-membrane process
2.2 不同初始浓度下14C-荧蒽的跨膜运输规律
从图 2中可以看出,在底物初始浓度分别0.2,0.4,1.6,3.2,9.6和20.0µmol/L时,红球菌BAP-1对荧蒽的膜结合量在反应进行 1min时为(0.0531±0.0084)µmol/L,(0.0691±0.0075)µmol/L,(0.0992±0.0054)µmol/L,(0.1113±0.0115)µmol/L,(0.2728±0.0174)µmol/L和(0.3607±0.0157)µmol/L.在反应进行 10min时基本达到了饱和,此时的膜结合14C-荧蒽量分别达到了(0.0827± 0.0067)µmol/L,(0.1384±0.0166)µmol/L, (0.1607± 0.0057)µmol/L,(0.1749±0.0256)µmol/L, (0.3859± 0.0018)µmol/L 和(0.5142±0.0086)µmol/L;占发酵液中总14C-荧蒽量的比例为41.35%, 40.18%, 10%, 5.3%,4.1%和2.5%.
研究结果表明随着底物浓度增加,红球菌BAP-1对14C-荧蒽的摄取比例并没有随之线性增加,而是随着底物浓度的增加而降低,而且膜结合14C-荧蒽的量始终低于膜外14C-荧蒽的量;同时,可以看出在底物浓度相对较高时,如9.6µmol/L,微生物细胞对14C-荧蒽的摄取量在缓慢增加后有一个下降趋势,这也与之前研究发现的微生物自身具有自我保护机制,当有毒物质的浓度过大时,微生物将其排出体外以保持微生物体内外环境的相对平衡的结论相似[16].从图 2还可以看出,无论在何种浓度条件下,红球菌BAP-1的体外14C-荧蒽浓度均高于体内的浓度,膜结合14C-荧蒽的量并不随着底物浓度的增加而增加.之前我们的研究表明红球菌BAP-1对14C-荧蒽的跨膜运输过程是需要能量的主动运输过程[13].这里所得到的研究结论又证明了这一点,因为如果红球菌 BAP-1对14C-荧蒽的运输过程是被动运输,那么其对14C-荧蒽的膜结合量应该随着底物浓度的增加而梯度增加,然而实验所得到的结论却是非线性增加的过程.因此,在不同的底物浓度条件下,红球菌BAP-1对14C-荧蒽的跨膜运输过程是需要能量的主动运输过程.
2.3 不同接菌量下14C-荧蒽的跨膜运输规律
从图 3中可以看出,随着菌体 OD600值的增加,膜结合14C-荧蒽的量并没有随之对应增加.当菌体密度的初始值分别为0.1, 0.2, 0.5, 0.8时,随着菌体密度的增加,膜结合14C-荧蒽的量也随着增加,在 20min 时达到(0.1019±0.0087)µmol/L,(0.1330±0.0103)µmol/L, (0.1855±0.0124)µmol/L,(0.2661±0.0134)µmol/L;而当菌体密度的初始值继续增加,膜结合14C-荧蒽的量并没有随着增加,20min膜结合14C-荧蒽的量保持在(0.2647±0.0029)µmol/L 左右.

图3 不同接菌量下红球菌BAP-1对14C-荧蒽的跨膜运输规律Fig.3 Uptake of 14C-fluoranthene by Rhodococcus sp.BAP-1 in the different inoculum level
研究表明,红球菌BAP-1对14C-荧蒽的跨膜运输与底物浓度的变化有关,也与环境中菌体的量有关.但是,在一定的底物浓度条件下,并不是环境中微生物的含量越大就越有利于跨膜运输过程的进行,菌体膜结合污染物的量会在一定的条件下达到饱和.
2.4 红球菌BAP-1细胞膜内包涵体的观察
红球菌 BAP-1在含有浓度 5mg/L和150mg/L荧蒽的MSM培养基中生长168h,通过透射电镜对微生物体内包涵体的形态进行观察,结果如图 4所示.可以看出,当培养基中荧蒽的浓度较低时(5mg/L),红球菌BAP-1中含有透明的包涵体如图 4(b);而且从放大倍数为 5000倍的图4(a)中可以看出,基本上所有的菌体内部都具有或多或少的包涵体;而当培养基中荧蒽的浓度较高时(150mg/L),将菌体放大至 20000倍的图4(c)中,无法观察到白色透明的包涵体存在;而当培养基中含有ATP抑制剂NaN3时,将菌体放大至20000倍的图4(d)中,无法观察到白色透明的包涵体存在.

图4 透射电镜观察在荧蒽中生长的红球菌BAP-1形态变化Fig.4 Transmission Electron Microscopy of Rhodococcus sp. BAP-1 grown on fluoranthene
研究表明,微生物体内包涵体的组成与微生物生长过程中所利用的碳源情况有关[17].Kennedy 和 Finnerty[18]对 Acinetobacter sp.体内的包涵体研究表明,包涵体的组分包括碳链长度从 C12到 C20的烃类物质.在我们的前期研究中,发现Pseudomonas sp. DG17在摄取正十八烷的过程中,微生物体内观察到有包涵体的存在,而当有NaN3的存在时,菌体死亡,细胞内物质流出,没有观察到包涵体[16].另外,结合之前的研究可以发现[19],当培养基中荧蒽的浓度较低时,荧蒽可以通过细胞膜进入到红球菌体内,因此红球菌对荧蒽的降解效果较好;而当荧蒽浓度较高时,由于菌体自身的保护作用,未在微生物体内观察到包涵体的存在,几乎没有荧蒽通过细胞膜进入红球菌体内,因此红球菌对荧蒽的降解效果较差.
同时,结合2.1中ATP抑制剂对荧蒽跨膜运输过程的抑制分析可以看出,红球菌BAP-1对荧蒽的跨膜运输过程是需要能量的主动运输过程,当有 NaN3这类 ATP抑制剂存在的情况下,荧蒽无法通过微生物细胞膜进入到微生物的体内,因此也无法得到较好的降解.所以,跨膜运输是红球菌BAP-1降解荧蒽的一个重要步骤,若是荧蒽无法通过红球菌细胞膜进入到红球菌细胞体内,就不能得到较好的生物降解.
2.5 红球菌 BAP-1对荧蒽的跨膜运输过程动力学分析
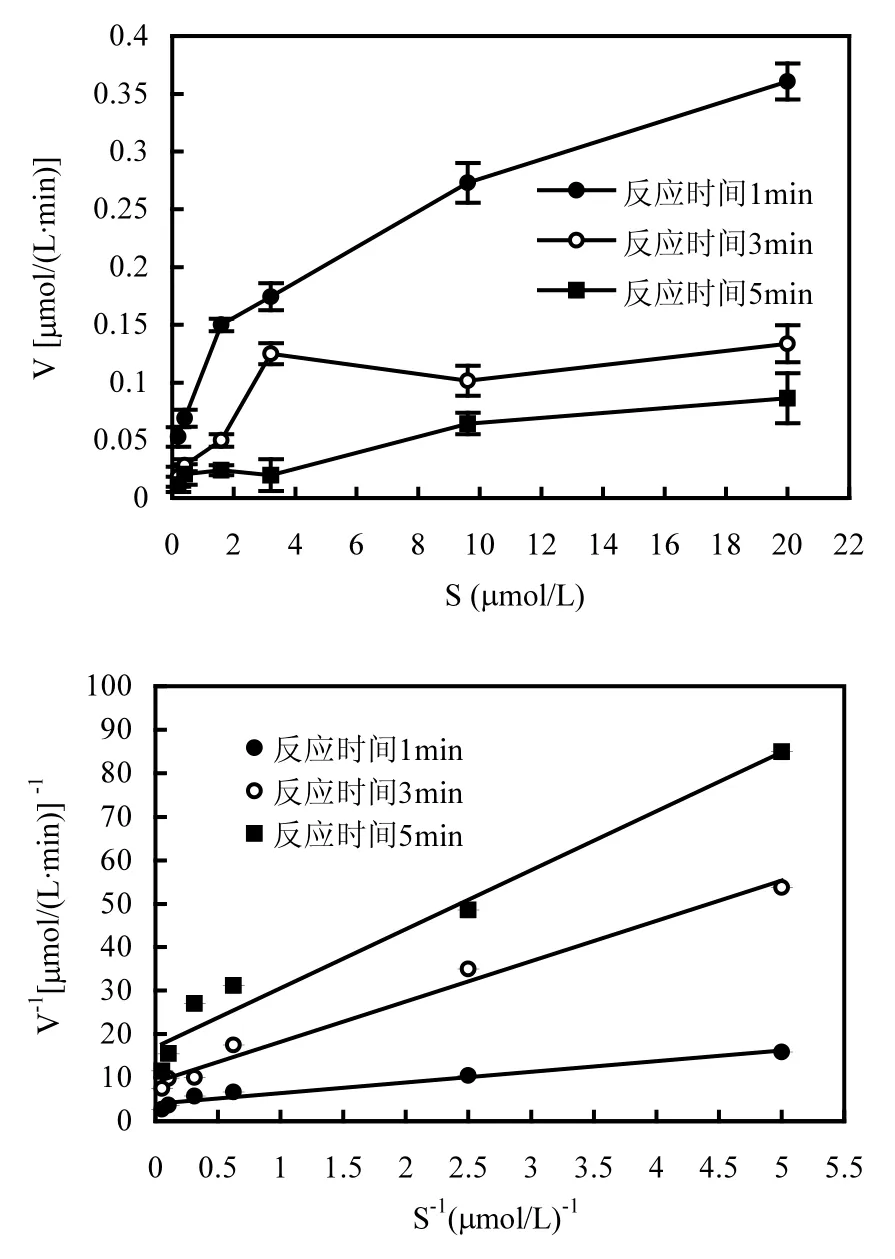
图5 红球菌BAP-1对14C-荧蒽的跨膜运输过程动力学分析Fig.5 Analyze of trans-membrane transport kinetics of 14C-fluoranthene by Rhodococcus sp. BAP-1
红球菌BAP-1对荧蒽的跨膜运输动力学过程分析如图5所示.培养基中的14C-荧蒽浓度依次从0.2~20µmol/L,实验进行1, 3和5min时取样分析膜结合14C-荧蒽的量.根据米氏方程的双倒数方程所算得的参数见表 1.从实验结果可以看出,在各浓度梯度下,反应时间为1, 3和5min时的最大摄取速率 Vmax依次为:0.367, 0.151和0.077µmol/(L·min).可以看出,在各浓度梯度下,红球菌 BAP-1对14C-荧蒽的跨膜运输在开始的1min内摄取速率较快,在接下来的反应时间内,摄取速率下降明显.
从表1中可以看出,在3min的反应时间内,Kt的值基本保持不变,当反应进行到 5min时,Kt的值有所下降,但总体变化不大.研究表明 Kt的值与底物浓度的变化是无关的,它表征的是底物与酶之间的亲和力大小[20];Kt的值越小,表示底物与酶之间的亲和力越大.可以说,在 5min的实验过程中,底物14C-荧蒽与红球菌BAP-1一直保持较高的亲和力,红球菌BAP-1通过主动运输的方式对14C-荧蒽进行跨膜运输,较高的亲和力有助于跨膜运输过程的顺利进行.

表1 红球菌BAP-1对14C-荧蒽跨膜运输动力学Michaelis-Menten方程参数Table 1 Michaelis-Menten parameters for the trans-membrane of 14C-fluoranthene by Rhodococcus sp. BAP-1
3 结论
3.1 红球菌BAP-1在对14C-荧蒽的跨膜运输过程中,目标物质首先与微生物相接触从而进入到微生物体内,在有ATP抑制剂NaN3的存在下,从反应开始红球菌BAP-1细胞膜内所结合的14C-荧蒽含量几乎没有变化.
3.2 对微生物体内包涵体的观察结果表明,当有 NaN3这类抑制剂存在的情况下,荧蒽无法通过细胞膜进入到微生物的体内;说明跨膜运输是红球菌降解荧蒽的一个重要步骤,若荧蒽无法进入到红球菌细胞内,就不能得到有效的生物降解.
3.3 在不同的底物浓度条件下,红球菌 BAP-1对14C-荧蒽的跨膜运输过程是需要能量的主动运输过程;在一定的底物浓度条件下,当菌体密度的初始值持续增加时,膜结合14C-荧蒽的量并没有随着增加,20min膜结合14C-荧蒽的量保持在(0.2647±0.0029)µmol/L 左右,菌体膜结合污染物的量会在一定的条件下达到饱和.
3.4 对红球菌BAP-1跨膜运输14C-荧蒽的动力学过程研究表明,底物14C-荧蒽与红球菌BAP-1一直保持较高的亲和力,红球菌BAP-1通过主动运输的方式对14C-荧蒽进行跨膜运输,较高的亲和力有助于跨膜运输过程的顺利进行.
参考文献:
[1]Hua F, Wang H. Uptake modes of octadecane by Pseudomonas sp.DG17 and synthesis of biosurfactant [J]. Journal of Applied Microbiology, 2012,112(1):25-37.
[2]Fernando Bautista L, Sanz R, Carmen Molina M, et al. Effect of different non-ionic surfactants on the biodegradation of PAHs by diverse aerobic bacteria [J]. International Biodeterioration &Biodegradation, 2009,63(7):913-922.
[3]Haritash A K, Kaushik C P. Biodegradation aspects of Polycyclic Aromatic Hydrocarbons (PAHs): A review [J]. Journal of Hazardous Materials, 2009,169(1-3):1-15.
[4]Song X, Xu Y, Li G, et al. Isolation, characterization of Rhodococcus sp. P14capable of degrading high-molecularweight polycyclic aromatic hydrocarbons and aliphatic hydrocarbons [J]. Marine Pollution Bulletin, 2011,62(10):2122-2128.
[5]刁 硕,王红旗,许 洁,等.低温耐盐芘降解菌的筛选鉴定及降解特性研究 [J]. 中国环境科学, 2017,37(2):677-685.
[6]Kolomytseva M P, Randazzo D, Baskunov B P, et al. Role of surfactants in optimizing fluorene assimilation and intermediate formation by Rhodococcus rhodochrous VKM B-2469 [J].Bioresource Technology, 2009,100(2):839-844.
[7]Whyte L G, Slagman S J, Pietrantonio F, et al. Physiological adaptations involved in alkane assimilation at a low temperature by Rhodococcus sp. Strain Q15 [J]. Applied and Environmental Microbiology, 1999,65(7):2961-2968.
[8]Wick L, Munain A D, Springael D, et al. Responses of Mycobacterium sp. LB501T to the low bioavailability of solid anthracene [J]. Applied Microbiology and Biotechnology, 2002,58(3):378-385.
[9]Lang S, Philp J C. Surface-active lipids in rhodococci [J].Antonie Van Leeuwenhoek, 1998,74(1):59-70.
[10]Beal R, Betts W B. Role of rhamnolipid biosurfactants in the uptake and mineralization of hexadecane in Pseudomonas aeruginosa [J]. Journal of Applied Microbiology, 2000,89(1):158-168.
[11]Bateman J N, Speer B, Feduik L, et al. Naphthalene association and uptake in Pseudomonas putida [J]. Journal of Bacteriology,1986,166(1):155-161.
[12]Bugg T, Foght J M, Pickard M A, et al. Uptake and active efflux of polycyclic aromatic hydrocarbons by Pseudomonas fluorescens LP6a [J]. Applied and Environmental Microbiology, 2000,66(12):5387-5392.
[13]Li Y, Wang H, Hua F, et al. Trans-membrane transport of fluoranthene by Rhodococcus sp. BAP-1and optimization of uptake process [J]. Bioresource Technology, 2014,155(155C):213-219.
[14]Kallimanis A, Frillingos S, Drainas C, et al. Taxonomic identification, phenanthrene uptake activity, and membrane lipid alterations of the PAH degrading Arthrobacter sp. strain Sphe3 [J].Applied Microbiology and Biotechnology, 2007,76(3):709-717.
[15]Miyata N, Iwahori K, Foght J M, et al. Saturable, energydependent uptake of phenanthrene in aqueous phase by Mycobacterium sp. Strain RJGII-135 [J]. Applied and Environmental Microbiology, 2004,70(1):363-369.
[16]Hua F, Wang H Q, Li Y, et al. Trans-membrane transport of n-octadecane by Pseudomonas sp. DG17 [J]. Journal of Microbiology, 2013,51(6):791-799.
[17]Alvarez H M, Mayer F, Fabritius D, et al. Formation of intracytoplasmic lipid inclusions by Rhodococcus opacus strain PD630 [J]. Archives of Microbiology, 1996,165(6):377-386.
[18]Kennedy R S, Finnerty W R. Microbial assimilation of hydrocarbons. I. The fine-structure of a hydrocarbon oxidizing Acinetobacter sp [J]. Archives of Microbiology, 1975,102(2):75-83.
[19]Li Y, Wang H, Hua F. Uptake Modes of Fluoranthene by Strain Rhodococcus Sp. Bap-1 [J]. Biotechnology & Biotechnological Equipment, 2013,27(6):4256-4262.
[20]易 修,袁嘉韩,顾锁娣,等.小麦根系吸收萘、菲、芘的动力学特征 [J]. 环境科学学报, 2013,33(4):1135-1140.

