CT定量参数预测评估肺混合磨玻璃结节侵袭性的临床价值*
由于高分辨计算机断层扫描(high-resolution computed tomography,HRCT)技术的应用及肺癌筛查在高危人群中的广泛开展,越来越多的肺磨玻璃结节(ground glass nodules,GGNs)被检出。肺磨玻璃结节在CT肺窗上表现为云雾状密度增高影,该云雾状影不能掩盖其内血管及支气管,而在纵隔窗上不可见或仅有病灶实性成分可见。根据是否含实性成分,GGNs分为纯磨玻璃结节(pure ground-glass nodule,pGGNs)和混合磨玻璃结节(mixed ground glass nodules,mGGNs)[1-2]。其病理类型分为非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinomain situ,AIS)、微浸润性腺癌(minimally invasive adenocarcinoma,MIA)和浸润性腺癌(invasive adenocarcinoma,IAC)[3]。GGNs中MIA和IAC多见于mGGNs。研究表明,在手术切缘阴性的情况下,MIA患者5年无瘤生存期可达或接近100%[3],MIA也是肺楔形切除术或肺节段切除术的适应证[4],相对于肺叶切除术可有效减少手术相关并发症[5-6]。此外,另有研究表明在直径≤3cm的肺腺癌中,IAC伴发淋巴结转移的概率更高,影响患者预后[7]。鉴于MIA和IAC的治疗方案和预后不同,本研究就日常工作中CT图像上简便易测的参数(肺窗最大径、肺窗最大径的最大垂直径、肺窗病灶体积、平均CT值、纵隔窗最大径、纵隔窗最大径的最大垂直径、纵隔窗病灶体积)进行分析,以期为有效区分MIA和IAC提供简便的预判标准,为患者的术前评估及治疗方案的选择提供一定的参考。
1 材料与方法
1.1 临床资料
回顾性分析天津医科大学肿瘤医院2013年1月至2016年9月经手术病理证实的164例CT上表现为mGGNs的肺癌患者的临床及CT影像资料。其中女性120例,男性44例;年龄36~79岁,平均年龄58.8岁;MIA组30例,IAC组134例。所有病例均为单发病灶,确诊前未接受过任何治疗。
1.2 方法
1.2.1 GE750 CT机器扫描检查 所有患者均在术前经GE750 CT机器扫描,范围从肺尖扫描至肺底,扫描参数如下:管电压120 kVp,管电流150~200 mA,螺距0.984∶1,层厚1.25 mm。采用高分辨率重建算法重建图像,肺窗设置(窗宽1 500 HU,窗位-500 HU)和纵隔窗设置(窗宽350 HU,窗位50 HU)。所有入组图像均为轴位平扫CT图像。
1.2.2 CT图像分析 所有病灶的CT定量参数均由2名放射科医师共同商讨通过Osirix MD软件勾画、测量完成(图1)。肺窗上测量的参数为:病灶的最大径、最大径的最大垂直径、病灶的总体积以及平均CT值。在纵隔窗上测量的参数为:病灶的最大径、病灶最大径的最大垂直径以及实性成分的体积。在CT图像上勾画出病变各层面轮廓后,体积通过软件自动计算得出;平均CT值则是将病灶包含实性成分的最大面积层面的感兴趣区(region of interest,ROI)及其上下相邻2个层面的ROI所代表的CT值求和后计算平均值得出。勾画时ROI应尽可能大,避免覆盖大面积支气管和血管以及病灶内的含气空腔。TDR(tu⁃mor shadow disappearance rate)计算公式:TDR=1-(纵隔窗病灶的最大径×病灶最大径的最大垂直径/肺窗病灶的最大径×肺窗最大径的最大垂直径)。

图1 肺窗及纵隔窗示例
1.3 统计学分析
使用SPSS 23.0软件及MedCalc 15.6.1进行统计学分析。采用χ2检验对分类变量进行分析,采用Mann-Whitney秩和检验对连续变量进行分析,P<0.05为差异具有统计学意义。对具有统计学意义的参数行受试者工作曲线(ROC)分析,以Youden指数作为截断点。采用两两比较的方式对ROC曲线进行比较,选出对预测侵袭性更有意义的参数进行二元Logistic回归分析,并建立逻辑回归方程。
2 结果
本研究中164例患者mGGNs的基本分类情况见表1,各项指标中年龄和性别的分布在MIA组和IAC组中差异无统计学意义(P>0.05),其他CT定量参数均存在差异(P<0.05)。两组中各参数的平均值、标准差以及P值见表2,IAC组的各项径线值、体积测量值及平均CT值均较MIA组高,但TDR值明显低于MIA组。
经过对肺窗最大径、肺窗最大径的最大垂直径、肺窗病灶体积、平均CT值、纵隔窗最大径、纵隔窗最大径的最大垂直径、纵隔窗病灶体积、TDR进行ROC曲线分析,各参数的ROC曲线下面积(AUC)、95%的置信区间(CI)、截断值、灵敏度、特异度(表3),其中平均CT值的AUC最小,虽然其灵敏度为88.06%,但特异度仅为36.67%,表现较差。成对比较这8个参数的ROC曲线得到仅有4组两两比较的结果有显著性差异(P<0.05),即纵隔窗病灶体积与纵隔窗最大径、平均CT值分别与TDR、肺窗最大径及纵隔窗最大径所对应的ROC曲线均有差异(表4)。由于平均CT值在各项比较中的表现最差,故二元Logistic回归模型不将其纳入方程,而另外7个参数经向前回归被纳入方程。经运算,肺窗最大径和纵隔窗最大径最终进入方程内,该逻辑回归模型的预测概率方程为P=,其中变量X代表肺窗最大径(OR=3.080,95%CI:1.135~8.355,P=0.027),变量X2代表纵隔窗最大径(OR=5.881,95%CI:1.634~21.166,P=0.007)。两个参数联合预测mGGNs病理分型的ROC曲线见图2,其ROC曲线下面积为0.855,灵敏度为77.61%,特异度为86.67%,截断值所对应的肺窗最大径为1.902 cm,纵隔窗最大径为1.273 cm。

表1 164例mGGNs的分类情况

表2 两组中CT定量参数的分析
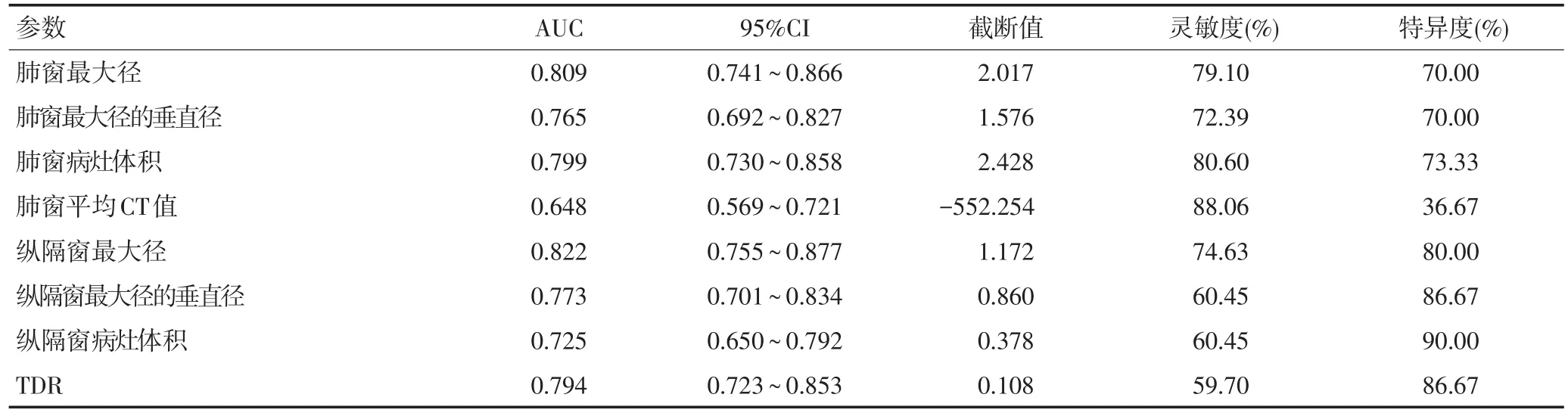
表3 各参数的ROC曲线分析
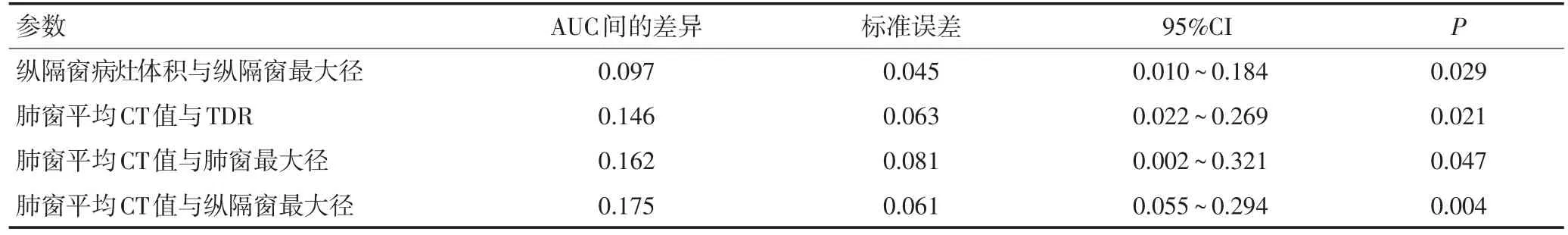
表4 ROC曲线成对比较有差异的参数

图2 肺窗最大径联合纵隔窗最大径的ROC曲线
3 讨论
肺磨玻璃结节以mGGNs恶性倾向较大[8],预测评估其侵袭性具有一定的临床意义。目前,已有多项针对肺磨玻璃结节CT形态学特征的研究[9-13],但这些形态学特征分析时易受主观因素影响,而CT定量参数更加客观直接,对预测其侵袭性具有重要意义[4,14-15]。
本研究中mGGNs的肺窗最大径、肺窗最大径的最大垂直径、肺窗病灶体积、肺窗平均CT值、纵隔窗最大直径、纵隔窗最大径的最大垂直径、纵隔窗病灶体积及TDR在MIA组和IAC组间均存在显著性差异(P<0.01)。经二元Logsitic回归分析,病灶的肺窗最大径和纵隔窗最大径为最重要的两个预测因素,即当病灶肺窗最大径≥1.902 cm及纵隔窗最大径≥1.273 cm时,mGGNs的病理分型更倾向为IAC,其AUC为0.855,灵敏度77.61%,特异度86.67%。本研究中IAC组的肺窗及纵隔窗最大径的平均值均高于MIA组,提示mGGNs直径越大,其内实性成分越多,恶性的可能性越高[16]。且肺窗及纵隔窗最大径对应的侵袭性阈值均高于 Zhang等[13]、Ding等[17]及 Liu等[18]研究结果。既往研究多将AAH和AIS与MIA列为一组分析,而AAH与AIS病灶多为纯磨玻璃结节,实性成分少见或实性成分比例较小;本研究仅针对mGGNs,且分析时将MIA单独列为一组与IAC进行比较。
Eguchi等[19]研究显示MIA及IAC的CT值分别约为-625 HU和-560 HU,表明结节中磨玻璃成分密度越高,其恶性可能性越大,与本研究结果一致。但在预测侵袭性的ROC成对比较中,本研究的平均CT值效能低于其他定量参数,可能是取值来源于含有实性成分的最大横截面积及其上下两个层面的平均CT值,并未包含病灶每一个层面的ROI。此外,Matsugu⁃ma等[20]研究磨玻璃结节内的实性成分比例与肺癌的侵袭性的关系,显示病灶中磨玻璃成分与其侵袭性呈负相关。TDR被用于描述肿瘤中磨玻璃密度影的比例,被认为是评估肺癌影像学侵袭性的标准[21]。TDR所对应的值越大,代表肺磨玻璃结节中的侵袭性成分越少,侵袭性越低,预后也相对越好[21]。本研究中MIA组TDR值明显大于IAC组,符合其侵袭性降低趋势。尽管TDR对应的AUC为0.794,灵敏度却仅为59.70%,原因可能为本研究中MIA和IAC两组样本数量相差较大,导致统计学偏倚。但TDR预测评估mGGNs侵袭性的特异度为86.67%,提示TDR可能有助区分MIA和IAC,但尚需扩大样本量以验证结论可靠性。
综上所述,CT定量参数对于预测评估肺mGGNs侵袭性具有一定的价值,其中肺窗最大径(≥1.902 cm)及纵隔窗最大径(≥1.273 cm)是mGGNs侵袭性的独立预测因子,可为临床决策提供一定的参考依据。
[1]Oh JY,Kwon SY,Yoon HI,et al.Clinical significance of a solitary ground‐glass opacity(GGO)lesion of the lung detected by chest CT[J].Lung Cancer,2007,55(1):67‐73.
[2]Kim HY,Shim YM,Lee KSI,et al.Persistent pulmonary nodular ground‐glass opacity at thin‐section CT:histopathologic compari‐sons[J].Radi,2007,245(1):267‐275.
[3]Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J].J Thora Oncol,2011,6(2):244‐285.
[4]Dembitzer FR,Flores RM,Parides MK,et al.Impact of histologic subtyping on outcome in lobar vs sublobar resections for lung can‐cer:a pilot study[J].Chest,2014,146(1):175‐181.
[5]Yoshimoto K,Nomori H,Mori T,et al.Quantification of the impact of segmentectomy on pulmonary function by perfusion single‐pho‐ton‐emission computed tomography and multidetector computed tomography[J].J Thora Cardi Surg,2009,137(5):1200‐1205.
[6]Macke RA,Schuchert MJ,Odell DD,et al.Parenchymal preserving anatomic resections result in less pulmonary function loss in pa‐tients with Stage I non‐small cell lung cancer[J].J Thora Cardi Surg,2015,(10):49.
[7]Yu Y,Jian H,Shen L,et al.Lymph node involvement influenced by lung adenocarcinoma subtypes in tumor size≤3 cm disease:A study of 2268 cases[J].Eur J Surg Oncol,2016,42(11):1714‐1719.
[8]Lee HJ,Goo JM,Lee CH,et al.Nodular ground‐glass opacities on thin‐section CT:size change during follow‐up and pathological re‐sults[J].Korean J Radi,2007,8(1):22‐31.
[9]Gao F,Ge XJ,Li M,et al.CT diagnosis of different pathological types of ground‐glass nodules[J].Chin J Oncol,2014,36(3):188‐192.
[10]Lee SM,Goo JM,Lee KH,et al.CT findings of minimally invasive ad‐enocarcinoma(MIA)of the lung and comparison of solid portion measurement methods at CT in 52 patients[J].Eur Radi,2015,25(8):2318‐2325.
[11]Si MJ,Tao XF,Du GY,et al.Thin‐section computed tomography‐his‐topathologic comparisons of pulmonary focal interstitial fibrosis,atypical adenomatous hyperplasia,adenocarcinoma in situ,and minimally invasive adenocarcinoma with pure ground‐glass opacity[J].Eur J Radi,2016,85(10):1708‐1715.
[12]Yanagawa M,Johkoh T,Noguchi M,et al.Radiological prediction of tumor invasiveness of lung adenocarcinoma on thin‐section CT[J].Med,2017,96(11):e6331.
[13]Zhang Y,Shen Y,Qiang JW,et al.HRCT features distinguishing pre‐invasive from invasive pulmonary adenocarcinomas appearing as ground‐glass nodules[J].Eur Radi,2016,26(9):2921‐2928.
[14]Son JY,Lee HY,Kim JH,et al.Quantitative CT analysis of pulmonary ground‐glass opacity nodules for distinguishing invasive adenocar‐cinoma from non‐invasive or minimally invasive adenocarcinoma:the added value of using iodine mapping[J].Eur Radi,2016,26(1):43‐54.
[15]Kadota K,Villena‐Vargas J,Yoshizawa A,et al.Prognostic signifi‐cance of adenocarcinoma in situ,minimally invasive adenocarcino‐ma,and nonmucinous lepidic predominant invasive adenocarcino‐ma of the lung in patients with stage I disease[J].Am J Surg Path,2014,38(4):448‐460.
[16]Yanagawa M,Tanaka Y,Kusumoto M,et al.Automated assessment of malignant degree of small peripheral adenocarcinomas using volumetric CT data:correlation with pathologic prognostic factors[J].Lung Cancer,2010,70(3):286‐294.
[17]Ding H,Shi J,Zhou X,et al.Value of CT characteristics in predicting invasiveness of adenocarcinoma presented as pulmonary ground‐glass nodules[J].Thoracic and cardiovascular surgeon,2017,65(2):136‐141.
[18]Liu Y,Sun H,Zhou F,et al.Imaging features of TSCT predict the clas‐sification of pulmonary preinvasive lesion,minimally and invasive adenocarcinoma presented as ground glass nodules[J].Lung Can‐cer,2017,(108):192‐197.
[19]Eguchi T,Yoshizawa A,Kawakami S,et al.Tumor size and computed tomography attenuation of pulmonary pure ground‐glass nodules are useful for predicting pathological invasiveness[J].PloS One,2014,9(5):e97867.
[20]Matsuguma H,Oki I,Nakahara R,et al.Comparison of three mea‐surements on computed tomography for the prediction of less in‐vasiveness in patients with clinical stage I non‐small cell lung cancer[J].Ann Thora Surg,2013,95(6):1878‐1884.
[21]Takamochi K,Nagai K,Yoshida J,et al.Pathologic N0 status in pul‐monary adenocarcinoma is predictable by combining serum car‐cinoembryonic antigen level and computed tomographic findings[J].J Thora Cardiova Surg,2001,122(2):325‐330.

