18F-FDG PET/CT在结外NK/T细胞淋巴瘤中的预后价值
综述 审校
结外NK/T细胞淋巴瘤(extranodal natural killer/T-cell lymphoma,ENKTL)是一种特殊类型的侵袭性非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL),起源于NK细胞和T细胞,在世界卫生组织(WHO)分类中属于成熟T细胞和NK细胞淋巴瘤的亚型[1]。其分布有明显的地域差异,好发于亚洲和南美洲,西方国家少见[2-3]。ENKTL常侵及上呼吸消化道,尤其是鼻咽部,主要表现为面部中线组织的进行性坏死,也可发生于皮肤、胃肠道、睾丸、唾液腺等部位。早期(Ⅰ/Ⅱ期)患者,多采用放疗或放化疗联合的综合治疗,晚期(Ⅲ/Ⅳ期)患者主要采用全身化疗。近年来,随着放疗技术的发展及以左旋门冬酰胺酶为基础的化疗方案的应用,其疗效有了一定的提高,但预后仍然不佳,5年总生存(overall survival,OS)率约为32%,中位总生存时间(median overall survival,mOS)约为8个月[4-5]。
目前,ENKTL常用的预后模型主要包括国际预后指数(international prognostic index,IPI)[6]和韩国预后指数(Korean prognostic index,KPI)[7],尚存在一定的局限性,如基于效果较差的、以蒽环类药物为基础的化疗方案所提出,未在前瞻性试验中验证,仅凭CT扫描进行分期和评价疗效等[2]。为建立更全面且有效的预后模型,亚洲淋巴瘤研究组织(Asia lymphoma study group,ALSG)以非蒽环类方案化疗的ENKTL为研究对象,发起了一项国际多中心回顾性研究[8],建立了新的预后模型─NK细胞淋巴瘤预后指数(prog⁃nostic index of natural killer cell lymphoma,PINK)。研究还发现,EB病毒(epstein-barr virus,EBV)DNA滴度为OS的独立预后因素,进而建立了包含EBV DNA的NK细胞淋巴瘤预后指数(prognostic index of natu⁃ral killer cell lymphoma with epstein-barr virus DNA,PINK-E)。目前,PINK和PINK-E预后模型用于以非蒽环类化疗的ENKTL预后评估。
正电子发射断层显像融合计算机断层扫描(posi⁃tron emission tomography/computed tomography,PET/CT)是一种将功能代谢显像和解剖结构显像有机结合的新型影像技术,18F标记的氟代脱氧葡萄糖(fluo⁃rine-18-fluorodeoxyglucose,18F-FDG)是最常用的示踪剂。目前,18F-FDG PET/CT广泛用于淋巴瘤的临床分期、疗效评价、预后评估、复发监测及复发后再分期,尤其是在霍奇金淋巴瘤(Hodgkin's lymphoma,HL)和弥漫大B细胞淋巴瘤(diffuse large B-cell lym⁃phoma,DLBCL)[9-11]。ENKTL具有较高的18F-FDG摄取[12-13],PET/CT为其临床诊疗中推荐的成像方式之一。近年研究发现PET/CT与ENKTL的预后存在一定的联系,部分学者根据PET/CT建立了新的预后模型。本文旨在针对不同时期的PET/CT对于ENKTL的预后价值进行综述。
1 治疗前18F-FDG PET/CT
ENKTL治疗前行PET/CT主要用于明确疾病累及的范围,协助分期和制定治疗方案,研究表明其准确性明显优于传统影像学技术[14-15]。近年来,多项研究报道治疗前PET/CT对ENKTL具有一定的预后价值[16-20]。
Bai等[16]回顾性分析81例初诊ENKTL患者,以治疗前病灶的最大标准摄取值(maximum standardized uptake value,SUVmax)为评估参数,探索PET/CT与无进展生存(progression-free survival,PFS)和OS之间的相关性。研究结果提示,SUVmax>15(P=0.020)为OS的独立预后因素。Jiang等[17]在一项前瞻性研究中得出了相似的结论,即治疗前SUVmax为PFS(P<0.01)和OS(P=0.01)的独立预后因素。Pak等[18]开展了一项多中心回顾性研究,纳入36例ENKTL,分别以SUVmax、平均标准摄取值(mean standardized uptake value,SUVmean)、肿瘤代谢体积(metabolic tumor volume,MTV)和病灶糖酵解总量(total lesion glycolysis,TLG)作为PET/CT的评估参数,评估治疗前PET/CT的预后价值。研究结果显示,治疗前较高的TLG(>45.8)为无复发生存(P=0.034)的唯一预测因素,SUVmax(P=0.024)和SUVmean(P=0.024)为OS的重要预测因素。Kim等[19]、Chang等[20]分别开展了两项回顾性分析,以SUVmax、全身肿瘤代谢体积(whole-body metabolic tumor volume,WBMTV)和全身糖酵解总量(whole-body total lesion glycolysis,WBTLG)为评估参数,探究治疗前PET/CT对ENKTL的预后价值。上述两项研究得出了相同的结论:WBMTV为PFS(P<0.05)和OS(P<0.05)的最佳预测因素。Kim等[19]研究认为SUVmax(P=0.036)和WBTLG(P=0.035)为PFS的有效预测因素;而Chang等[20]研究认为SUVmax为OS(P=0.017)的独立预后因素。另外,Kim等[19]提出将IPI评分和PET/CT相结合的预后模型,即使IPI评分较低,若患者同时具有较高的PET/CT参数,则意味着预后较差,该类患者可能适用于更大强度的治疗方案。
上述研究表明,对于ENKTL的治疗前PET/CT,不同的参数均显示出与预后的相关性,参数高的患者较参数低的患者预后更差。目前研究得知,治疗前PET/CT对ENKTL具有一定的预后意义。
2 中期18F-FDG PET/CT
ENKTL的治疗中期PET/CT多于2~4个周期化疗后进行,可较传统CT扫描更好地评价疗效。目前,关于中期PET/CT对ENKTL预后价值的研究较少,评价参数不一致,研究结论不完全统一[17,20-22]。治疗中期或治疗后PET/CT的评价参数多采用淋巴瘤国际协调专家组(international harmonization project,IHP)共识、Deauville 5点量表(deauville 5-point scale,DS)评分和ΔSUVmax。IHP共识主要采用目测法来判断PET/CT扫描结果,将其分为阳性和阴性[9]。DS评分由第一届国际研讨会提出[23],根据残留病灶摄取示踪剂的能力将其分为1~5分:1~3分判定为PET/CT阴性,4~5分判定为阳性。ΔSUVmax反映了病灶SU⁃Vmax的降低程度,其计算公式为:ΔSUVmax(%)=[100×(治疗前SUVmax-治疗中期或治疗结束后SUV⁃max)/治疗前SUVmax]。
Jiang等[17]在一项前瞻性临床研究中,采用IHP共识对33例ENKTL的中期PET/CT进行预后评价。结果显示,PET/CT阳性组和阴性组的PFS(P=0.07)和OS(P=0.09)比较,差异无统计学意义。Jiang等[21]在其另一项前瞻性临床研究中,纳入了60例ENKTL,分别采用IHP共识、DS评分及ΔSUVmax 3种方法评价中期PET/CT的预后价值,中位随访时间为23.5个月。结果显示,基于IHP共识的中期PET/CT评价非ENKTL的独立预后因素;基于DS评分的治疗中期PET/CT为PFS(P<0.001)和OS(P<0.001)的独立预后因素;ΔSUVmax为OS(P=0.013)的独立预后因素,但非 PFS(P=0.054)的独立预后因素。Chang等[20]、Khong等[22]分别对ENKTL进行了回顾性和前瞻性临床研究,使用DS评分对治疗中期PET/CT进行评估,得出了相同的结论:基于DS评分的治疗中期PET/CT评价为PFS(P<0.05)和OS(P<0.05)的独立预后因素。
上述研究提示,IHP共识并非治疗中期PET/CT预测预后的有效方法,因其未对病灶进行摄取能力的测定,仅凭肉眼判断将治疗反应分为阳性和阴性,存在较大的误差。DS评分为PFS和OS的独立预后因素,体现出良好的预后价值。出现上述结果的可能原因为:1)与IHP共识相比,DS评分根据病灶放射性摄取的不同,将其分为5个等级,具有更好的连续性;2)DS评分将病灶的放射性摄取能力与患者自身背景组织、纵隔血池及肝脏对比,考虑到个体差异因素,具有更好的普适性和重复性。ΔSUVmax在Jiang等[21]的研究中体现出预后价值,亟需更多的研究进一步验证。因此,目前研究表明,基于DS评分的治疗中期PET/CT评价对ENKTL具有一定的预后价值。
3 治疗后18F-FDG PET/CT
ENKTL于治疗结束后行PET/CT,一方面可以评价治疗效果,指导疗效较差者进行巩固治疗或挽救治疗;另一方面可以监测疾病状态,了解患者是否存在复发或转移。近年多项研究提示,治疗后PET/CT对ENKTL具有一定的预后意义[17,20,24]。
Jiang等[17]在一项前瞻性研究中,用IHP共识评价治疗后PET/CT对ENKTL的预后价值。多因素分析提示,基于IHP共识的治疗后PET/CT评价为PFS(P<0.01)和OS(P=0.04)的独立预后因素。Jiang等[24]还对59例ENKTL开展了回顾性分析,使用IHP共识、DS评分及ΔSUVmax 3种方法分别对治疗后PET/CT进行评价,研究其预后价值。研究结果提示,基于IHP共识的PET/CT评价不具有预后意义;DS评分为PFS(P=0.008)和OS(P=0.002)的重要预后因素;ΔSU⁃Vmax为PFS(P=0.019)的独立预后因素,但非OS的独立预后因素。Chang等[20]对28例治疗后行PET/CT的ENKTL开展了回顾性分析,采用DS评分作为评价参数。研究结果提示,基于DS评分的治疗后PET/CT评价为PFS(P=0.025)和OS(P=0.034)的独立预后因素。
上述研究提示,治疗后PET/CT对于ENKTL的预后评价,采用了IHP共识、DS评分、ΔSUVmax等不同的评价参数,与IHP共识和ΔSUVmax相比,DS评分可以更好地预测预后。因此,根据目前研究得出,基于DS评分的治疗后PET/CT评价对ENKTL具有一定的预后意义。
4 18F-FDG PET/CT与循环EBV DNA结合的新型预后模型
ENKTL是一种与EBV感染高度相关的恶性肿瘤。研究表明,血循环EBV DNA水平可以预测患者的肿瘤负荷、治疗反应、毒副作用及预后[25-28]。2016年,ALSG将EBV DNA水平作为ENKTL的不良预后因素之一,建立了PINK-E预后模型[8]。近年来,有学者将EBV DAN水平和PET/CT结果相结合,建立了新的预后模型,指导分层治疗[28-29]。
Kim等[28]开展的一项多中心回顾性研究,探究ENKTL治疗后PET/CT和EBV DNA情况对于肿瘤残留、治疗失败和生存结局的预测价值,并对患者进行危险度分层。研究共纳入了140例初治ENKTL,其中102例来自韩国,作为研究队列;38例来自新加坡和中国香港,作为验证队列。在研究队列中,中位随访时间为47.2个月,多因素分析显示,治疗后DS评分为3~4分和EBV DNA阳性为PFS(P<0.001,P=0.002)和OS(P=0.017,P=0.033)的独立预后因素。据此建立新的风险模型,进行危险度分层:1)低危组:DS评分为1~2分且EBV DNA阴性;2)高危组:DS评分为3~4分且EBV DNA阴性,或DS评分为1~2分且EBV DNA阳性;3)治疗失败组:DS评分为3~4分且EBV DNA阳性,或DS评分为5分。结果显示,低危组、高危组和治疗失败组中的治疗失败率分别为15%、62%和100%;3组患者的PFS(P<0.000 1)和OS(P<0.000 1)差异均具有统计学意义。研究者将此风险模型应用于验证队列中,得到了同样的结果。另外,该研究根据其风险模型提出,对于低危组患者,可于治疗结束后密切观察;对于高危组患者,建议其继续增加额外治疗直至DS评分降至1~2分或EBV DNA转为阴性;对于治疗失败组,建议行挽救治疗或者参加临床试验。Lim等[29]在一项临床研究中建立了类似的预后模型,评估ENKTL自体造血干细胞移植前的PET/CT和EBV DNA情况的预后价值。研究共纳入27例ENKTL,中位随访时间为36.9个月。根据DS评分及EBV DNA状态,将其分为两组:1)低风险组:DS评分为1~2分且EBV DNA阴性;2)高风险组:DS评分为1~2分且EBV DNA阳性、或评分为3~5分而不论EBV DNA状态。多因素分析提示,DS评分和EBV DNA状态为PFS(P=0.025)和OS(P=0.025)的独立预后因素。
尽管上述研究存在一些局限性,如纳入研究的病例数过少;DS评分截点值的划分可能存在误差;未在前瞻性临床试验中验证等,但是该研究提供了新的研究思路,即将PET/CT与EBV DNA相结合建立新的预后模型(表1)。
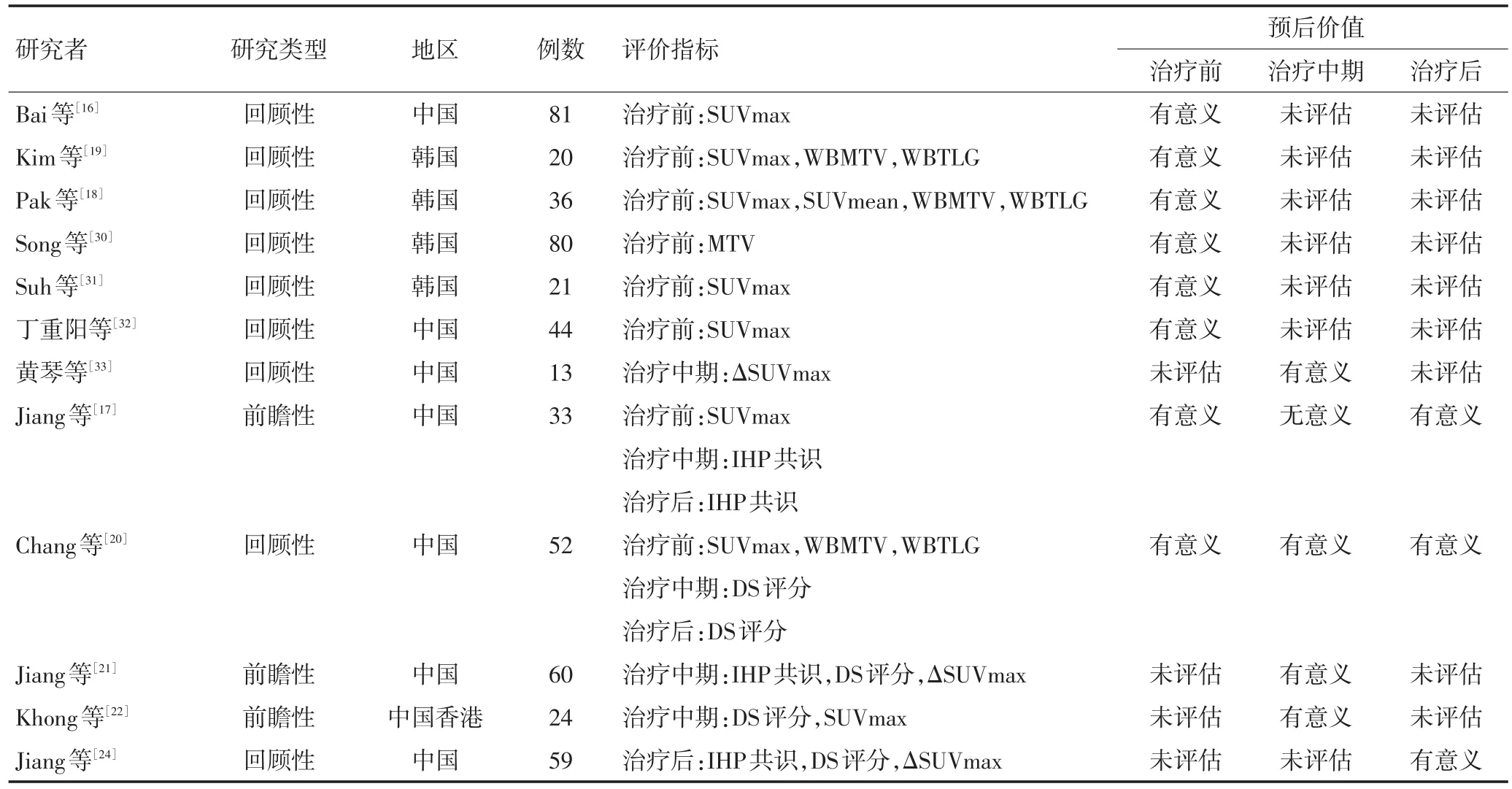
表1 18F-FDG PET/CT在结外NK/T细胞淋巴瘤预后价值的相关研究
5 结语
目前,国内外有多项研究对ENKTL治疗前、治疗中期及治疗后PET/CT的预后价值进行评估,且大多得出了肯定的结论,提示PET/CT对ENKTL具有一定的预后价值。但是,不同研究采用的治疗方案、评价参数等有所不同,得出具有预后价值的PET/CT参数也不同。另一方面,这些研究大多为小样本、回顾性研究,尚需在更多前瞻性、大样本临床研究中验证,并得出统一、公认、有效的评价参数。此外,目前仍无根据PET/CT结果调整ENKTL的治疗方案、指导临床治疗的相关研究。随着肿瘤学和核医学的不断发展,PET/CT在ENKTL中的预后价值将更加明确,也将更广泛地用于指导患者的分层治疗。
[1]Swerdlow SH,Campo E,Pileri SA,et al.The 2016 revision of the world health organization classification of lymphoid neoplasms[J].Blood,2016,127(20):2375.
[2]Tse E,Kwong YL.How I treat NK/T‐cell lymphomas[J].Blood,2013,121(25):4997‐5005.
[3]Sun J,Yang Q,Lu Z,et al.Distribution of lymphoid neoplasms in China analysis of 4 638 cases according to the world health organi‐zation classification[J].Am J Clin Pathol,2012,138(3):429‐434.
[4]Au Wy,Weisenburger DD,Intragumtornchai T,et al.Clinical differ‐ences between nasal and extranasal natural killer/T‐cell lympho‐ma:a study of 136 cases from the international peripheral T‐Cell lymphoma project[J].Blood,2009,113(17):3931‐3937.
[5]Vose J,Armitage J,Weisenburger D,et al.International peripheral T‐cell and natural killer/T‐cell lymphoma study:pathology findings and clinical outcomes[J].J Clin Oncol,2008,26(25):4124‐4130.
[6]The International Non‐Hodgkin's Lymphoma Prognostic Factors Project.A predictive model for aggressive Non‐Hodgkin's lympho‐ma[J].N Engl J Med,1993,329(14):987‐994.
[7]Lee J,Suh C,Park YH,et al.Extranodal natural killer T‐cell lympho‐ma,nasal‐type:a prognostic model from a retrospective multi‐center study[J].J Clin Oncol,2006,24(4):612‐618.
[8]Kim SJ,Yoon DH,Jaccard A,et al.A prognostic index for natural killer cell lymphoma after non‐anthracycline‐based treatment:a multi‐centre,retrospective analysis[J].Lancet Oncol,2016,17(3):389‐400.
[9]Juweid ME,Stroobants S,Hoekstra OS,et al.Use of positron emis‐sion tomography for response assessment of lymphoma:consen‐sus of the imaging subcommittee of international harmonization project in lymphoma[J].J Clin Oncol,2007,25(5):571‐578.
[10]Cheson BD.Role of functional imaging in the management of lym‐phoma[J].J Clin Oncol,2011,29(14):1844‐1854.
[11]Hutchings M,Barrington SF.PET/CT for therapy response assess‐ment in lymphoma[J].J Nucl Med,2009,5(50 Suppl 1):S21‐S30.
[12]Khong PL,Pang CBY,Liang R,et al.Fluorine‐18 fluorodeoxyglucose positron emission tomography in mature T‐cell and natural killer cell malignancies[J].Ann Hematol,2008,87(8):613‐621.
[13]Chan WKS,Au WY,Wong CYO,et al.Metabolic activity measured by18F‐FDG PET in natural killer‐cell lymphoma compared to aggres‐sive B‐and T‐cell lymphomas[J].Clin Nucl Med,2010,35(8):571‐575.
[14]Moon SH,Cho SK,Kim WS,et al.The role of18F‐FDG PET/CT for ini‐tial staging of nasal type natural killer/T‐cell lymphoma:a compari‐son with conventional staging methods[J].J Nucl Med,2013,54(7):1039‐1044.
[15]Fujiwara H,Maeda Y,Nawa Y,et al.The utility of positron emission tomography/computed tomography in the staging of extranodal natural killer/T‐cell lymphoma[J].Eur J Haematol,2011,87(2):123‐129.
[16]Bai B,Huang HQ,Cai QC,et al.Predictive value of pretreatment positron emission tomography/computed tomography in patients with newly diagnosed extranodal natural killer/T‐cell lymphoma[J].Med Oncol,2013,30(1):339.
[17]Jiang C,Zhang X,Jiang M,et al.Assessment of the prognostic capac‐ity of pretreatment,interim,and post‐therapy18F‐FDG PET/CT in ex‐tranodal natural killer/T‐cell lymphoma,nasal type[J].Ann Nucl Med,2015,29(5):442‐451.
[18]Pak K,Kim BS,Kim K,et al.Prognostic significance of standardized uptake value on18F‐FDG PET/CT in patients with extranodal nasal type NK/T cell lymphoma:a multicenter,retrospective analysis[J].Am J Otolaryngol,2018,39(1):1‐5.
[19]Kim CY,Hong CM,Kim DH,et al.Prognostic value of whole‐body metabolic tumour volume and total lesion glycolysis measured on18F‐FDG PET/CT in patients with extranodal NK/T‐cell lymphoma[J].Eur J Nucl Med Mol Imaging,2013,40(9):1321‐1329.
[20]Chang Y,Fu X,Sun Z,et al.Utility of baseline,interim and end‐of‐treatment18F‐FDG PET/CT in extranodal natural killer/T‐cell lym‐phoma patients treated with L‐asparaginase/pegaspargase[J].J He‐matol Oncol,2017,(7):41057.
[21]Jiang C,Su M,Kosik RO,et al.The deauville 5‐point scale improves the prognostic value of interim FDG PET/CT in extranodal natural killer/T‐cell lymphoma[J].Clin Nucl Med,2015,40(10):767‐773.
[22]Khong PL,Huang B,Phin Lee EY,et al.Midtreatment18F‐FDG PET/CT scan for early response assessment of SMILE therapy in natural kill‐er/T‐cell lymphoma:a prospective study from a single center[J].J Nucl Med,2014,55(6):911‐916.
[23]Meignan M,Gallamini A,Meignan M,et al.Report on the first inter‐national workshop on interim‐PET scan in lymphoma[J].Leuk Lym‐phoma,2009,50(8):1257‐1260.
[24]Jiang C,Liu J,Li L,et al.Predictive approaches for post‐therapy PET/CT in patients with extranodal natural killer/T‐cell lymphoma:a ret‐rospective study[J].Nucl Med Commun,2017,38(11):937.
[25]Ito Y,Kimura H,Maeda Y,et al.Pretreatment EBV‐DNA copy num‐ber is predictive of response and toxicities to SMILE chemotherapy for extranodal NK/T‐cell lymphoma,nasal type[J].Clin Cancer Res:An Offi J Am Associ Cancer Res,2012,18(15):4183‐4190.
[26]Kwong YL,Pang AWK,Leung AYH,et al.Quantification of circulating Epstein‐Barr virus DNA in NK/T‐cell lymphoma treated with the SMILE protocol:diagnostic and prognostic significance[J].Leuke‐mia,2014,28(4):865‐870.
[27]Suzuki R,Yamaguchi M,Izutsu K,et al.Prospective measurement of Epstein‐Barr virus‐DNA in plasma and peripheral blood mononucle‐ar cells of extranodal NK/T‐cell lymphoma,nasal type[J].Blood,2011,118(23):6018‐6022.
[28]Kim SJ,Choi JY,Hyun SH,et al.Risk stratification on the basis of deauville score on PET‐CT and the presence of Epstein‐Barr virus DNA after completion of primary treatment for extranodal natural killer/T‐cell lymphoma,nasal type:a multicentre,retrospective analysis[J].Lancet Haematol,2015,2(2):e66‐e74.
[29]Lim SH,Hyun SH,Kim HS,et al.Prognostic relevance of pretrans‐plant deauville score on PET‐CT and presence of EBV DNA in pa‐tients who underwent autologous stem cell transplantation for EN‐KTL[J].Bone Marrow Transplant,2016,51(6):807‐812.
[30]Song MK,Chung JS,Shin HJ,et al.Clinical value of metabolic tumor volume by PET/CT in extranodal natural killer/T cell lymphoma[J].Leuk Res,2013,37(1):58‐63.
[31]Suh C,Kang YK,Roh JL,et al.Prognostic value of tumor18F‐FDG up‐take in patients with untreated extranodal natural killer/T‐cell lym‐phomas of the head and neck[J].J Nucl Med,2008,49(11):1783‐1789.
[32]丁重阳,吴宇霖,杨文平,等.治疗前18F‐FDG PET‐CT最大标准摄取值在结外NK/T细胞淋巴瘤中的预后意义[J].影像诊断与介入放射学,2015,24(3):242‐246.
[33]黄琴,刘虹,杨晓丰,等.化疗中期18F‐FDG PET/CT显像对自然杀伤/T细胞淋巴瘤的预后评价[J].中华核医学与分子影像杂志,2017,(10):618‐622.

