PD-L1对过敏性鼻炎小鼠Treg/Th17细胞免疫失衡调节作用研究*
王 頔,唐桥斐,姜玉秋,张 爽,李赛楠,闫智永
沈阳医学院附属第二医院耳鼻喉科(沈阳110200)
PD-L1对过敏性鼻炎小鼠Treg/Th17细胞免疫失衡调节作用研究*
王 頔,唐桥斐,姜玉秋,张 爽,李赛楠,闫智永△
沈阳医学院附属第二医院耳鼻喉科(沈阳110200)
*沈阳医学院科研基金资助项目(20161006)
△通讯作者
目的:探讨PD-L1对过敏性鼻炎小鼠Treg/Th17细胞免疫失衡的调节作用。方法:将30只BALB/c小鼠随机分三组,模型组和PD-L1重组蛋白干预组给予卵清蛋白(OVA)诱发过敏性鼻炎,PD-L1重组蛋白干预组给予PD-L1重组蛋白进行处理;正常对照组在相同时间点给予生理盐水。采用叠加量化记分法进行搔鼻、喷嚏及鼻溢症状评价;采用HE染色观察鼻黏膜组织的病理变化,采用免疫组化检测鼻黏膜组织PD-1和PD-L1的表达;Western blot检测鼻粘膜组织p-AKT、、AKT、mTOR、p-mTOR的表达;RT-PCR检测鼻黏膜组织调节性T细胞(Treg)和辅助性T细胞17(Th17)重要转录因子Foxp3、RORγt表达;ELISA法检测血清IL-10、IL-17A、IL-6的水平。结果:正常对照组、模型组、PD-L1重组蛋白干预组行为学评分分别为0、(6.33±1.15)、(3.67±0.58)分,组间比较具有统一学意义(P<0.05)。与正常对照组相比较,模型组鼻粘膜组织损伤严重,鼻粘膜组织中PD-1、PD-L1和Foxp3的表达下降,RORγt、p-AKT、p-mTOR的表达增加,血清IL-10水平下降,血清中IL-17A、IL-6的水平升高,AKT、mTOR的表达无明显变化。与模型组相比较,PD-L1重组蛋白干预组鼻粘膜组织损伤减轻,鼻粘膜组织中PD-1和PD-L1和Foxp3的表达上升,RORγt、p-AKT、p-mTOR表达下降,血清IL-10水平升高,血清中IL-17A、IL-6的水平下降;组间比较差异显著(P<0.05);AKT、mTOR无明显变化。结论:PD-L1通过抑制AKT-mTOR信号进而促进Treg的分化抑制过敏性鼻炎的发生和发展。
过敏性鼻炎是机体接触变应原后主要由IgE介导的鼻黏膜非感染性疾病[1]。过敏性鼻炎是全球范围内发病率较高的过敏性疾病,近20年来我国成人及儿童过敏性鼻炎发病率均呈逐年增加趋势[2],已经严重影响到人类的生活质量、工作效率、精神状态及睡眠等。既往研究认为过敏性鼻炎的发病由Th1细胞、Th2细胞免疫失衡引起,且主要与Th2细胞应答增强有关[3]。但近年来研究显示,过敏性鼻炎发病过程中出现调节性T细胞(Treg)、辅助性T细胞17(Th17)比例下调[4]。Treg被认为是一群具有免疫抑制作用的细胞,主要分泌TGF-β1和IL-10,叉头状转录因子p3(Forkhead box p3,Foxp3)是其重要调控基因[5];Th17细胞是另一种新的T细胞亚群[5],以分泌IL-17A细胞因子为特征,在促进炎症反应和自身免疫性疾病中发挥着重要作用[6]。程序性死亡分子PD-1及其配体PD-L1是CD28/B7超家族的协同刺激分子,介导免疫反应的负性调节信号。PD-1/PD-L1信号途径在Treg细胞增殖、分化以及功能维持中发挥重要作用。同时,有研究证实PD-L1能够通过减弱AKT-mTOR信号诱导初始化T细胞向Treg[7]。
本研究通过建立小鼠过敏性鼻炎的模型,使用PD-L1重组蛋白对其进行干预,检测干预后Treg/Th17平衡的变化,从而揭示PD-L1对过敏性鼻炎小鼠Treg/Th17细胞免疫失衡的调节作用。
材料和方法
1 材料及试剂 6~8周SPF级雄性小鼠BALB/c小鼠30只,购自辽宁长生生物技术有限公司,卵清蛋白(OVA) (美国Sigma公司)、Al(OH)3(天津大茂化学试剂厂),PD-L1重组蛋白(英国Abcam公司),PD-1多克隆抗体(北京博奥森生物技术有限公司),PD-L1多克隆抗体、醇溶的曙红Y(上海生工生物工程有限公司),p-AKT、AKT、mTOR(沈阳万类生物科技有限公司),p-mTOR(美国CST公司),苏木精、DAB显色液(北京索莱宝科技有限公司),生物素化山羊抗兔IgG(上海碧云天生物技术公司),小鼠IL-6、IL-10、IL-17A ELISA试剂盒(杭州联科生物技术股份有限公司),Super M-MLV反转录酶、高纯总RNA快速提取试剂盒、2×Power Taq PCR Master Mix(北京百泰克生物科技有限公司),其余的试剂均为国产分析纯。
2 动物模型及分组 将BALB/c小鼠随机分为三组,每组10只。模型组(AR)、PD-L1重组蛋白干预组(AR+PD-L1)使用卵清蛋白致敏,100 μg OVA+2 mg氢氧化铝溶于0.1 ml生理盐水中,分别于第0、2、4、6、8、10、12、14 d对小鼠进行腹腔注射,之后分别在第15~25 d,予以100 μg OVA(20 μl)滴鼻激发,1次/d。PD-L1重组蛋白干预组在刺激前鼻内滴注PD-L1重组蛋白(10 μg/20 μl),对照组及模型组各阶段注射生理盐水作为对照。末次滴鼻局部刺激后2 h处死小鼠,各组小鼠摘除眼球取血后,取各组鼻粘膜组织。
3 行为学评分 最后一次激发完成后,观察小鼠鼻部症状,如搔鼻、喷嚏、鼻溢液等,按照如下标准记录评分:鼻痒:轻度1分,轻搔鼻几次;重度2分,反复搔鼻不止,到处摩擦;喷嚏1~3个为1分,4~10个为2分,11个以上为3分;清水涕:流到前鼻孔1分;超过前鼻孔2分;流涕满面3分,以累计叠加法记录总分,大于5分表示造模成功。
4 HE染色检观察鼻黏膜组织病理变化 取各组小鼠鼻黏膜组织,常规石蜡包埋并切片,60 ℃温箱中2 h,烘干切片;二甲苯脱蜡,梯度乙醇脱水,苏木素浸染5 min,伊红浸染3 min;常规脱水,透明,干燥,封片,显微镜下观察组织病理变化。
5 免疫组化检测鼻黏膜组织PD-1、PD-L1表达 取各组小鼠鼻黏膜组织,常规石蜡包埋并切片,60 ℃温箱中2 h,烘干切片;二甲苯脱蜡,梯度乙醇脱水,微波加热修复抗原;3% H2O2室温孵育15 min灭活内源性过氧化物酶,山羊血清封闭;加入PD-1和PD-L1一抗,湿盒内4 ℃过夜孵育;山羊二抗孵育30 min,滴加辣根过氧化物酶(HRP)进行标记,DAB显色;苏木素复染,常规脱水,透明,干燥,封片,显微镜下观察染色情况。PD-1、PD-L1均以细胞质呈棕黄色至棕褐色为阳性。
6 Western blot检测鼻粘膜组织p-AKT、p-mTOR、AKT、mTOR的表达 取各组小鼠鼻黏膜组织,提取组织总蛋白,BCA法测定蛋白浓度;取40 μg蛋白样品进行SDS-PAGE电泳,转移到PVDF膜上,5%脱脂乳封闭;加入p-AKT、p-mTOR、AKT、mTOR一抗,4 ℃过夜孵育;加入二抗,37 ℃孵育45 min,ECL显影,β-actin作为内参进行标准化处理。
7 RT-PCR检测鼻粘膜组织Foxp3和RORγt的表达 收集小鼠鼻粘膜组织,总RNA提取试剂盒提取样本总RNA,紫外分光光度测定RNA质量浓度及鉴定纯度。在Super M-MLV反转录酶作用下,将RNA反转录成cDNA。利用Primer 5.0设计上下游引物,引物信息见表1。利用PCR对β-actin、Foxp3和RORγt进行扩增,PCR反应程序为:95 ℃保持5 min使模板DNA充分变性;然后进入扩增循环,在每一个循环中,95 ℃保持20 s使模板变性,52 ℃退火20 s,72 ℃延伸30 s,重复循环36次;25 ℃保持5 min,使产物延伸完整。对扩增产物进行琼脂糖凝胶电泳,凝胶成像系统对得到的凝胶进行拍照。利用Image J软件对核酸电泳照片进行灰度分析,得到各样本中基因的相对表达量。

表1 RT-PCR引物信息
8 ELISA检测血清IL-10、IL-17A、IL-6水平 取各组血清样本,按照ELISA试剂盒说明书检测血清中IL-10、IL-17A、IL-6的水平。
9 统计学方法 所有数据以均数±标准差表示,使用SPSS19.0进行统计学分析,多组间比较采用单因素方差分析,组间两两比较采用t检验,P<0.05为差异具有统计学意义。
结 果
1 行为学评分比较 正常对照组无喷嚏、搔鼻及清水涕症状;模型组频繁搔鼻,喷嚏及清水涕较多;PD-L1重组蛋白组较模型组症状减轻。对照组、模型组、PD-L1重组蛋白干预组行为学评分分别为0、(6.33±1.15)、(3.67±0.58)分,三组间比较差异有统计学意义(P<0.05)。
2 各组鼻粘膜病理组织变化 HE染色结果可见,与正常对照组相比较,模型组和PD-L1重组蛋白干预组的鼻粘膜上皮细胞排列紊乱,上皮层变薄,上皮细胞间连接疏松,上皮层下间质水肿,可见散在大量嗜酸细胞为主的炎症细胞浸润;与模型组相比较,PD-L1重组蛋白干预组鼻粘膜上皮细胞排列较整齐,上皮层变厚,上皮细胞间连接较紧密,嗜酸细胞浸润明显减少(图1)。

3 各组鼻粘膜组织PD-1、PD-L1表达变化 PD-L1通过与其受体PD-1的相互作用,介导免疫反应的负性调节信号,从而诱导免疫抑制。在正常对照组,PD-1和PD-L1在鼻粘膜组织中高表达,并且表达在胞质和胞浆中;在模型组中PD-1和PD-L1的的阳性细胞数明显减少;与模型组相比较,PD-L1重组蛋白干预组中PD-1和PD-L1的阳性细胞数明显增加(图2)。
4 各组鼻粘膜组织p-AKT、p-mTOR、AKT、mTOR的表达 与正常对照组相比,p-AKT、p-mTOR的表达水平升高,AKT、mTOR的表达水平没有明显变化;与模型组相比较,p-AKT、p-mTOR的表达水平下降,AKT、mTOR的表达水平没有明显变化(图3)。
5 各组鼻粘膜组织Foxp3和RORγt表达变化 Foxp3为Treg细胞的重要转录因子,RORγt为Th17细胞特异性转录因子,二者的表达水平能够间接反映Treg/Th17的平衡变化。与正常对照组相比较,模型组和PD-L1重组蛋白干预组Foxp3表达水平显著下降,RORγt表达水平上升;与模型组相比较,PD-L1重组蛋白干预组Foxp3表达水平上升,RORγt表达水平下降(图4)。
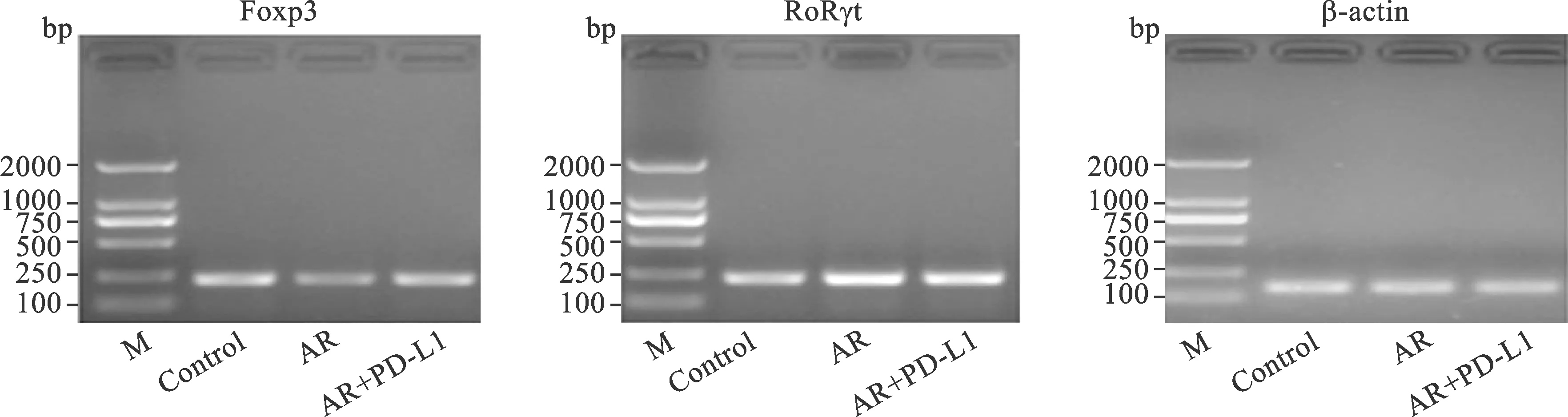
图4 RT-PCR检测鼻粘膜组织中Foxp3和RORγt的表达
6 各组血清中IL-10、IL-17A、IL-6水平变化 与正常对照组相比较,模型组和PD-L1重组蛋白干预组血清IL-10水平下降、IL-17A、IL-6水平上升(P<0.05);与模型组相比较,PD-L1重组蛋白干预组IL-10水平上升,IL-17A、IL-6水平下降(P<0.05)(图5)。
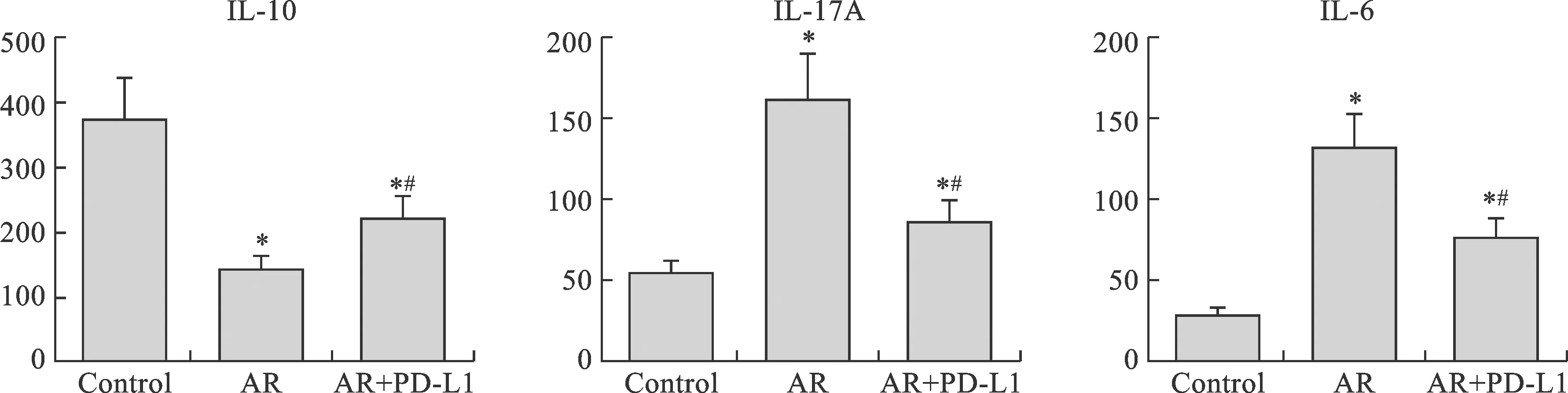
图5 ELISA检测血清中IL-10、IL-17A、IL-6的水平(*P<0.05;与AR组比较,#P<0.05)
讨 论
过敏性鼻炎是由IgE介导的鼻黏膜I型超敏反应。Treg和Thl7是近年来发现的CD4+T细胞亚群。研究表明,Treg/Thl7失衡参与过敏性鼻炎的发病过程[8]。Foxp3是诱导CD4+T向Treg分化的重要转录因子,分化的Treg细胞分泌IL-10和TGF-β,抑制效应性T细胞、树突状细胞和单核巨嗜细胞活化,发挥免疫抑制作用[9]。Th17细胞分泌其中IL-17A与体内广泛表达的受体表达的IL-17受体结合,诱导上皮细胞、成纤维细胞、内皮细胞等靶细胞释放IL-8,IL-6,GM-CSF、TNF-a、CXCL1、CXCL5等前炎症细胞因子、趋化因子,发挥促炎作用[10]。Th17细胞的分化受转录因子RORγt的特异性调控。
PD-1/PD-L1结合负性调控免疫反应,在自身免疫性疾病中发挥重要的作用[11]。PD-L1可通过增强诱导性调节性T细胞(Treg)上Foxp3表达诱导Treg细胞分化,并维持其功能,PD-L1缺失导致体内Treg细胞受损[12]。Sheetal等证实在雌二醇介导的EAE小鼠模型中,敲除PD-L1伴有Th17水平的显著增加[13]。AKT-mTOR在调节CD4+T细胞分化过程中也发挥重要作用,激活AKT-mTOR会维持Th17细胞的稳定和增殖,抑制Treg细胞的产生[14]。有研究表明[15],抗原提呈细胞表面的PD-L1可以通过抑制T细胞中的AKT-mTOR的激活从而促进Treg细胞的分化、维持其功能。田玫[16]等亦证实,PD-L1促进子痫前期CD4+T向Treg分化,并证明通过下调p-AKT、p-mTOR来实现的。说明PD-L1可以通过抑制AKT-mTOR的激活促进Treg细胞的分化。基于PD-1/PD-L1在机体免疫调节中的作用,PD-1与其配体PD-L1介导的信号途径正成为通过免疫干预进行临床疾病治疗的手段之一。
本研究结果显示,PD-L1重组蛋白干预后,能有效缓解小鼠过敏性鼻炎症状,减轻过敏小鼠的鼻粘膜组织损伤,增加程序性死亡分子PD-1及其配体PD-L1的表达,进而增加Treg特异性转录因子Foxp3表达及上调Treg细胞因子IL-10水平,降低Th17转录因子p-AKT、p-mTOR、RORγt表达和下调细胞因子IL-17A和IL-6的水平,表明PD-L1可能通过调节Treg/Th17的比例,抑制过敏性鼻炎的发生。PD-1/PD-L1信号途径有望成为过敏性鼻炎的治疗靶点。
[1] Seidman MD, Gurgel PK, Lin SY,etal. Clinical practice guideline: Allergic rhinitis[J]. Otolaryngol Head Neck Surg, 2015, 152(1S): S1-S43.
[2] Zhang Y, Zhang L. Prevalence of allergic rhinitis in china[J]. Allergy Asthma Immun, 2014, 6(2): 105-113.
[3] Xu F, Yu S,etal. Hydrogen-rich saline Ameliorates allergic rhinitis by reversing the imbalance of Th1/Th2 and up-pegulation of CD4+CD25+Foxp3+Regulatory T Cells, interleukin-10, and membrane-bound transforming crowth factor-β in guinea pigs[J]. Inflammation, 2017,9:11.
[4] Tripathi S, Guleria I. Role of PD-1/PD-L1 pathway and TH17 and treg cells in materna ltolerance to the fetus [J]. Biomed J, 2015, 38 (1): 25-31.
[5] Huang X, HuengY. Chen F,etal. Peripheral Th17/Treg cell-mediated immunity imbalance in allergic rhinitis patients[J]. Brazilian Journal of Otorhinolaryngology, 2014, 80 (2):152-155.
[6] Okamoto K. Regulation of bone by IL-17-producing T cells[J].Nihon Rinsho Meneki Gakkai Kaishi, 2017, 40(5): 361-366.
[7] Francisico LM, Sage PT, Sharpe AH. The PD-1 pathway in tolerance and autoimmunity [J]. Immunol Rev, 2010, 236: 219-224.
[8] Huang X, Chen Y, Zhang F,etal. Peripheral Thl7/Treg cell mediated immunity imbalance in allergic rhinitis patients [J]. Braz J Otorhinol aryngol, 2014, 80(2): 152-155.
[9] Gouveia ACC, Braga FG,etal. Enhanced expression of PD-L1 and IFN-γ on dendritic cells is associated with BCG-induced Th2 inhibition[J]. Cytokine, 2017, 99: 163-172.
[10] Ahn SH, Edwards AK,etal. IL-17A Contributes to the pathogenesis of endometriosis by triggering proinflammatory cytokines and angiogenic growth factors[J]. J Immunol, 2015,195(6): 2591-2600.
[11] Song MY1, Hong CP,etal. Protective effects of Fc-fused PD-L1 on two different animal models of colitis[J]. Gut, 2015, 64(2): 260-271.
[12] Yin X, Ren X, Liu C,etal. The regulatory effect of IL-35 on the balance of Treg/Th17 cells in allergic rhinitis patients [J]. Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2016, 30(3): 213-216.
[13] Bodhankar S, Galipeau T. PD-1 Interaction with PD-L1 but not PD-L2 on B-cells mediates protective effects of estrogen against EAE[J]. J Clin Cell Immunol, 2013, 4(3): 143.
[14] Gulen MF, Bulek K, Inactivation of the enzyme GSK3α by the kinase IKKi promotes AKT-mTOR signaling pathway that mediates interleukin-1-induced Th17 cell maintenance [J]. Immunity, 2012, 37(5): 800-812.
[15] Francisco LM, Salinas VH. PD-L1 regulates the development, maintenance, and function of induced regulatory T cells[J]. J Exp Med, 2009, 206(13): 3015-3029.
[16] 田 玫.子痫前期中PD-1/PD-L1信号信号通路对Treg/Th17免疫平衡的调控机制的研究[D]. 武汉:华中科技大学, 2016.
(收稿:2017-11-06)
TheeffectsofPD-L1onimbalanceofTreg/Th17cellinallergicrhinitisofamurinemodel.
Wang Di,Tang Qiaofei,Jiang Yuqiu,et al.
Otolaryngology Department, Second Affiliated Hospital, Shenyang Medical College (Shenyang 110200)
Objective: To investigate the effects of PD-L1 on imbalance of Treg/Th17 cell in allergic rhinitis (AR) of a murine model. Methods: Thirty BALB/c mice were randomly divided into three groups, ten animals in each.The mice in the model group and PD-L1 recombinant protein group (PD-L1 group) received ovalbumin (OVA) to reduce allergic rhinitis.Then, The mice were intervented with recombinant PD-L1 protein. Mice in the control group were administrated normal saline. Pathological findings of nasal mucosa was analyzed by hematoxylin and eosin stain, The positive cells of PD-1 and PD-L1 in nasal mucosa was analyzed by immunohistochemistry. The expression of Foxp3 and RORγt in nasal mucosa was measured by RT-PCR. The concentration of IL-10, IL-6 and IL-17A in serum was detected by ELISA.Results:The behavioral scores for the control,model and PD-L1 groups were 0,(6.33±1.15),(3.67±0.58)respectively (allP<0.05).serious pathological damage occured in nasal mucosa in model group, whereas damage eased in PD-L1 group. Significantly decreased concentration of PD-1, PD-L1, Foxp3 in nasal mucosa and IL-10 in serum was observed in model group compared with that of the control group (P<0.05), while significantly increased expression of IL-17A, IL-6 in serum and p-AKT、p-mTOR RORγt in nasal mucosa was found (P<0.05). AKT and mTOR change non-significantly and the opposite trends for PD-L1 group compared with the model group(P<0.05). Conclusion: PD-L1 may inhibited AR by inhibiting AKT-mTOR signal pathway and then promoting the differentiation of Treg cells.
Rhinitis,allergic,seasonal/immunology @Recombinant proteins @Regulatory T cells Th17 cells Mice
鼻炎,过敏性,季节性/免疫学 重组蛋白质类 @调节性T细胞 Th17细胞 小鼠
R392.3
A
10.3969/j.issn.1000-7377.2018.03.004

